雷帕霉素对豚鼠形觉剥夺性近视的干预作用及相关机制研究△
李欣蒙 高洪莲 刘奇奇 于睿 张磊
近视是最常见的屈光不正,近年来逐渐出现低龄化、高度近视增加的趋势。有研究表明,近视是全球的第二大致盲病因[1]。高度近视患者除远视力较差外,还可发生不同程度的眼底改变;与正常人相比,发生视网膜脱离、裂孔及黄斑出血的危险性更大[2]。
目前,临床上近视治疗最常应用的药物是低浓度阿托品[3-4],但作为非选择性M型受体阻断剂,长期使用会出现畏光、视物模糊、过敏性结膜炎等不良反应[5],且其具体作用机制及可能发生的远期副作用尚不明确。有研究表明,近视主要是由眼轴增长引起的,巩膜细胞外基质(ECM)的重塑在近视眼轴增长的过程中发挥重要作用。龙琴等[6]研究发现,近视的发生伴有基质金属蛋白酶-2(MMP-2)表达升高,后部巩膜胶原降解增加,进而导致巩膜变薄。有研究指出,转化生长因子β1(TGF-β1)通过调节胶原产生和成纤维细胞增生、刺激巩膜成纤维细胞和软骨细胞增生参与巩膜的重塑[7]。α-平滑肌肌动蛋白(α-SMA)是肌成纤维细胞特征性表达的细胞骨架蛋白,也是肌成纤维细胞最主要的收缩结构,在组织纤维化、伤口愈合、瘢痕形成中均起着重要的作用[8]。这些因子均参与了近视的眼轴增长导致后极部巩膜变薄的过程。有研究表明,哺乳动物雷帕霉素靶蛋白(mTOR)信号通路参与了近视的发生发展[9],雷帕霉素是mTOR信号通路的特异性抑制剂[10],且雷帕霉素可以调节角膜[11]、肝脏[12]、肾脏[13-14]等组织中MMP-2、TGF-β1及α-SMA因子的表达。本实验旨在观察雷帕霉素球结膜下注射对豚鼠形觉剥夺性近视(FDM)的形成是否有干预作用,以及对巩膜组织中MMP-2、TGF-β1及α-SMA等因子表达的影响,研究其可能的作用机制和对视网膜结构的影响,以期为临床上抑制近视的发展寻找新的药物治疗方向提供一定的参考资料。
1 材料与方法
1.1 材料
1.1.1 实验动物2~3周龄健康断乳花色豚鼠80只(山东省济南市西岭角生物科里有限公司),雌雄不限,体质量为200~250 g,采用手持裂隙灯、检眼镜排除眼睑、眼底异常的豚鼠;行屈光及眼轴检查,排除先天性高度近视的豚鼠,于滨州医学院附属医院临床医学实验室动物房饲养,采用日光灯予以照明,明暗周期12 h/12 h,喂养环境维持在22~28 ℃、湿度50%,自由摄食、进水。本实验遵守滨州医学院动物管理委员会的动物福利伦理要求,给予人道主义关怀。
1.1.2 主要试剂及仪器雷帕霉素(HY-10219,Med Chem Express公司);糖原过碘酸-雪夫(PAS)染色试剂盒(北京索莱宝);动物组织总RNA提取试剂盒[天根生化科技(北京)有限公司];反转录试剂盒、荧光定量PCR试剂盒(罗氏公司);AKT兔多克隆抗体、p-AKT-S473小鼠单克隆抗体、mTOR兔多克隆抗体、p-mTOR-Ser2448兔多克隆抗体、GAPDH小鼠单克隆抗体、酶标亲和纯化山羊抗小鼠IgG(H+L)、酶标亲和纯化山羊抗兔IgG(H+L)均购自Proteintech中国公司;BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒(北京碧云天生物科技有限公司);5×蛋白上样缓冲液(大连美仑公司);荧光定量PCR仪(美国伯乐公司)。
1.2 方法
1.2.1 动物分组及处理80只豚鼠采用随机数字表法分为4组,每组20只。空白对照组:双眼不进行任何干预;FDM组:为保证豚鼠正常觅食,左眼不做干预,5-0线缝合右眼眼睑;雷帕霉素组:分别于实验第1天、第7天两次右眼球结膜下注射雷帕霉素50 μg;FDM+雷帕霉素组:分别于实验第 1天、第7天两次右眼球结膜下注射雷帕霉素50 μg后再缝合右眼眼睑。实验组(FDM组、雷帕霉素组、FDM+雷帕霉素组)豚鼠术后给予右眼眼睑换药、涂氧氟沙星眼膏预防感染。
1.2.2 雷帕霉素试剂的配制及豚鼠注药量雷帕霉素溶于DMSO,配制成母液,在无菌操作下用双蒸水稀释,使终浓度为1 g·L-1,按照豚鼠每眼50 μg行球结膜下注射。
1.2.3 豚鼠眼生物学测量指标分别于实验前及实验第7天、第14天测量各组豚鼠的眼轴长度和屈光度。眼轴长度测量采用A型超声波(法国光太公司),测量前使用盐酸丙美卡因滴眼液行表面麻醉,由同一位经验丰富的专业技师进行,连续验光5次,取其平均值。使用手持带光检影镜(重庆康华瑞明科技股份有限公司)进行屈光度测量,测量前使用复方托吡卡胺滴眼液进行豚鼠右眼散瞳,共3次,间隔15 min,由同一位经验丰富的专业技师进行操作,使用带状光检影验光,连续验光5次,取其平均值。
1.2.4 标本收集空白对照组随机选取4只豚鼠、实验组实验第7天、第14天各随机选取2只豚鼠,进行PAS染色和视网膜透射电镜观察;空白对照组随机选取6只豚鼠,实验组实验第7天、第14天各随机选取3只豚鼠,使用颈椎脱臼法处死豚鼠后,摘出右眼眼球,于冰块上快速取后极部巩膜,保存于-80 ℃冰箱。
1.2.5 PAS染色观察各组豚鼠视网膜形态100 g·L-1水合氯醛腹腔过量注射麻醉处死各组豚鼠后取出眼球,保留2 mm视神经,生理盐水冲洗干净后置于冰上去除结膜、筋膜、眼外肌等组织,浸泡于Davidson 固定液固定3 h。沿视神经方向切开眼球,剔除晶状体、玻璃体等眼球内容物,切面朝下放入包埋盒,梯度脱水至蜡后包埋组织。切片厚4 μm,选取靠近视盘的切片进行PAS染色、透明、封片后在光学显微镜下观察。
1.2.6 透射电镜下观察各组豚鼠视网膜形态100 g·L-1水合氯醛腹腔注射麻醉各组豚鼠后,灌注固定至右心房流出的液体颜色变为淡红色时更换体积分数3%戊二醛溶液,至豚鼠四肢及颈部明显僵硬、眼球壁微凹时摘取眼球,用注射器针头在角膜上刺几个孔,进一步固定眼球。沿赤道部环切,保留带有视网膜的后半部眼球(避开黄斑部),将组织切成 1~2 mm长条,体积分数3%戊二醛固定液、10 g·L-1四氧化锇后固定、酒精丙酮梯度脱水、包埋剂浸透过夜后定向包埋,半薄切片铀染、铅染后透射电镜下观察各组豚鼠视网膜形态。
1.2.7 RT-PCR检测各组豚鼠巩膜中mTOR、MMP-2、TGF-β1、α-SMA的mRNA表达按照总RNA提取试剂盒说明书提取各组豚鼠巩膜总RNA,紫外分光光度计测量提取的RNA浓度;进行反转录,合成cDNA;以cDNA为模版进行PCR扩增,引物以β-actin为内参,根据NCBI中所提供的mTOR、MMP-2、TGF-β1、α-SMA序列,由Takara合成引物序列。按2×SYBR Green qPCR Mix说明书设置PCR反应条件,记录Ct值,使用2-△△Ct法进行分析。RT-PCR反应引物序列如下:mTOR上游引物为5’-TTCCGCCTTCACAGATACCC-3’,下游引物为5’-CCTCACAGCCACAGAAAGCA-3’,大小为8621 bp;MMP-2上游引物为5’-TGATAACCTGGATGCCGTTG-3’,下游引物为5’-TGCTTCCAAACTTCACGCTCT-3’,大小为3093 bp;TGF-β1上游引物为5’-TACCCCAGAGTGGTTGTCCTTT-3’,下游引物为5’-ACCGATCCCGTTGATTTCC-3’,大小为1597 bp;α-SMA上游引物为5’-CCCAGAAGAGCATCCAACC-3’,下游引物为5’-ACCGCCTGAATAGCCACATAC-3’,大小为2006 bp;β-actin上游引物为5’-GCTGCGTTACACCCTTTCTTG-3’,下游引物为5’-TCACCTTCACCGTTCCAGTTT-3’,大小为1746 bp。
1.2.8 Western blot检测各组豚鼠巩膜中AKT、p-AKT、mTOR、p-mTOR的蛋白表达取各组豚鼠巩膜置于冰上研磨,加入裂解液裂解15 min,转移至EP管,4 ℃ 12 000 r·min-1离心15 min,取上清液,BCA法测定蛋白浓度,加入5×蛋白上样缓冲液煮沸15 min;电泳、转膜后,70 g·L-1脱脂奶粉中封闭3 h,加入一抗4 ℃孵育过夜,TBST冲洗3次×10 min,加入二抗室温孵育2 h,TBST冲洗3次×10 min,化学发光法(ECL)显影,Image Lab软件分析各组豚鼠巩膜中各因子蛋白表达的灰度值。
1.3 统计学方法本研究使用SPSS 26.0统计学软件分析,实验结果以均数±标准差表示,采用多组间单因素方差分析,两组间均数采用LSD-t检验分析。检验水准:α=0.05。
2 结果
2.1 各组豚鼠眼生物学指标比较实验开始前80只豚鼠右眼均呈远视状态,4组豚鼠间右眼眼轴长度、屈光度差异均无统计学意义(均为P>0.05)。实验第7天、第14天,FDM组豚鼠眼轴长度和屈光度均大于空白对照组,差异均有统计学意义(均为P<0.05);雷帕霉素组与空白对照组相比,豚鼠眼轴长度和屈光度差异均无统计学意义(均为P>0.05)。实验第7天,FDM+雷帕霉素组与FDM组相比,豚鼠眼轴长度和屈光度差异均无统计学意义(P=0.081、0.062);实验第14天,FDM+雷帕霉素组豚鼠眼轴长度和屈光度均小于FDM组,且差异均有统计学意义(均为P<0.05)(见表1)。
2.2 各组豚鼠视网膜形态比较
2.2.1 PAS染色观察各组豚鼠视网膜形态各组豚鼠PAS染色后光学显微镜下观察发现(见图1),空白对照组、雷帕霉素组豚鼠视网膜各层结构清晰,染色均匀,内、外界膜明显,外核层厚,细胞质较少,核小而密集,蓝色深染,内核层细胞较外核层薄,细胞多层排列稍稀疏,细胞核大着色较深;节细胞体积较大,单层排列,细胞体圆形或锥形,细胞质丰富,核大浅染。实验第7天,FDM组与空白对照组相比,视网膜较薄,外核层稍变薄,细胞体变小,排列稍紊乱,内核层细胞层数及数量减少,节细胞数量减少;FDM+雷帕霉素组与空白对照组相比,外核层细胞排列稍紊乱,外丛状层染色变浅。实验第14天,FDM组视网膜各层形态学改变更加明显,视网膜各层厚度明显变薄,内外丛状层及神经纤维层染色浅,内外核层细胞排列紊乱、稀疏,细胞层数明显减少,节细胞可见脱失,残留细胞多数体积变小,核固缩,细胞质染色变浅,可见空泡。FDM+雷帕霉素组实验第14天较第7天时视网膜形态未见明显改变。
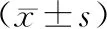
表1 各组豚鼠不同时间点右眼眼轴长度、屈光度比较

图1 不同时间点各组豚鼠视网膜PAS染色结果 A:空白对照组;B:雷帕霉素组实验第7天;C:雷帕霉素组实验第14天;D:FDM组实验第7天;E:FDM组实验第14天;F:FDM+雷帕霉素组实验第7天;G:FDM+雷帕霉素组实验第14天。
2.2.2 透射电镜观察各组豚鼠视网膜形态各组豚鼠视网膜透射电镜下观察发现(见图2),空白对照组、雷帕霉素组实验第7天和第14天,视网膜结构正常,各层结构排列紧密。实验第7天,FDM组视锥、视杆细胞膜盘间隙不均、轻度水肿,部分脱落、变短;内丛状层和外丛状层轻微水肿;内核层细胞和节细胞胞质水肿,少量空泡样改变。实验第14天,FDM组各层结构间隙增大,可见细胞水肿、胞质空泡样改变。实验第7天、第14天,FDM+雷帕霉素组各层间结构稍疏松,其余未见明显异常。
2.3 各组豚鼠巩膜中不同因子mRNA的表达实验第7天、第14天,与空白对照组相比,FDM组豚鼠巩膜中mTOR mRNA相对表达量差异均无统计学意义(均为P>0.05),MMP-2、α-SMA的mRNA相对表达量均增多,TGF-β1 mRNA相对表达量减少,差异均有统计学意义(均为P<0.05)。雷帕霉素组与空白对照组相比、FDM+雷帕霉素组与FDM组相比,豚鼠巩膜中mTOR、MMP-2、α-SMA的mRNA相对表达量均减少,TGF-β1 mRNA相对表达量均增多,差异均有统计学意义(均为P<0.05)(见表2)。
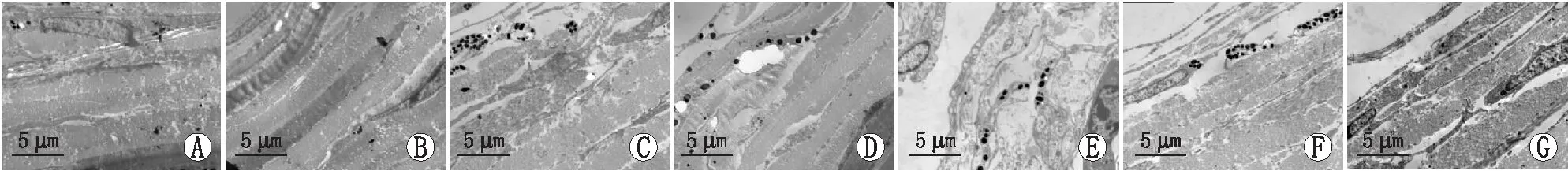
图2 不同时间点各组视网膜透射电镜观察结果 A:空白对照组;B:雷帕霉素组实验第7天;C:雷帕霉素组实验第14天;D:FDM组实验第7天;E:FDM组实验第14天;F:FDM+雷帕霉素组实验第7天;G:FDM+雷帕霉素组实验第14天。
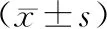
表2 各组豚鼠巩膜中不同时间点各因子mRNA相对表达量
2.4 各组豚鼠巩膜中不同因子蛋白的表达Western blot检测结果显示,实验第7天、第14天,FDM组与空白对照组相比,豚鼠巩膜中AKT、p-AKT、mTOR、p-mTOR的蛋白表达量差异均无统计学意义(均为P>0.05);雷帕霉素组与空白对照组相比、FDM+雷帕霉素组与FDM组相比,豚鼠巩膜中AKT、p-AKT、mTOR、p-mTOR的蛋白表达量均减少,且差异均有统计学意义(均为P<0.05)(见表3、图3)。
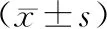
表3 实验第7天、第14天各组豚鼠巩膜中各因子蛋白的相对表达量

图3 Western blot检测各组豚鼠巩膜中不同因子蛋白表达 A:实验第7天Western blot电泳图;B:实验第14天Western blot电泳图。
3 讨论
目前多数研究认为,巩膜ECM重塑是近视眼轴增长的主要原因。在近视的形成与发展中,巩膜的机械特性影响了眼轴的形态。MMP-2可降解I型胶原纤维,介导巩膜生物力学强度下降,导致其胶原结构变薄、ECM成分改变,在FDM小鼠模型中,MMP-2 mRNA和蛋白表达均升高[15]。TGF-β1参与调节纤维母细胞增殖、ECM和胶原纤维的形成。有研究表明,FDM会引起大鼠巩膜组织中TGF-β1的蛋白和mRNA表达降低[16]、鸡视网膜和脉络膜中TGF-β1活性下降[17],引起巩膜主动重塑;高活性的TGF-β1可升高TIMP-2的表达,间接抑制MMP-2的活性,导致巩膜厚度增加、抑制胶原的降解[18]。α-SMA是肌成纤维细胞特征性表达的细胞骨架蛋白,也是肌成纤维细胞最主要的收缩结构[7],成纤维细胞向肌成纤维细胞转化受到组织应力和TGF-β调控[19];且α-SMA在近视眼发育过程中肌成纤维细胞表型的变化与创面愈合过程中发生的变化不同[20]。以往有研究表明,在小鼠、树鼩模型中,近视巩膜细胞中α-SMA表达增加[21-22]。
雷帕霉素是一种大环内酯类免疫抑制药物,具有疗效好、毒性低、无肾毒性的特点。Lewis鼠结膜下注射雷帕霉素的研究发现[23],注射200 μg·kg-1及以下剂量不会引起眼组织结构及视网膜功能的异常,且雷帕霉素对缺氧损伤视网膜神经节细胞有保护作用[24]。本实验中豚鼠球结膜下注射50 μg雷帕霉素,结果发现,对于正常豚鼠视网膜形态没有影响,而对FDM豚鼠的视网膜形态改变有一定的改善作用;应用雷帕霉素后,豚鼠巩膜组织中MMP-2、α-SMA的mRNA相对表达量减少,TGF-β1 mRNA相对表达量增多,与近视眼轴变长时MMP-2、α-SMA的mRNA相对表达量增多、TGF-β1 mRNA相对表达量减少的变化趋势相反[6-8],说明雷帕霉素可以调节近视相关因子的表达来抑制FDM。雷帕霉素的特异性结合蛋白是哺乳动物mTOR,PI3K/AKT/mTOR是mTOR的经典信号转导通路[25],活化的mTOR通过介导下游靶分子来发挥生物学作用。本实验中Western blot检测结果显示,球结膜下注射雷帕霉素后,雷帕霉素组与空白对照组相比、FDM+雷帕霉素组与FDM组相比,巩膜组织中AKT、p-AKT、mTOR、p-mTOR的蛋白表达量均减少,说明可能是通过结合PI3K/AKT/mTOR信号通路发挥了抑制近视的作用。
本实验中还发现,单纯缝合豚鼠眼睑7 d即可诱导出相对近视,雷帕霉素抑制了FDM诱导的近视进展,眼轴延长变慢、屈光度减小,而不改变正常的眼睛发育;实验第7天,FDM+雷帕霉素组与FDM组相比,眼轴长度和屈光度差异虽均无统计学意义,但FDM+雷帕霉素组豚鼠眼轴长度及屈光度较FDM组略有减少;实验第14天,FDM+雷帕霉素组与FDM组相比,豚鼠眼轴长度和屈光度的减少差异均有统计学意义(均为P<0.05),这表明随着注药次数的增加及作用时间的延长,雷帕霉素逐渐发挥作用,能抑制近视的进展,但并不能完全抑制近视。
本实验周期较短,给药次数及注药剂量均存在一定局限性,长期应用是否会产生副作用尚不明确;且未设置近视形成后加用雷帕霉素的组别,明确其是否可以停止或延缓近视的发展;蛋白水平只是证实了经典的PI3K/AKT/mTOR信号通路,未研究是否与其他近视信号通路存在关联;雷帕霉素结合mTOR后下游信号的变化机制是否与激活自噬[26]相关,这些还需在此实验基础上进一步研究,进而为雷帕霉素应用于临床近视的治疗提供实验基础。
致谢:感谢滨州医学院附属医院临床实验室董洪亮老师在电镜实验中给予的帮助!

