2种类型膜荚黄芪主要药效成分含量及关键酶基因表达量差异研究
姚萱航,刘翠晶,常晶茹,张雪薇,刘 霞
2种类型膜荚黄芪主要药效成分含量及关键酶基因表达量差异研究
姚萱航,刘翠晶,常晶茹,张雪薇,刘 霞*
吉林农业大学中药材学院 省部共建生态恢复与生态系统管理国家重点实验室,吉林 长春 130118
以2年生2种类型膜荚黄芪(绿茎有毛膜荚黄芪、紫茎有毛膜荚黄芪)根、茎、叶为实验材料,探究其主要药效成分含量及其生物合成途径中关键酶基因表达量的差异,为药材膜荚黄芪资源合理利用及其优良品种选育选育提供科学的理论参考。使用HPLC检测膜荚黄芪根、茎、叶中黄芪甲苷与毛蕊异黄酮葡萄糖苷的含量,使用紫外分光光度计检测膜荚黄芪根、茎、叶中总皂苷含量,采用实时荧光定量PCR检测其根中皂苷生物合成过程中关键酶乙酰辅酶A乙酰基转移酶(AATC)、3-羟基-3-甲基戊二酰辅酶A合酶(HMGS)、3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)、异戊二烯焦磷酸异构酶(IDI)、法尼基焦磷酸合酶(FPS)、鲨烯合酶(SS)、鲨烯环氧酶(SE)、环阿尔庭烷合酶(CAS)基因的表达量。紫茎膜荚黄芪根中黄芪甲苷含量始终高于绿茎膜荚黄芪;在生殖生长期时,绿茎膜荚黄芪根中毛蕊异黄酮葡萄糖苷含量高于紫茎膜荚黄芪,而枯萎期二者变化浮动较大;绿茎膜荚黄芪根中总皂苷含量普遍高于紫茎膜荚黄芪。、、基因表达量与绿茎膜荚黄芪总皂苷含量呈显著相关(<0.05),基因表达量与总皂苷含量呈极显著相关(<0.01),说明这4个基因在绿茎膜荚黄芪总皂苷合成中具有重要影响;基因与紫茎膜荚黄芪总皂苷呈显著相关(<0.05),其他基因与紫茎膜荚黄芪皂苷含量均有相关性,但未达到显著水平。探究了2种类型黄芪3种主要药效成分的动态变化和皂苷类化合物关键酶基因的表达,为黄芪皂苷类化合物合成生理生态机制的明晰、膜荚黄芪资源合理利用及优良品种选育提供了科学的理论依据。
膜荚黄芪;黄芪甲苷;总皂苷;毛蕊异黄酮葡萄糖苷;关键酶基因
黄芪为豆科多年生草本植物膜荚黄芪(Fisch.) Bunge.或蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao的干燥根[1],始载于《神农本草经》,用药历史已2000多年,为我国传统大宗中药材之一。《中国药典》2015年版中规定以黄芪甲苷和毛蕊异黄酮葡萄糖苷的含量作为黄芪药材质量标准,其中,按干燥品计算,含黄芪甲苷不得少于0.040%、含毛蕊异黄酮葡萄糖苷不得少于0.020%。
近几十年,随着人民生活水平的改善和医疗保健水平的提高,黄芪药材市场需求量持续增加,主流品种为膜荚黄芪和蒙古黄芪两种商品规格,其中约有50%用于生产黄芪饮片,近50%用于中成药和提取物及制剂[2],由于黄芪用量很大,加之野生资源的枯竭及再生能力的下降,我国北方多省均有人工引种[3]。在长期的栽培过程中,受生态环境、种子混杂、质量参差不齐以及栽培技术不完善等因素的影响,使人工栽培的膜荚黄芪群体中出现了丰富的形态多样性,具有不同的种内类型[4],主要为茎秆颜色呈绿色的绿茎膜荚黄芪和茎秆颜色呈紫色的紫茎膜荚黄芪2种。
黄芪中主要含有皂苷类、黄酮类、多糖类、氨基酸类等活性成分,黄芪皂苷类成分具有促进细胞增殖、合成抗体、强心、抗心力衰竭、抗炎、抑制胶原合成等作用;黄酮类成分能够增强心肌收缩力,对细胞免疫功能具有促进作用,黄芪多糖有明显的抗疲劳、抗肿瘤作用;据相关文献报道,黄芪中含有一种微量元素硒能提高谷胱甘肽过氧化物酶活性,激活解毒酶系,从而对肝细胞起保护作用[5-7]。
遗传因素对中药材质量的形成具有重要作用,目前已有研究发现黄芪皂苷的合成通路及其合成过程中的关键酶基因,甲羟戊酸途径是药用植物黄芪黄芪皂苷类次生代谢产物主要合成途径[8-9],关键酶基因主要包括:乙酰辅酶A乙酰基转移酶(acetoacetyl-co zyme A (CoA) thiolase,AACT);3-羟基-3-甲基戊二酰辅酶A合酶(HMG-CoA synthase,HMGS);3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase,HMGR);异戊二烯焦磷酸异构酶(iso-pentenyl diphosphate isomerase,IDI);法尼基焦磷酸合酶(farnesyl diphosphate synthase,FPS);鲨烯合酶(squalene synthase,SS);鲨烯环氧酶(squalene epoxidase,SE);环阿尔庭烷合酶(cycloartenol synthase,CAS)等。皂苷合成过程中,AACT、HMGR直接催化生成甲羟戊酸(mevalonic acid,MVA);SS、SE催化形成2,3-氧化角鲨烯,导致三萜骨架环化;CAS催化2,3-氧化角鲨烯导致环化反应形成,这些酶基因均为黄芪皂苷合成过程中重要的限速酶[10-11]。
本研究以2年生2种类型膜荚黄芪为实验材料,测定了不同时期膜荚黄芪样品的黄芪甲苷、毛蕊异黄酮葡萄糖苷和总皂苷含量及其皂苷生物合成8种关键酶基因相对表达量的动态变化,并将2种类型膜荚黄芪皂苷含量与关键酶基因表达量进行了Pearson相关性分析,以期确定2种类型膜荚黄芪的质量差异及原因,为膜荚黄芪优良品种选育及其药用资源合理利用提供科学的理论依据和参考。
1 材料与仪器
1.1 材料
实验材料为二年生膜荚黄芪(绿茎有毛型、紫茎有毛型),样品于2017-09-06~2017-10-11在吉林农业大学药用植物园采集,由吉林农业大学刘霞副教授鉴定为豆科黄芪属膜荚黄芪(Fisch.) Bunge.。样地地理位置东经125°24'59'',北纬43°48'24'',海拔高度251 m。百泰克植物多糖多酚总RNA提取试剂盒,百泰克反转录试剂盒(北京百泰克生物有限公司),SYBR Premix Ex Taq TM Ⅱ试剂盒(DRR081A,日本TaKaRa有限公司),黄芪甲苷对照品(批号20633-67-5)购于上海源叶生物科技有限公司,毛蕊异黄酮葡萄糖苷对照品(质量分数>98%,批号20633-67-4)购于北京索莱宝公司,乙腈,甲醇为色谱纯,乙醇、冰醋酸、香草醛、高氯酸以及其他试剂均为分析纯,蒸馏水。
1.2 仪器
AUY220电子天平;GZX-9070MBE电热鼓风干燥箱;DL-820E智能超声波清洗器(上海之信仪器有限公司);Agilent1260高效液相色谱仪(Agilent,美国);依利特ODS柱(250 mm×4.6 mm,5μm);ProFlex™梯度PCR扩增仪(Applied Biosystems,美国);Mx3000P实时荧光定量PCR仪(Agilent,美国);NanoDrop 2000核酸/蛋白定量仪(Thermo,美国);DYY-8C型电泳仪(北京六一电泳厂);Tanon Gis-2010凝胶成像系统[天能科技(上海)有限公司];电热恒温水浴锅(北京市永光明医疗仪器有限公司);高速离心机(美国Thermo公司),高速万能打粉机(天津泰斯特仪器有限公司)。
2 方法
2.1 样品的采集与处理
膜荚黄芪样品于2017年9月6日~2017年10月11日采集自吉林省长春市吉林农业大学药用植物园,采用五点采样法每5天取样1次,采集膜荚黄芪样品,低温运输至实验室,冷冻保存部分样品。将剩余样品烘干至恒定质量,粉碎过100目筛,以便后续实验。
2.2 膜荚黄芪黄芪甲苷含量测定
2.2.1 供试品溶液的制备 精确称量2种类型的膜荚黄芪样品1.00 g,加入15 mL甲醇超声提取30 min,提取3次,合并滤液,用蒸发皿在水浴锅中65 ℃下蒸发溶剂,加入甲醇溶解,随后将提取物离心,定容至1 mL,选择0.22 μm 微孔滤膜滤过上清液,即得供试品溶液。
2.2.2 对照品溶液的制备 精确称量黄芪甲苷对照品2.53 mg置于10 mL量瓶中,加少量甲醇溶解,定容,摇匀,即得对照品溶液。
2.2.3 色谱条件[12]Agilent 1260型高效液相色谱仪UV检测器;色谱柱:依利特Hypersil ODS(250 mm×4.6 mm,5 μm)柱;洗脱条件:等度洗脱;流动相:乙腈-水=38:62;体积流量为1.0 mL/min;检测波长203 nm;柱温30 ℃;进样量10 μL;检测时间30 min。色谱图见图1。
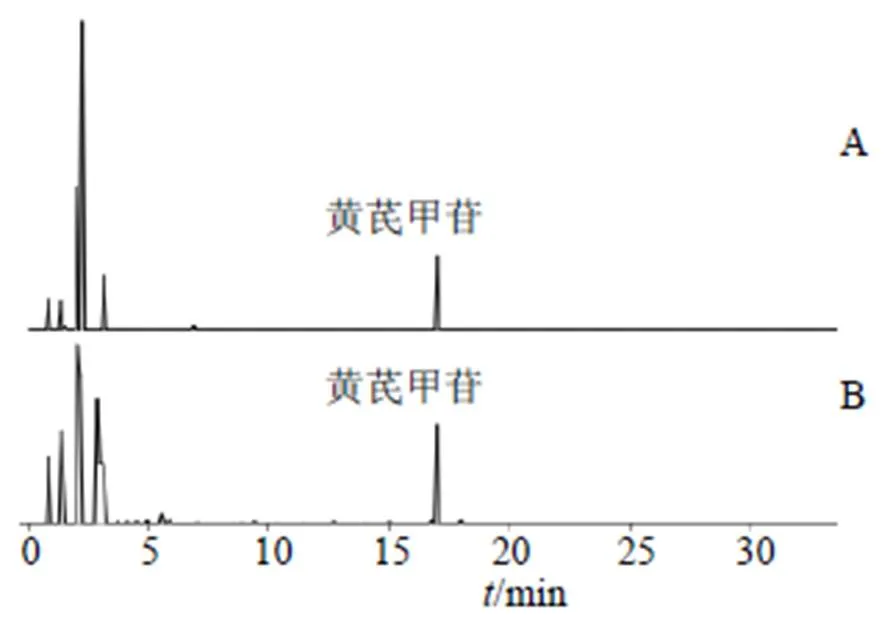
图1 对照品(A)和供试品(B) 溶液的高效液相色谱图
2.2.4 线性方程的绘制 以质量分数为横坐标(),峰面积为纵坐标(),根据文献报道方法[13]绘制线性方程=447.1-1.010 5,2=0.995,计算黄芪甲苷含量。
2.2.5 精密度试验 吸取黄芪甲苷对照品溶液,在“2.2.3”项色谱条件下重复进样6次,每次进样10 μL,计算黄芪甲苷峰面积的RSD值为1.64%,说明实验仪器的精密度较好。
2.2.6 稳定性试验 取同一份药材样品,按照“2.2.1”项的方法制备供试品溶液,在室温下分别于 0、2、4、6、8、12、24 h内进行测定,以峰面积为指标计算黄芪甲苷的RSD值为1.37%,说明供试品溶液能在24 h内保持稳定。
2.2.7 重复性试验 取黄芪粉1.0g,按照“2.2.1”项平行制备6份供试品溶液,在“2.2.3”项色谱条件下进行分析,计算黄芪甲苷质量分数的RSD值为1.82%,说明实验重复性较好。
2.2.8 加样回收率试验 取同一批黄芪样品6份,每份样品1.0 g,加入黄芪甲苷对照品甲醇溶液1 mL,室温挥干,按照“2.2.1”项制备供试品溶液,测定,加样回收率为98.8%,RSD值小于3%。
2.3 膜荚黄芪毛蕊异黄酮葡萄糖苷含量测定
2.3.1 供试品溶液的制备 以“2.2.1”项中提取的滤液为供试品。
2.3.2 对照品溶液的制备 精确称量毛蕊异黄酮葡萄糖苷标准品2.21 mg,置于10 mL量瓶中,加少量甲醇溶解,定容,摇匀,即得对照品溶液。
2.3.3 色谱条件 Agilent 1260型高效液相色谱仪UV检测器;色谱柱:安捷伦C18(250 mm×4.6 mm,5 μm)柱;梯度洗脱,0~20 min,20%~40%乙腈;20~30 min,40%乙腈;流动相为乙腈-0.2%甲酸溶液;体积流量1.0 mL/min;检测波长260 nm;柱温30 ℃;进样量10 μL,检测时间30 min。色谱图见图2。

图2 对照品 (A) 和供试品(B) 溶液的高效液相色谱图
2.3.4 线性方程的绘制 以对照品溶液浓度为横坐标(),峰面积为纵坐标(),绘制线性方程:=25.735-3.297 2,2=0.999 2,计算毛蕊异黄酮葡萄糖苷含量。
2.3.5 精密度试验 吸取毛蕊异黄酮葡萄糖苷对照品溶液,在“2.3.3”项色谱条件下重复进样6次,每次进样10 μL,计算毛蕊异黄酮葡萄糖苷峰面积的RSD值为1.33%,说明实验仪器的精密度较好。
2.3.6 稳定性试验 取同一份药材样品,按照“2.2.1”项的方法制备供试品溶液,在室温下分别于 0、2、4、6、8、12、24 h进行测定,以峰面积为指标计算毛蕊异黄酮葡萄糖苷的RSD值为1.84%,说明供试品溶液能在24 h内保持稳定。
2.3.7 重复性试验 取黄芪粉1.0 g,按照“2.2.1”平行制备6份供试品溶液,在“2.3.3”项色谱条件下进行分析,以峰面积为指标计算毛蕊异黄酮葡萄糖苷的RSD值为1.75%,说明实验重复性较好。
2.3.8 加样回收率试验 称取同一批黄芪样品6份,每份样品1.0 g,加入毛蕊异黄酮葡萄糖苷对照品溶液1 mL,室温挥干,按照“2.2.1”项制备供试品溶液,测定,加样回收率为99.5%,RSD值小于3%。
2.4 总皂苷含量测定
2.4.1 供试品溶液的制备 精确称量2种类型的膜荚黄芪样品1.00 g,加入15 mL 80%乙醇超声提取30 min,提取3次,合并滤液。用蒸发皿在水浴锅中65℃下蒸发溶剂,加入80%甲醇溶解,随后将提取物离心,挥干溶液,定容至5 mL,即得供试品溶液。
2.4.2 对照品溶液制备 精密称取黄芪甲苷对照品5 mg,置于10 mL量瓶中,加少量甲醇溶解,定容,摇匀,即得对照品溶液。
2.4.3 测定波长的选择 取对照品溶液、供试品溶液适量,加入5%香草醛-冰醋酸试液0.2 mL,高氯酸溶液0.8 mL,充分振摇混匀后置于60 ℃恒温水浴上加热20 min,立即用冰水冷却至室温,再加入5 mL冰醋酸溶液,摇匀。以试剂作空白,采用紫外分光光度法在200~700 nm进行扫描,于570 nm波长处有最大吸收。
2.4.4 线性方程的绘制 以吸光度为纵坐标()、浓度为横坐标(),绘制标准曲线,根据标准曲线方程:=17.846 4+0.104 38,2=0.999 7,计算总皂苷含量。
2.5 膜荚黄芪根组织总RNA的提取
将保存在−80 ℃的膜荚黄芪根组织样品在液氮中充分研磨至粉末状,利用多糖多酚植物总RNA提取试剂盒提取总RNA,研磨样品约30 min,在研磨过程中,注意试验环境的卫生状况以免样品感染,最好选择在冰上操作,以加大提取总RNA试验的成功率。利用NanoDrop2000检测仪测定膜荚黄芪根、茎、叶组织中RNA浓度,并对提取得到的总RNA进行完整性检测。选用 M-MuLV第1链cDNA合成试剂盒,按试剂盒中提供的操作步骤将总RNA逆转录合成cDNA,并于−20 ℃保存备用。
2.6 引物设计
根据GenBank数据库中已经公布的AATC、 HMGS、HMGR、IDI、FPS、SS、SE、CAS,以18S RNA为内参基因,合成引物(上海生物工程技术有限公司),引物序列见表1。
2.7 关键酶基因表达量的测定
膜荚黄芪组织的cDNA为模板,18S RNA为内参基因,根据表1中各基因的引物序列,分别对、、、、、、和基因进行RT-PCR扩增,重复3次,采用2−ΔΔCt法分析结果。生物合成途径关键酶基因表达量以膜荚黄芪根中表达量为参照。PCR反应体系为:灭菌水7.4 µL,SYBR® Premix Ex TaqTM 10 µL,正反引物各0.8 µL,cDNA模板1.0 µL,共20 µL的反应体系。RT-PCR反应程序为:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,反应40个循环。

表1 基因序列引物
2.8 数据分析
试验所得数据采用Excel 2010、SPSS和GraphPad Prism6等软件进行处理
3 结果与分析
3.1 2种类型膜荚黄芪黄芪甲苷含量
2种类型膜荚黄芪根、茎、叶黄芪甲苷含量见图3。图3-A为绿茎膜荚黄芪根、茎、叶中黄芪甲苷含量,与其他部位相比,黄芪甲苷在根中含量最高,茎、叶次之,在9月21日绿茎膜荚黄芪根、茎中黄芪甲苷含量最高,分别为0.19%、0.11%,9月11日叶中黄芪甲苷含量最高为0.07%。图3-B为紫茎膜荚黄芪根、茎、叶中黄芪甲苷含量,在不同部位中黄芪甲苷含量表现为:根>叶>茎,在9月21日根、叶中黄芪甲苷含量最高,分别为0.27%、0.13%,10月11日茎中黄芪甲苷含量最高为0.07%。图3-C为2种类型膜荚黄芪根中黄芪甲苷含量,除9月26日与10月1日外,10月11日2种类型膜荚黄芪根中黄芪甲苷含量差异显著(<0.05),其余皆表现为两种类型膜荚黄芪黄芪甲苷含量差异极显著(<0.01),9月16日黄芪甲苷含量差值最大,紫茎膜荚黄芪黄芪甲苷含量最高为绿茎膜荚黄芪的2.3倍。图3-D为2种类型膜荚黄芪茎中黄芪甲苷含量,10月11日2种类型膜荚黄芪茎中黄芪甲苷含量差异显著(<0.05),9月6日、9月21日、9月26日茎中黄芪甲苷含量差异极显著(<0.01),9月21日茎中黄芪甲苷含量差异最大,绿茎膜荚黄芪茎中黄芪甲苷含量最高为紫茎膜荚黄芪的2.9倍。图3-E为2种类型膜荚黄芪叶中黄芪甲苷含量,9月6日、9月16日、10月6日两者叶中黄芪甲苷含量表现为:差异显著(<0.05),9月21日表现为差异极显著(<0.01),紫茎膜荚黄芪叶中黄芪甲苷含量最高为绿茎膜荚黄芪的3.02倍。
3.2 2种类型膜荚黄芪毛蕊异黄酮葡萄糖苷含量
2种类型膜荚黄芪根、茎及叶中毛蕊异黄酮葡萄糖苷含量见图4。图4-A为绿茎膜荚黄芪根、茎、叶中毛蕊异黄酮葡萄糖苷含量,与其他部位相比,毛蕊异黄酮葡萄糖苷在根中含量最高,茎中最少,叶次之,9月21日绿茎膜荚黄芪根中毛蕊异黄酮葡萄糖苷含量最高为0.25%,10月11日茎中毛蕊异黄酮葡萄糖苷含量最高为0.07%,9月6日叶中毛蕊异黄酮葡萄糖苷含量最高为0.13%。图4-B为紫茎膜荚黄芪根、茎、叶中毛蕊异黄酮葡萄糖苷含量,在不同部位中毛蕊异黄酮葡萄糖苷含量大致表现为根>叶>茎,9月21日根、茎中毛蕊异黄酮葡萄糖苷含量最高,分别为0.14%、0.07%,10月6日叶中毛蕊异黄酮葡萄糖苷含量最高为0.15%。图4-C为2种类型膜荚黄芪根中毛蕊异黄酮葡萄糖苷含量,除9月6日、10月1日、10月11日外,其余皆表现为2种类型膜荚黄芪毛蕊异黄酮葡萄糖苷含量差异极显著(<0.01),10月6日毛蕊异黄酮葡萄糖苷含量差值最大,绿茎膜荚黄芪毛蕊异黄酮葡萄糖苷含量最高为紫茎膜荚黄芪的2.3倍。图4-D为2种类型膜荚黄芪茎中毛蕊异黄酮葡萄糖苷含量,除10月6日外,其余皆表现为毛蕊异黄酮葡萄糖苷含量差异极显著(<0.01),9月21日茎中毛蕊异黄酮葡萄糖苷含量差异最大,紫茎膜荚黄芪茎中毛蕊异黄酮葡萄糖苷含量最高为绿茎膜荚黄芪的1.7倍。图4-E为2种类型膜荚黄芪叶中毛蕊异黄酮葡萄糖苷含量,除9月16日外,9月26日两者叶中毛蕊异黄酮葡萄糖苷含量表现为:差异显著(<0.05),其余皆表现为差异极显著(<0.01),紫茎膜荚黄芪叶中毛蕊异黄酮葡萄糖苷含量最高为绿茎膜荚黄芪的2.3倍。

1-9月6日 2-9月11日 3-9月16日 4-9月21日 5-9月26日 6-10月1日 7-10月6日 8-10月11日 不同小写字母表示基因表达量差异显著(P<0.05);*相关性显著(P<0.05);**相关性极显著(P<0.01),下同
3.3 2种类型膜荚黄芪总皂苷含量
2种类型膜荚黄芪根、茎及叶中总皂苷含量见图5。图5-A为绿茎膜荚黄芪根、茎、叶中总皂苷含量,结果表明:生殖生长期时绿茎膜荚黄芪总皂苷含量叶>根>茎,枯萎期总皂苷含量表现为根>叶>茎。图5-B为紫茎膜荚黄芪根、茎、叶中总皂苷含量,在不同部位中总皂苷含量表现为:生殖生长期时茎中总皂苷含量较高,枯萎期时根中总皂苷含量较高。图5-C为2种类型膜荚黄芪根中总皂苷含量,除10月1日与10月11日外,9月16日、9月26日2种类型膜荚黄芪根中总皂苷含量差异显著(<0.05),其余皆表现为两种类型膜荚黄芪总皂苷含量差异极显著(<0.01),10月6日总皂苷含量差值最大,绿茎膜荚黄芪总皂苷含量最高为紫茎膜荚黄芪的4.2倍。图5-D为2种类型膜荚黄芪茎中总皂苷含量,10月6日、10月11日两种类型膜荚黄芪茎中总皂苷含量差异显著(<0.05),9月21日、9月26日茎中总皂苷含量差异极显著(<0.01),9月21日茎中总皂苷含量差异最大,紫茎膜荚黄芪茎中总皂苷含量最高为绿茎膜荚黄芪的2.6倍。图5-E为2种类型膜荚黄芪叶中总皂苷含量,除9月26日外,9月21日、10月1日两者叶中总皂苷含量表现为差异显著(<0.05),其余表现为差异极显著(<0.01),9月11日两者差异最大,绿茎膜荚黄芪叶中总皂苷含量最高为紫茎膜荚黄芪的3.5倍。
3.4 2种类型膜荚黄芪皂苷合成关键酶基因表达量
2种类型膜荚黄芪皂苷合成关键酶基因表达量见图6。在绿茎膜荚黄芪与紫茎膜荚黄芪根中,基因在生殖生长期均有较高的表达,而在枯萎期,基因表达量降低;绿茎膜荚黄芪根中S基因表达呈变化趋势,而基因在9月16日紫茎黄芪根中表达量急剧升高,显著高于该基因在各个时间段的绿茎与紫茎膜荚黄芪根中的表达量;基因在两种类型膜荚黄芪生殖生长期均有较高的表达量,后期表达量不高的特点。基因在2种类型膜荚黄芪根中表达量基本一致,无明显差异;基因与基因在紫茎膜荚黄芪根中表达量普遍高于绿茎膜荚黄芪。
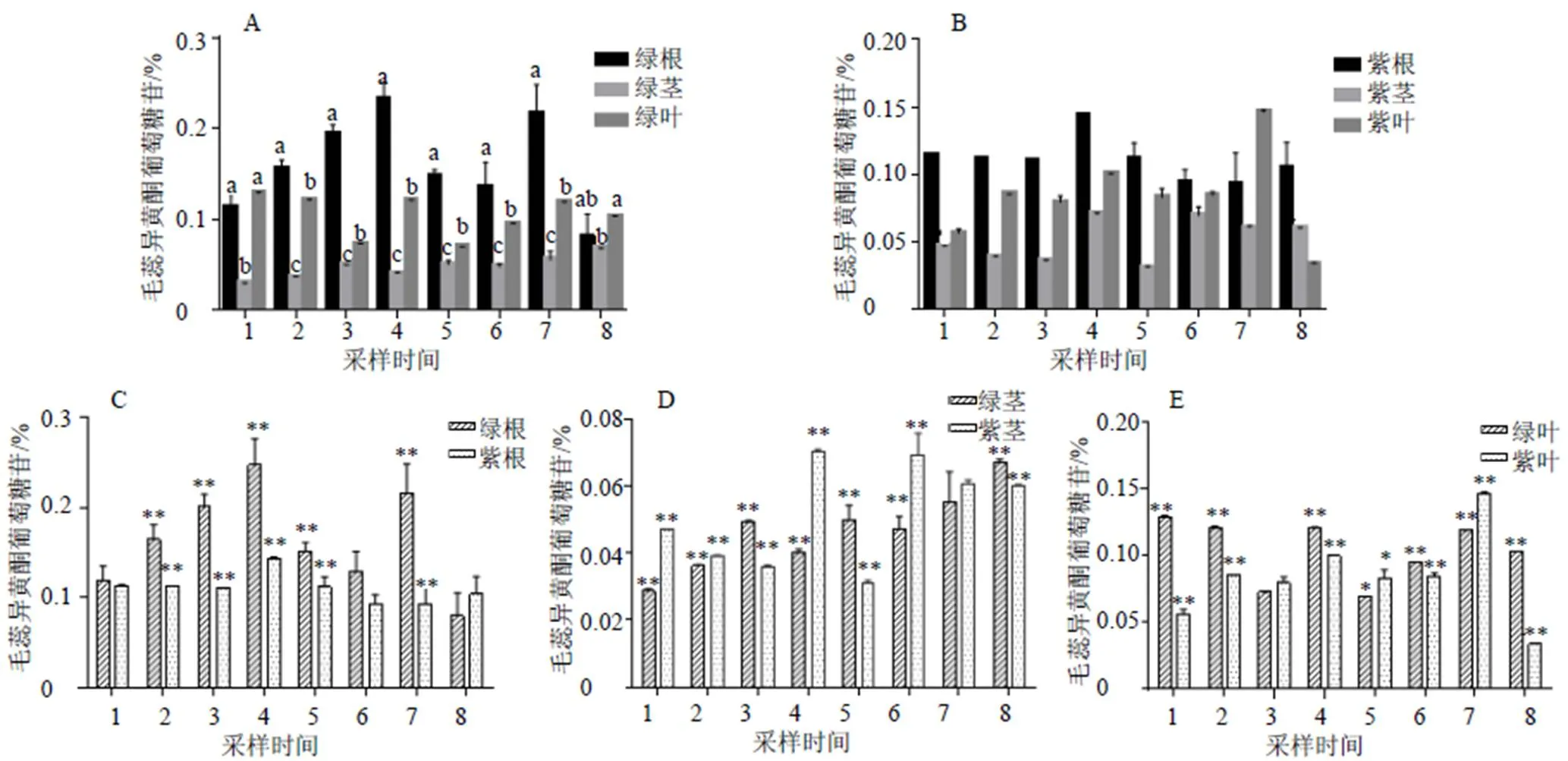
图4 2种类型膜荚黄芪根、茎、叶毛蕊异黄酮葡萄糖苷含量
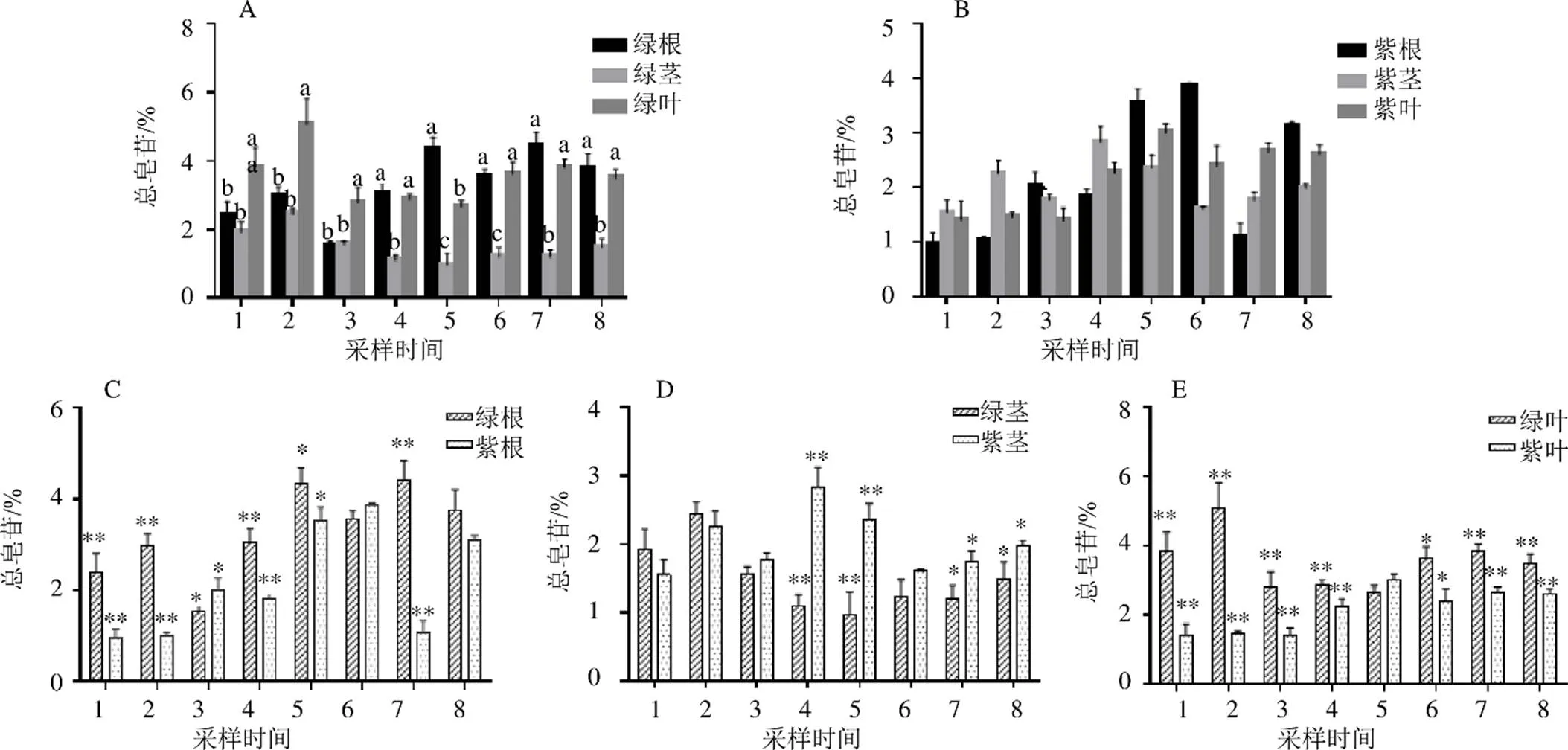
图5 2种类型膜荚黄芪根、茎、叶总皂苷含量
3.5 绿茎膜荚黄芪根部皂苷含量与关键酶基因表达量相关性分析
使用SPSS 19.0对绿茎膜荚黄芪根部皂苷含量与关键酶基因表达量进行Pearson相关性分析,见表2,结果表明与总皂苷呈显著相关(<0.05),与总皂苷呈极显著相关(<0.01),说明这4个基因在绿茎膜荚黄芪总皂苷合成中有重要作用。以上4个基因均对绿茎膜荚黄芪总皂苷含量表现出显著相关性,它们在皂苷合成途径中的作用机制值得继续深入研究,其他基因对绿茎膜荚黄芪皂苷含量没有表现出显著的相关性,可能是因为它们时空表达模式受到自身转录调控因子或者外部环境变化的影响,虽然在黄芪皂苷合成途径中有一定作用,但未表现出明显相关性。说明黄芪皂苷的生物合成是复杂多变的,其分子机制亟待阐明。
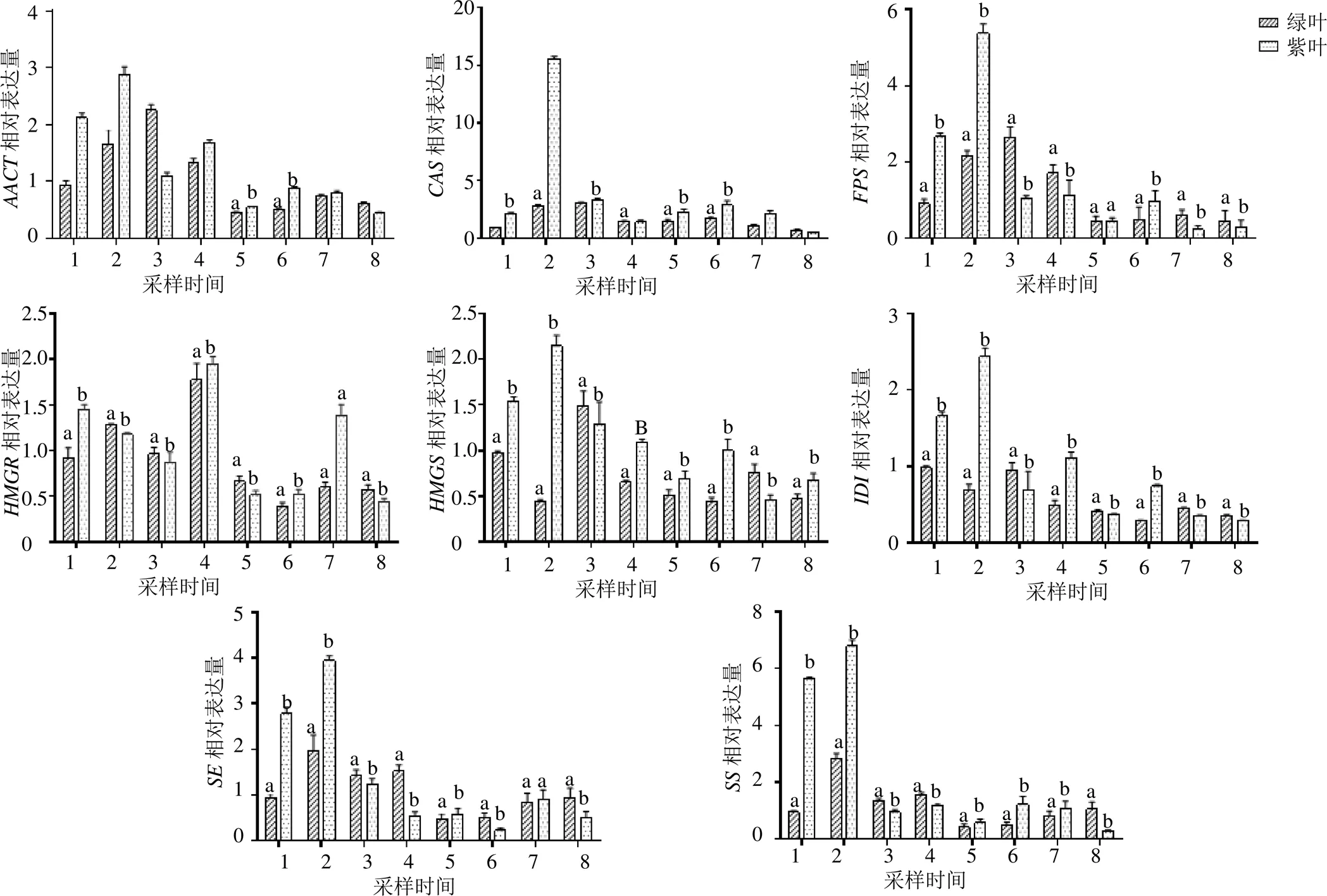
图6 2种类型膜荚黄芪根中关键酶基因荧光定量PCR表达分析

表2 绿茎膜荚黄芪皂苷含量与关键酶基因的相关性
*相关性达到显著水平,<0.05,**相关性达到极显著水平,<0.01,下同
*correlation reached significant level (<0.05), while ** correlation reached extremely significant level (<0.01), same as below
3.6 紫茎膜荚黄芪皂苷含量与关键酶基因表达量相关性分析
使用SPSS 19.0对紫茎膜荚黄芪根部皂苷含量与关键酶基因表达量进行Pearson相关性分析,见表3,结果表明与总皂苷呈显著相关(<0.05),其他基因与紫茎膜荚黄芪皂苷含量均有相关性,但未达到显著水平。说明这些基因在紫茎膜荚黄芪皂苷合成过程中均有一定的作用,其作用过程复杂,有待进一步深入研究。

表3 紫茎膜荚黄芪皂苷含量与关键酶基因的相关性
4 讨论
黄芪属药食兼用资源种,用途广泛、需求量大,由于生态环境的破坏和人类无节制的采挖,导致野生膜荚黄芪资源急剧减少,因此,用栽培品代替野生资源成为黄芪市场的趋势[14],选育高品质、高质量的栽培黄芪具有十分重要的意义。在人工栽培的膜荚黄芪群体中,出现许多外观形态不一的新类型,这为膜荚黄芪种内高品质类型的选育提供丰富的基础资料[15]。本实验选取2年生栽培不同类型膜荚黄芪,通过对其不同部位黄芪甲苷含量、毛蕊异黄酮葡萄糖苷含量、总皂苷含量以及根组织中皂苷合成途径关键酶基因表达量的测定,探究了不同类型膜荚黄芪中主要有效成分含量差异,在分子层面上分析皂苷合成关键酶基因表达量与膜荚黄芪黄芪甲苷及总皂苷含量之间的关系,为高质量栽培黄芪的选育提供理论依据。
药用植物的主要活性成分一般为次生代谢产物,其成分类型和含量是衡量中药材质量的重要标志[16]。本实验研究发现,紫茎膜荚黄芪根中黄芪甲苷含量始终高于绿茎膜荚黄芪;在生殖生长期时,绿茎膜荚黄芪根中毛蕊异黄酮葡萄糖苷含量高于紫茎膜荚黄芪,而枯萎期二者变化浮动较大;绿茎膜荚黄芪根中总皂苷含量基本高于紫茎膜荚黄芪。由研究结果发现,不同类型膜荚黄芪中主要有效成分含量确有不同,此结果与王雅莹等[15]的研究结果一致。
黄芪皂苷合成关键酶基因的表达调控了黄芪皂苷体内生物合成的流向,对其合成有着重要的影响。实验结果发现,在9月11日时紫茎与绿茎膜荚黄芪中的表达量均极显著高于其他时期,但与此同时紫茎与绿茎膜荚黄芪中的皂苷含量较低,说明黄芪皂苷的生物合成是复杂的,其分子机制亟待阐明,同时也可能与土壤、光照、水分等生态因子的参与有关,有待进一步研究[17-18]。本实验通过比较不同类型膜荚黄芪皂苷类成分与其合成关键酶基因表达量的相关性研究发现,绿茎膜荚黄芪总皂苷生物合成途径中,基因、基因及基因对总皂苷合成具有重要影响;紫茎膜荚黄芪总皂苷的生物合成途径中,基因起到重要作用,这为后续深入研究关键酶在植物体的作用机制及相关基因调控提供一定的理论参考,实现对黄芪药材质量向更优质方向的调控。
本研究系统地从主要有效成分及皂苷合成途径关键酶基因表达对不同类型膜荚黄芪的品质进行了初步探索,为膜荚黄芪药材种内高品质类型的选育提供科学依据,对中药材品质评价研究具有示范性意义,同时丰富发展了中药品质研究内涵,对于确保临床用药安全有效有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2015: 302-303.
[2] 秦雪梅, 李震宇, 孙海峰, 等. 我国黄芪药材资源现状与分析 [J]. 中国中药杂志, 2013, 38(19): 3234-3238.
[3] 曹庆伟, 张瑞, 李科, 等. 蒙古黄芪质量评价及商品规格等级研究进展 [J]. 山西医科大学学报, 2019, 50(6): 854-859.
[4] 刘霞, 王雅莹, 刘中林, 等. 膜荚黄芪不同类型种子生物学特性比较研究 [J]. 东北师大学报(自然科学版), 2017, 49(1): 110-115.
[5] 孙政华, 邵晶, 郭玫. 黄芪化学成分及药理作用研究进展 [J]. 中医临床研究, 2015, 7(25): 22-25.
[6] 仝欣. 黄芪主要活性成分的药理作用 [J]. 时珍国医国药, 2011, 22(5): 1246-1249.
[7] 张霞. 黄芪化学成分及药理作用概述 [J]. 实用中医药杂志, 2013, 29(7): 608-609.
[8] Kim Y B, Thwe A A, Li X,. Accumulation of astragalosides and related gene expression in different organs ofBge. var mongholicus (Bge.) [J]., 2014, 19(8): 10922-10935.
[9] Ding Y X, Ou-yang X, Shang C H,. Molecular cloning, characterization, and differential expression of a farnesyl-diphosphate synthase gene from the basidiomycetous fungus[J]., 2014, 72(6): 789-796.
[10] Huang Z, Jiang K, Pi Y,. Molecular cloning and characterization of the yew gene encoding squalene synthase from[J]., 2007, 40(5): 625-635.
[11] He F, Zhu Y, He M,. Molecular cloning and characterization of the gene encoding squalene epoxidase in[J]., 2008, 19(3): 270-273.
[12] 张艳利, 杨兴鑫, 李晓妮. HPLC/UV法测定黄芪四物胶囊中黄芪甲苷含量 [J]., 2010, 19(3): 223-228.
[13] 曹庆伟, 杜鹃, 罗晋平, 等. 黄芪甲苷含量测定方法的优化及对不同产地、不同等级黄芪中黄芪甲苷含量分析 [J]. 中国中药杂志, 2019, 44(13): 2813-2819.
[14] 王玲玲, 杨路存, 熊丰, 等. 不同栽培密度和采收期对蒙古黄芪生长发育和产量的影响 [J]. 分子植物育种, 2019, 17(23): 7962-7968.
[15] 王雅莹. 不同类型膜荚黄芪生理生态特性的比较研究 [D]. 长春: 吉林农业大学, 2016.
[16] Cheng L, Han M, Yang L,. Changes in the physiological characteristics and baicalin biosynthesis metabolism ofGeorgi under drought stress [J]., 2018, 122: 473-482.
[17] 韦赫, 程林, 吴培, 等. 黄芪皂苷生物合成对短期水分变化的响应 [J]. 中国中药杂志, 2019, 44(3): 441-447.
[18] 张甜, 程林, 杨林林, 等. 生态因子及关键酶基因表达对秋季黄芩采收期主要药效成分合成的影响 [J]. 中草药, 2019, 50(4): 936-944.
Study on content of main active components and expression of key enzyme genes in two types of
YAO Xuan-hang, LIU Cui-jing, CHANG Jing-ru, ZHANG Xue-wei, LIU-xia
State Key Laboratory of Ecological Restoration and Ecosystem Management, College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China
To explore the differences of the main effective components and the expression of key enzyme genes in the biosynthesis pathway of two types of(with green stem,with purple stem) roots, stems, and leaves, so as to provide a scientific theoretical reference for the rational utilization of resources ofand the selection of its excellent varieties.The contents of astragaloside A and genistein glucoside in the roots, stems, and leaves ofwere detected by HPLC, the contents of total saponins in the roots, stems and leaves ofwere detected by UV spectrophotometer, and the expression of key enzyme genes (AATC, HMGR, CAS, FPS, HMGs, IDI, SE, and SS) in the process of saponin biosynthesis in the roots ofwas detected by real-time fluorescence quantitative PCR.The content of astragaloside inwith purple stem root was always higher than that inwith green stem. During reproductive growth, the content of isoflavone glucoside inwith green stem root was higher than that inwith purple stem root, but the fluctuation of them was larger in wilting stage. The content of total saponin inwith green stem root was generally higher than that inwith purple stem.,, andgene expression were significantly correlated with the content of total saponins ofwith green stem (< 0.05),gene expression was significantly correlated with the content of total saponins (< 0.01), indicating that these four genes had an important influence on the synthesis of total saponins ofwith green stem;gene was significantly correlated with the content of total saponins ofwith purple stem (< 0.05), and other genes were significantly correlated with the content ofwith purple stem. The content of saponins was correlated, but did not reach the significant level.The dynamic changes of three main active components of two types ofand the expression of key enzyme genes ofsaponins were studied, which provided scientific theoretical basis for the clear physiological and ecological mechanism ofsaponins synthesis, the rational utilization ofresources and the selection of excellent varieties.
(Fisch.) Bge; astragaloside IV; total saponins; isoflavone glucoside; key enzyme genes
R286.12
A
0253 - 2670(2021)07 - 2072 - 10
10.7501/j.issn.0253-2670.2021.07.024
2020-08-03
吉林省科技发展计划项目(20160307001YY)
姚萱航(1994—),男,硕士研究生,研究方向为生态学。E-mail: 724020462@qq.com
刘 霞(1965—),女,博士,副教授,研究方向为中药资源与栽培。E-mail: liuxia651015@163.com
[责任编辑 时圣明]

