星点设计-响应面法优选菊苣叶干燥方法和炮制工艺
闫梦真,王瑞生,王金淼,张振凌, 3*,刘延泽
星点设计-响应面法优选菊苣叶干燥方法和炮制工艺
闫梦真1, 2,王瑞生1, 2,王金淼1,张振凌1, 2, 3*,刘延泽4*
1. 河南中医药大学,河南 郑州 450046 2. 河南省中药特色炮制技术工程研究中心,河南 郑州 450046 3. 呼吸疾病中医药防治省部共建协同创新中心,河南 郑州 450046 4. 中国医学科学院药用植物研究所,北京 100193
以绿原酸和菊苣酸及浸出物含量为指标,建立菊苣叶最佳干燥方法;优选菊苣叶饮片的最佳炮制工艺,为菊苣叶的开发应用奠定基础。建立菊苣叶中绿原酸和菊苣酸含量测定的HPLC方法,测定条件:色谱柱为Agilent Zorbax Eclipse XDB-C18柱(250 mm×4.6 mm,5 μm),以乙腈-0.4%磷酸水溶液为流动相梯度洗脱,体积流量为1 mL/min,柱温为30 ℃,检测波长为334 nm;采用绿原酸和菊苣酸及浸出物多指标确定菊苣叶最佳干燥方法;采用星点设计-响应面法对菊苣叶切制段长、干燥温度、干燥时间进行考察,以绿原酸、菊苣酸、浸出物含量及色度值、饮片外观性状等按照权重计分为评价指标并进行综合分析。菊苣叶最佳干燥方法为远红外干燥法;菊苣叶饮片炮制工艺条件为切制段长7 mm、干燥温度为50 ℃、干燥时间为17 h。优选出的菊苣叶炮制工艺综合评分较高,不仅最大限度保留有效成分,而且饮片色泽好,可重复性强,工艺稳定可靠。
星点设计-响应面法;菊苣;干燥方法;炮制工艺;绿原酸;菊苣酸;色度值;综合分析;远红外干燥
菊苣为菊科菊苣属植物毛菊苣Boiss. et Huet或菊苣s L.的干燥地上部分或根,味微苦、咸,性凉,归肝、胆、胃经,具有清肝利胆、健胃消食、利尿消肿的功效,用于治疗湿热黄疸、胃痛食少、水肿尿少等。菊苣系维吾尔族习用药材,也是国家卫生健康委员会公布的既是食品又是药品的物品之一。菊苣中主要含酚酸类、黄酮类、萜类、多糖、维生素等多种化学成分,菊苣酸、绿原酸是菊苣中主要有效成分,具有抑菌[1]、抗病毒[2]、抗氧化[3-5]、降尿酸[6]等药理活性。新鲜菊苣叶水分含量高,常温下不宜长途运输和长时间保存,因此,采收后应尽快进行干燥加工以保证其品质。菊苣叶在地采原材料至干燥饮片过程中涉及采集、净制和切制等多道工序,其质量容易受到较多外在因素的影响,因此建立科学合理的饮片生产流程至关重要。但是目前以有效成分为指标进行菊苣炮制工艺质量评价的研究尚属空白,仅有部分学者[7-8]以多酚含量及抗氧化活性为指标对菊苣叶、根的干燥方法进行了优选,确定以60 ℃热风干燥法作为最优工艺。一般来说,不同干燥方法和温度可能对有效成分的含量产生较大影响,有必要对其进行分析比较以优化干燥工艺。但历版《中国药典》菊苣项下均没有含量测定项,缺少对菊苣饮片进行客观质控的化学成分指标,当前市场及企业普遍采用传统的辨状论质作为菊苣叶的质量控制指标,但这一指标很难真正反映出菊苣叶的内在质量。因此,建立以有效成分含量为标准的质量评价方法及饮片的客观质量标准显得非常重要。综上所述,本研究采用阴干、晒干、冷冻干燥、定温鼓风干燥、连续升温鼓风干燥、真空干燥及远红外干燥7种不同干燥方法处理样品,然后以样品中的菊苣酸、绿原酸及浸出物含量为指标,筛选出菊苣的最佳干燥方法;并在此基础上采用星点设计-响应面法(central composite design- response surface methodology,CCD-RSM)考察切制段长、干燥温度及干燥时间等参数,通过对菊苣酸、绿原酸、浸出物含量、色度值、及外观性状的综和评分进行分析,确定菊苣最佳炮制加工工艺,为菊苣炮制工艺的规范化提供客观依据。
1 实验材料
1.1 仪器
岛津SPD-20A型高效液相色谱仪,日本岛津公司;GFL-620型电热鼓风干燥箱,天津市莱玻特瑞仪器设备有限公司;HOC-ZH45AF型真空烘箱,上海恒黔电子科技有限公司;881Y-1型远红外恒温干燥箱,吴江市华银烘箱制造厂;DHG-9076A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;ZD-F12型真空冷冻干燥机,南京载智自动化设备有限公司;HP-C220型精密色差仪,上海图新电子科技有限公司;KQ-500DV型超声清洗仪,昆山市超声仪器有限公司。
1.2 材料
对照品菊苣酸(批号PS000526,质量分数>98%)、绿原酸(批号PS0131-0025,质量分数>98.5%),成都普思生物科技有限公司;乙腈、磷酸为色谱纯;水为超纯水;甲醇为分析纯。新鲜菊苣采自河南封丘豫封园百草有机家庭农场,经河南中医药大学张振凌教授鉴定为菊科菊苣属植物菊苣L.的新鲜叶。
2 方法与结果
2.1 干燥方法考察
取新鲜菊苣叶,洗净后切10 mm段,晾干表面水分,备用。将样品按照阴干、晒干、冷冻干燥、定温鼓风干燥、连续升温鼓风干燥、真空干燥、远红外干燥7种不同方式干燥,放置备用。按照《中国药典》2020年版菊苣项下浸出物测定法[9]测定浸出物含量,测定菊苣酸、绿原酸含量,考察不同干燥方法对菊苣酸、绿原酸、浸出物含量的影响。
2.2 菊苣酸、绿原酸的含量测定
2.2.1 色谱条件 色谱柱为Agilent Zorbax Eclipse XDB-C18分析型色谱柱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.4%磷酸水溶液,洗脱梯度:0~25 min,10%~21%乙腈;25~40 min,21%乙腈;40~45 min,21%~10%乙腈;体积流量1 mL/min;柱温30 ℃;进样量20 μL;检测波长334 nm。HPLC图见图1。
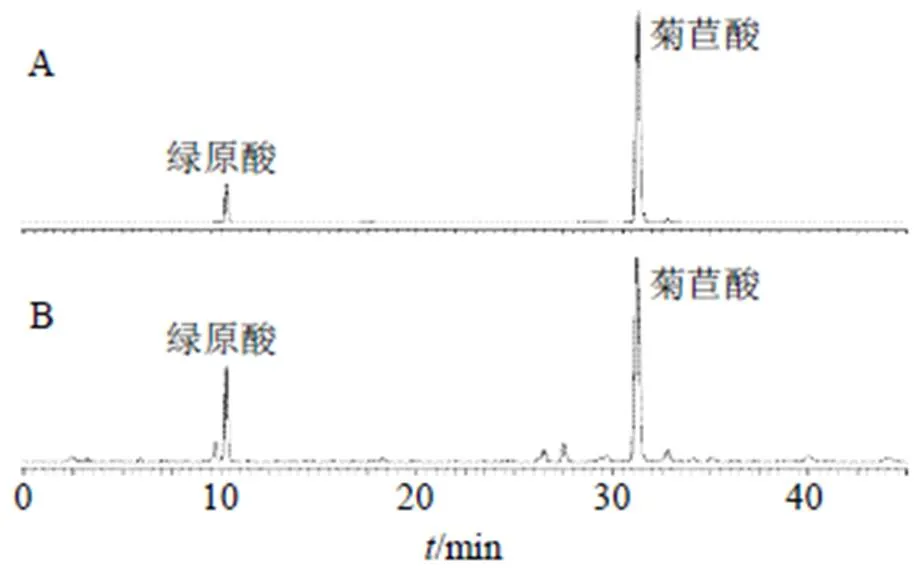
图1 混合对照品 (A) 和菊苣叶样品 (B) 的HPLC图
2.2.2 对照品溶液的制备 分别精密称取绿原酸、菊苣酸对照品4.68、5.88 mg置于5 mL量瓶中,超纯水定容至刻度,得质量浓度分别为绿原酸0.936 mg/mL、菊苣酸1.176 mg/mL的对照品母液。
2.2.3 供试品的制备 精密称取0.5 g的菊苣样品粉末(过4号筛)于50 mL具塞锥形瓶中,加入25 mL甲醇,密塞,超声提取40 min,放冷后补足减失的质量。滤过,取续滤液10 mL至蒸发皿中,55 ℃水浴锅上挥干甲醇,用超纯水溶解至5 mL量瓶中定容,即得供试品溶液。
2.2.4 线性关系考察 精密吸取“2.2.2”项下绿原酸、菊苣酸对照品母液适量,至2 mL量瓶中并定容,配制成质量浓度分别为绿原酸0.467 5、4.675、23.375、46.750、70.125、233.750 μg/mL,菊苣酸2.937 5、29.375、146.875、293.750、440.625、 587.500 μg/mL的混合对照品溶液,过0.22 μm的微孔滤膜,按照“2.2.1”项下色谱条件检测,以对照品溶液进样量为横坐标(),对照品峰面积为纵坐标(),绘制标准曲线,标准曲线方程为绿原酸=2 279 751.892 4-1 004.939 5,²=1.000 0,线性范围为9.35~4 675.0 ng;菊苣酸= 2 798 275.277 3+162 685.388 8,²=0.999 5,线性范围为58.75~11 750.0 ng。
2.2.5 精密度试验 吸取编号为S6样品的供试品溶液20 μL,按照“2.2.1”项下色谱条件连续进样6次,计算绿原酸和菊苣酸峰面积RSD值分别为0.17%、0.20%,说明该方法精密度良好。
2.2.6 稳定性试验 取同一供试品溶液,在0、2、4、6、8、10、12、24 h进样测定,计算绿原酸、菊苣酸峰面积RSD值分别为0.18%、0.20%,结果表明供试品溶液在24 h内基本稳定。
2.2.7 重复性试验 精密称取同一菊苣样品粉末6份,按照“2.2.3”项下方法制成供试品溶液,按照“2.2.1”项下色谱条件测定,计算绿原酸、菊苣酸质量分数的RSD值分别为3.39%、1.52%,表明该方法重复性良好。
2.2.8 加样回收率试验 精确称取已测定含量的菊苣样品6份,每份0.25 g,分别精密加入0.936 mg/mL绿原酸、1.176 mg/mL菊苣酸对照品溶液适量(加入量与所取供试品中待测成分量之比约为1∶1),按照“2.2.3”项方法制备供试品溶液,按照“2.2.1”项下色谱条件测定,计算各成分加样回收率,结果绿原酸、菊苣酸的平均加样回收率分别为99.83%、98.50%,RSD值分别为2.00%、2.17%。
2.2.9 供试品测定 按照“2.2.3”项下方法制备菊苣样品供试品溶液,按照“2.2.1”项下色谱条件进样测定,根据线性回归方程,以干燥品计,计算绿原酸、菊苣酸含量。
2.3 不同干燥方法对指标成分的影响
以绿原酸、菊苣酸、浸出物含量为考察指标,因为浸出物反映了样品整体质量,所以将浸出物和有效成分权重各设为50%,绿原酸和菊苣酸均属于有效成分,所以权重也各为有效成分的50%。故绿原酸、菊苣酸、浸出物权重系数分别为0.25、0.25、0.50,综合评分=(0.25×绿原酸/绿原酸max+0.25×菊苣酸/菊苣酸max+0.5×浸出物/浸出物max)×100,计算综合评分,优选菊苣叶最佳干燥方法。结果见表1。
对不同干燥方法菊苣叶进行综合评分,排名为S1>S7>S4>S5>S6>S2>S3,结果表明,传统的晒干处理比高温烘干有利于菊苣叶活性成分的积累,可延缓干燥过程中活性成分的降解速度;阴干法所需时间最长,在干燥过程中成分会发生降解;冷冻干燥需快速冷冻,而新鲜菊苣叶中含水量较多,急速超低温冷冻会造成组织结构损伤,使成分遭到破坏;其他干燥方法均为加热干燥法,且温度相近或相同,其成分含量也较为相近。最优干燥方法为晒干,远红外干燥次之,由于晒干法耗时较长,且易受天气影响发生霉变腐烂,故选择排名靠前的远红外干燥进行菊苣叶干燥工艺研究。
2.4 炮制工艺研究
2.4.1 干燥温度考察 取新鲜菊苣叶适量,抢水洗净杂质,切10 mm的段,分别在30、40、50、60、70 ℃干燥。考察不同干燥温度对绿原酸、菊苣酸及浸出物含量的影响,结果见图2。由图2可知,40 ℃时绿原酸、菊苣酸、浸出物含量均最高,50~70 ℃含量逐渐降低。绿原酸和菊苣酸为酚酸类物质,较高温度加热时其含量随温度的升高而降低,可见绿原酸和菊苣酸稳定性受温度影响较大,宜在较低温度下进行干燥加工,又考虑到缩短干燥时间,故以40~50 ℃为温度范围设计干燥工艺。
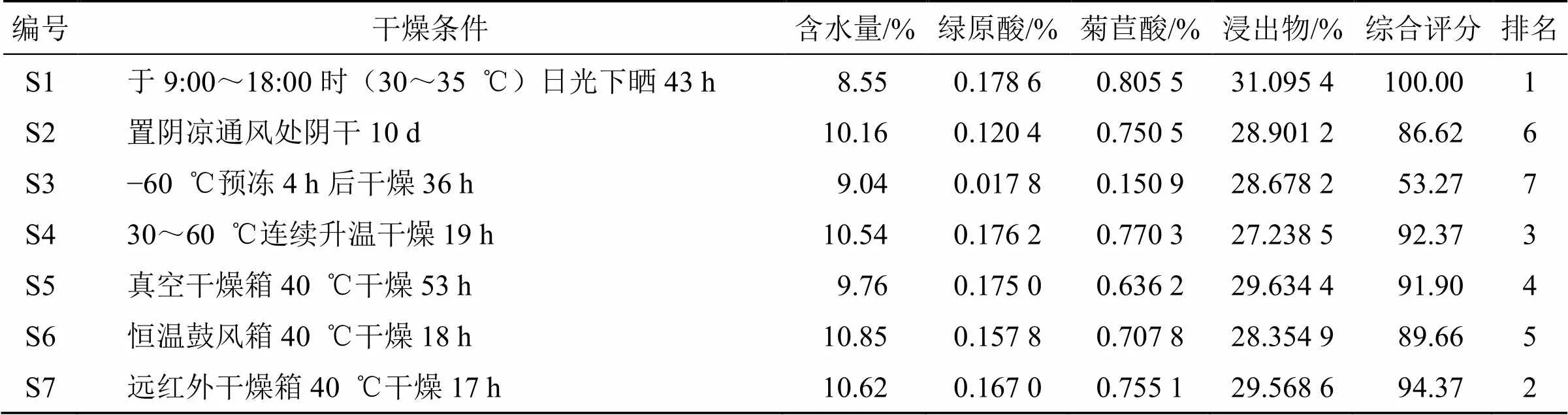
表1 菊苣中绿原酸、菊苣酸、浸出物3种成分含量及综合评分
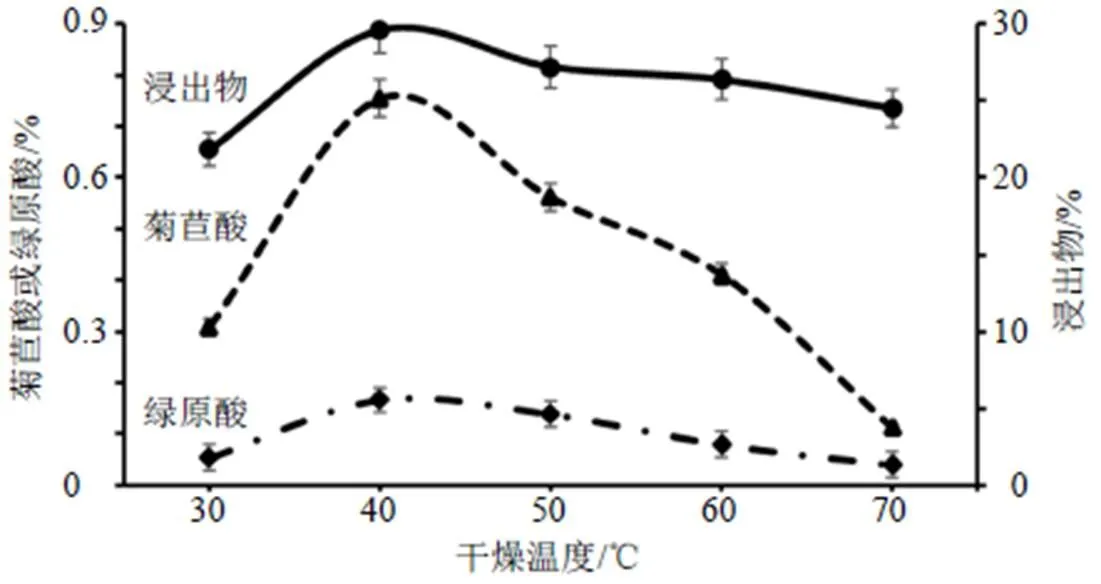
图2 不同干燥温度对3种成分含量的影响
2.4.2 CCD-RSM实验设计 查阅《中国药典》2020年版[9]发现菊苣炮制方法仅切段,而段分为短段(5~10 mm)和长段(10~15 mm),所以选取3个标志点5、10、15 mm作为段长水平,干燥时长为13 h,故以13 h为最低水平设置干燥时间。在干燥温度考察的基础上采用远红外干燥箱,选取切制段长(1)、干燥温度(2)、干燥时间(3)3个考察因素,采用Design-Expert 8.0.6软件建立3因素3水平的星点设计-响应面设计试验,以绿原酸、菊苣酸、浸出物含量及色度值、饮片外观性状等得出的综合评分为响应值,各因素的3个水平采用−1、0、+1进行编码,实验设计如表2所示。
2.4.3 外观性状评价 结合饮片颜色及形状情况,分别请10位不同人员进行外观性状评分,形状越完整颜色越鲜亮越绿者得分越高,最终结果取平均值。同时采用HP-C220精密色差仪(D65光源)对样品进行色度测定[10-12],以仪器配备的黑白腔进行黑白校准,在模式下对粉碎均匀的粉末进行3次平均采集。为亮度轴,表示黑白,0为黑,100为白;为红绿轴,表示红绿,正值为红,负值为绿,0为中性。由于外观为质量评价的重要评判标准,精密色差仪测得数据为客观评价标准,所以外观及色差仪测得值权重各设为50%,而色差仪测得值包括值和值,所以权重各占测得值的50%,故外观、、权重系数分别为0.50、0.25、0.25,值越大饮片越亮,所以系数为正值,值越小饮片越绿,所以系数为负值,外观性状评分=(外观/外观max×0.5+/max×0.25-/max×0.25)×100,结果见表3。饮片外观性状及粉末颜色见图3和表3。
2.4.4 饮片样品质量综合评分 以外观性状结合内在质量作为样品综合评分,以市场及企业普遍采用的传统辨状论质质量评判标准为基础,将外观性状和内在质量权重各设为50%,内在含量包括浸出物和有效成分(绿原酸、菊苣酸),浸出物为样品中总物质含量,可反应样品整体质量,选取的菊苣酸、绿原酸化学成分指标是菊苣中主要有效成分,所以将浸出物和有效成分权重各设为内在质量的50%,化学成分又包括绿原酸和菊苣酸,所以权重也各为有效成分的50%。所以绿原酸、菊苣酸、浸出物、外观性状权重系数分别为0.125、0.125、0.25、0.5,综合评分=绿原酸×0.125+菊苣酸×0.125+浸出物×0.25+外观性状×0.5,结果见表2。
采用SPSS 20.0对原始数据进行标准化处理(消除量纲和数量级差异),计算色度值与绿原酸、菊苣酸、浸出物、外观性状评分、综合评分之间的Pearson相关系数,结果见表4。由Person相关系数结果可知,菊苣酸含量、综合评分与呈极显著负相关 (<0.01),相关系数分别为−0.890、−0.826,由此可知,样品的色泽与菊苣酸含量、综合评分存在极显著相关性,表明一定程度上菊苣颜色越绿,菊苣酸含量、综合评分越高。
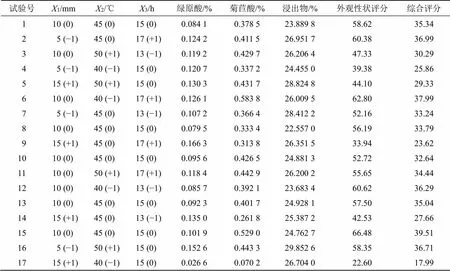
表2 CCD-RSM实验设计及不同实验条所得样品综合评分结果
2.4.5 响应面模型的建立与分析 利用Design- Expert 8.0.6软件对实验数据进行方差分析及2次多项式回归拟合,回归方程为=35.26-4.281+1.582+0.703+0.1212-1.9513+0.6123-6.0812-1.7122+1.2032。2为0.694 5,说明模型预测值与实测值有较高的相关性,失拟项=0.051 1>0.05,无显著性差异,表明方程拟合度良好,模型的残差可能是随机误差产生的。
以上结果表明此模型拟合情况良好,可用此模型对实验结果进行分析和预测。由响应面模型分析结果可知,3个因素对菊苣叶干燥后质量的影响大小为1>2>3,1、12因素对菊苣质量的影响显著,表明切制段长对菊苣饮片质量有显著影响,结果见表5。

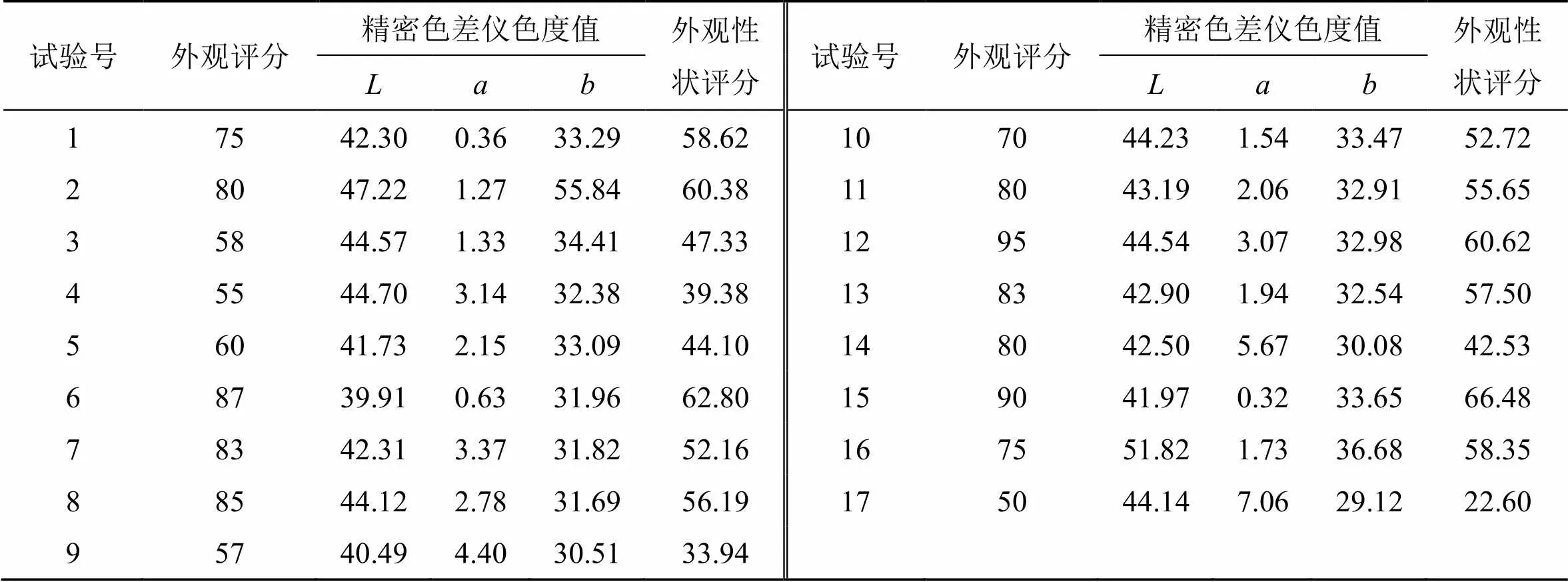
表3 不同实验条件所得样品外观评分及色度值测定结果
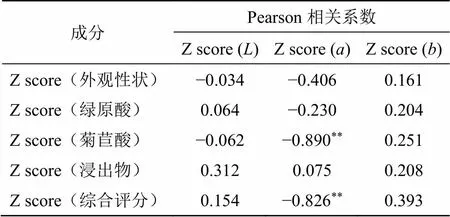
表4 色度值与成分相关性
**<0.01
2.4.6 响应面的优化与预测性评价 利用Design- Expert 8.0.6软件绘制3个因素之间的交互作用对综合评分影响的三维曲面图和等高线,见图4。通过响应曲面图和等高线图可以清晰的看出各因素对菊苣综合评分的影响。基于Design-Expert 8.0.6软件,得到菊苣的干燥工艺参数为切制段长7.47 mm、干燥温度为48.11 ℃、干燥时间为17 h,预测综合评分为39.415 5。
2.5 工艺验证试验
为了实际生产的可操作性和简便性,将工艺参数调整为切制段长7 mm、干燥温度为50 ℃、干燥时间为17 h。按调整后的工艺参数进行工艺验证3批,综合评分均值为33.75,RSD值为2.34%,得到实测值与预测值偏差较小,说明该模型预测性良好,结果见表6。
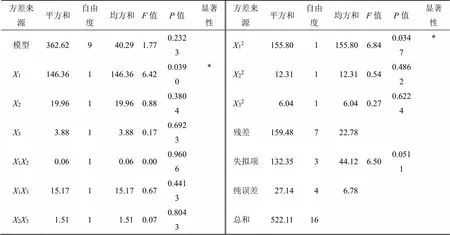
表5 拟合回归分析结果
*<0.05
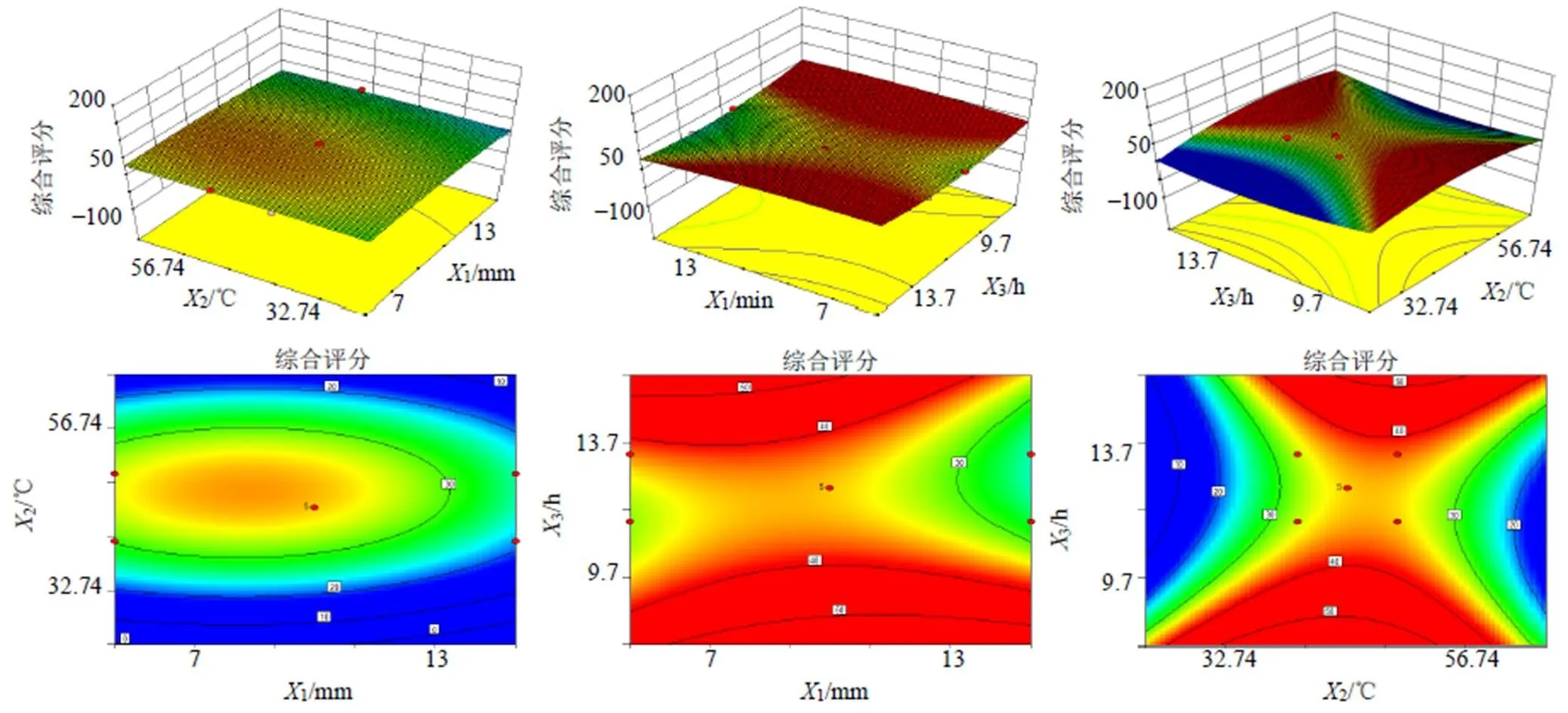
图4 3个因素之间的交互作用对综合评分影响的三维曲面图和等高线
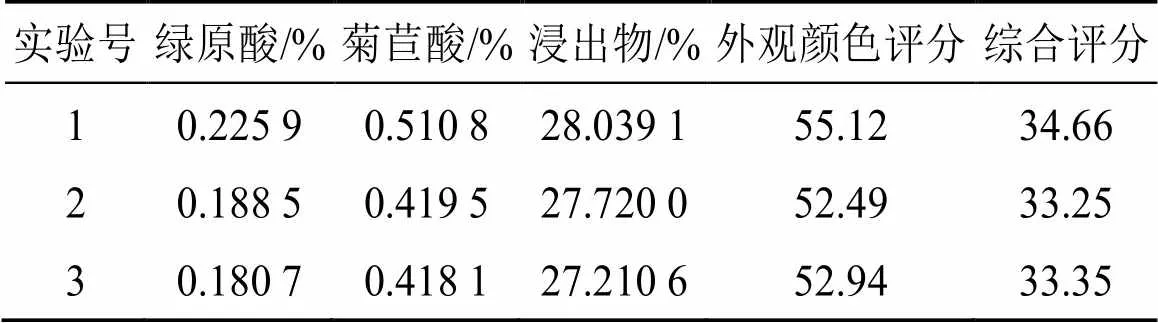
表6 工艺验证试验结果
3 讨论
本研究首次建立同时测定菊苣中菊苣酸、绿原酸含量测定方法,实验考察回流和超声2种提取方法,结果表明2种方法提取效率相近,因超声提取方便快捷,最终选择超声提取;菊苣叶中成分种类较多,使用甲醇提取时色谱峰较杂,所以对提取方法进行考察,选择前文中供试品处理方法;考察乙腈-0.1%磷酸水溶液、乙腈-0.3%磷酸水溶液、乙腈- 0.4%磷酸水溶液、甲醇-0.4%磷酸水溶液等不同流动相,以乙腈-0.4%磷酸水溶液最佳;考察不同洗脱条件,以前文所述梯度洗脱方法最佳[13-19],此方法分离效果好、重现性强,可以用于菊苣饮片质量标准的建立。
由不同方法干燥菊苣叶实验综合评分可知,晒干>远红外干燥>连续升温鼓风干燥>真空干燥>恒温鼓风干燥>阴干>冷冻干燥。根据排名可知晒干法为较好的干燥加工方法,本实验在夏季日光较好的条件下进行,温度环境与40 ℃加热烘干效果相近,然而晒干法受天气影响较大,新鲜菊苣若不及时处理会腐烂影响其品质,故需要稳定可靠的干燥加工方法。
晒干和阴干属于自然干燥,未经过机械加热,相比于高温烘干,可延缓干燥过程中活性成分的降解速度,成分含量较高。冷冻干燥是将被干燥的物质在超低温下快速冻结,然后在适当的真空环境下,使冻结的水分子直接升华成为水蒸气逸出的过程,若直接将新鲜植物材料放入超低温冰箱,由于其制冷特点,冷冻速度能力有限,物料从室温降到超低温过程缓慢,生物细胞内的水分将在缓慢冷冻过程中因膨胀而导致细胞壁破裂使组织结构损伤,表面水分在温度较长时间的下降过程中蒸发从而破坏样品,而新鲜菊苣叶中含水量较多,冷冻会造成组织结构损伤,使成分损失,且其成本较高不宜实际生产使用。其他方法均为加热干燥,所以选择排名靠前的远红外干燥作为干燥方法。
采用响应面法以切制段长、干燥温度、干燥时间为考察因素对菊苣叶炮制工艺条件进行优选,结果表明切制段长对菊苣饮片质量有显著性影响。切制段长太长,相同干燥温度下样品不容易干燥,需更长的干燥时间,造成绿原酸及菊苣酸高温不稳定成分的损失,且干燥时间过长样品颜色会变黄或变黑,综合评分较低;段长太短,虽然干燥速度较快,但叶子破碎度增加,外观评分下降,使综合评分相应降低。不考虑干燥温度和干燥时间的情况下,切制段长越长综合评分越低。根据综合评分结果优选出菊苣叶最佳炮制工艺为切制段长7 mm、干燥温度为50 ℃、干燥时间为17 h,该模型准确可靠,可从整体上全面评价菊苣饮片质量,为菊苣叶炮制工艺的规范化提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 吐尔逊娜依·迪力夏提, 穆拉丁·库热西, 阿不都拉·阿巴斯. 菊苣茎乙醇提取物抑菌活性研究 [J]. 食品科学, 2009, 30(11): 80-82.
[2] Ding Y, Cao Z Y, Cao L,. Antiviral activity of chlorogenic acid against influenza A (H1N1/H3N2) virus and its inhibition of neuraminidase [J]., 2017, 7: 45723.
[3] Hwang S H, Paek J H, Lim S S. Simultaneous ultra performance liquid chromatography determination and antioxidant activity of linarin, luteolin, chlorogenic acid and apigenin in different parts of Compositae species [J]., 2016, 21(11): E1609.
[4] 肖海芳, 付晶晶, 王友玲, 等. 菊苣酸对活性氧诱导脂质和DNA氧化损伤的影响 [J]. 食品科学, 2018, 39(13): 235-240.
[5] 肖海芳, 杨淑青, 王旭光, 等. 菊苣酸对蛋白质氧化损伤的作用 [J]. 食品科学, 2018, 39(7): 119-124.
[6] 朱春胜, 张冰, 林志健, 等. 菊苣降尿酸有效成分及机制研究 [J]. 中草药, 2017, 48(5): 957-961.
[7] 尚红梅, 王雪昭, 潘丹, 等. 干燥方式对菊苣叶多酚含量和抗氧化活性的影响 [J]. 中国农业大学学报, 2015, 20(1): 96-102.
[8] 尚红梅, 郭玮, 潘丹, 等. 干燥方式对菊苣根多酚含量和抗氧化活性的影响 [J]. 食品科学, 2015, 36(1): 84-88.
[9] 中国药典 [S]. 一部. 2020: 323.
[10] 刘战, 侯晓琳, 宿莹, 等. 基于色差原理分析赤芍颜色与HPLC指纹图谱信息相关性研究 [J]. 中药材, 2020(8): 1935-1938.
[11] 柴冲冲, 毛民, 袁金凤, 等. 不同方法软化切制后的黄芩饮片颜色与5种黄酮类成分含量的相关性研究 [J]. 中国中药杂志, 2019, 44(20): 4467-4475.
[12] 刘娟汝, 刘晓梅, 刘雨诗, 等. 基于色度分析原理的青黛有效成分含量与其色度值的相关性分析 [J]. 中国实验方剂学杂志, 2019, 25(23): 165-170.
[13] 石国慧, 杨世林, 张晓书, 等. HPLC法同时测定翠菊不同部位中5种黄酮类成分 [J]. 中草药, 2015, 46(3): 428-431.
[14] 华春, 李建玲, 周峰, 等. 菊苣中菊苣酸提取工艺优化 [J]. 食品科学, 2011, 32(20): 126-129.
[15] 徐健梅. 菊苣中菊苣酸的提取工艺及指纹图谱的研究 [D].北京: 北京化工大学, 2008.
[16] 陈英红, 罗浩铭, 姜瑞芝. 苦碟子中(-)3,4-二咖啡酰基酒石酸和菊苣酸含量的高效液相色谱法测定 [J]. 时珍国医国药, 2012, 23(2): 386-387.
[17] 李晶, 聂斌, 武力, 等. 引种紫锥菊中菊苣酸的定性定量分析 [J]. 药物分析杂志, 2011, 31(9): 1804-1807.
[18] 朱春胜, 林志健, 牛红娟, 等. 一测多评法测定菊苣中绿原酸、秦皮乙素、异绿原酸B和异绿原酸A的量 [J]. 中草药, 2016, 47(4): 666-670.
[19] 孟创鸽, 傅虹飞, 周良付, 等. 菊苣中菊苣酸、绿原酸和木犀草苷的协同抗氧化作用 [J]. 中国食品学报, 2017, 17(9): 41-47.
Optimization of drying method and processing technology ofleaves by central composite design-response surface methodology
YAN Meng-zhen1, 2, WANG Rui-sheng1, 2, WANG Jin-miao1, ZHANG Zhen-ling1, 2, 3, LIU Yan-ze4
1. School of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Henan Research Center for Special Processing Technology of Chinese Medicine, Zhengzhou 450046, China 3. Co-construction Collaborative Innovation Center for Chinese Medicine and Respiratory Diseases by Henan & Education Ministry of P. R. China, Zhengzhou 450046, China 4. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Beijing 100193, China
To establish the best drying method forleaves based on the content of chlorogenic acid and cichoric acid and extracts; and optimize the best processing technology ofleaves, to lay a foundation for the development and application ofleaves.An HPLC method for the simultaneous determination of chlorogenic acid and cichoric acid was established, the chromatographic column was an Agilent Zorbax Eclipse XDB-C18column (250 mm × 4.6 mm, 5 μm) with acetonitrile (A)-0.4% phosphoric acid water (B) as mobile phase gradient elution. The flow rate was 1 mL/min, the column temperature was 30 ℃, and the detection wavelength was 334 nm. The optimum drying method ofleaves was determined by chlorogenic acid, cichoric acid, and extracts multi-index comparison. The cutting length, drying temperature, and drying time of chicory leaves were investigated by central composite design-response surface methodology. The content of chlorogenic acid, cichoric acid, and the crude extract and the color value, and appearance properties of decoction pieces were comprehensively analyzed as evaluation indicators according to weight.The best drying method for chicory leaves was far-infrared drying. The processing conditions ofleaves pieces were as follows: the cutting length was 7 mm, the drying temperature was 50 ℃, and the drying time was 17 h.The optimized processing technology ofleaves has a high comprehensive score, not only retains the active ingredients to the maximum extent but also has a good color, reproducibility, stable and reliable process.
central composite design-response surface methodology;s L.; drying method; processing technology; chlorogenic acid; cichoric acid; chromatic value; comprehensive analysis; far-infrared drying
R283.6
A
0253 - 2670(2021)07 - 1957 - 08
10.7501/j.issn.0253-2670.2021.07.012
2020-11-25
公益性行业专项—中药炮制技术传承基地建设(00104296)
闫梦真(1994—),女,硕士研究生,从事中药饮片研究及开发。E-mail: yanmz2610@163.com
张振凌,博士生导师,教授,从事中药饮片质量与炮制作用机制研究。E-mail: zhangzl6758@163.com
刘延泽,教授,从事中草药化学成分与新药发现技术研究。E-mail: yzliu@implad.ac.cn
[责任编辑 郑礼胜]

