黄白温敏型原位凝胶的处方筛选与评价
朱卫丰,刘水婷,王万春,管咏梅
黄白温敏型原位凝胶的处方筛选与评价
朱卫丰1,刘水婷1,王万春2,管咏梅1*
1. 江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004 2. 江西中医药大学附属医院 外一科,江西 南昌 330004
筛选并优化黄白温敏型原位凝胶的处方,并考察其经皮渗透性能。以泊洛沙姆407(P407)、泊洛沙姆188(P188)、聚乙二醇6000(PEG6000)作为凝胶基质材料,以胶凝温度为考察指标,采用Box-Behnken效应面法优化温敏凝胶处方;对制备的温敏凝胶进行理化表征,并采用Franz透皮扩散池法考察黄白温敏凝胶的经皮渗透性能。黄白温敏型原位凝胶的最佳处方为P407 20.10%,P188 2.54%,PEG6000 2.00%,胶凝温度为(34.2±0.2)℃,24 h内欧前胡素、盐酸小檗碱的累积渗透量分别为(14.07±1.34)、(395.72±35.04)μg/cm2,均符合Higuchi动力学方程。制备的凝胶具有温敏、缓释作用,为临床提供治疗蛇虫咬伤的制剂奠定基础。
黄白温敏型原位凝胶;处方优化;Box-Behnken效应面法;经皮渗透性能;欧前胡素;盐酸小檗碱;Higuchi动力学方程;温敏;缓释
毒蛇咬伤是严重影响劳动人民生命健康的常见灾害性疾病,在我国每年有超过1万人死于毒蛇咬伤。中医中药治疗毒蛇咬伤不仅有着悠久的历史,并且独具特色[1]。蛇虫咬伤后毒蛇毒虫的毒液进入人体,患处表现出红肿热痛、皮肤表层温度升高、炎症反应等局部症状,故临床常外用给药,直达病灶,发挥抗炎、消肿的作用。通过中华医典数据库和中医资源网等的古文检索发现,白芷外用常用于治疗蛇虫咬伤,黄柏外用常用于解毒消肿,且以“黄柏”“白芷”“外敷/外用”为关键词检索发现,二者常配伍使用,发挥解毒、消肿、止痛等作用。然而,临床治疗蛇虫咬伤所致肿痛外用制剂多为散剂,其颗粒粗大,刺激性强,患者依从性不高。近年来,半固体凝胶剂以其制备简单、使用温和备受青睐,而具有温度响应型凝胶颇具潜力,其为智能给药系统,能够实时感知环境、用药部位等的温度变化并随之发生相转变,当温度低于临界相变温度(lower critical solution temperature,LCST)时呈液态,高于LCST时呈半固体凝胶态,从而延长药物滞留时间,持续释药,提高生物利用度[2-4]。因此,本课题组研制了一种环境响应型凝胶剂——黄白温敏凝胶,旨在研发出一种便于患者使用且能快速消除蛇虫咬伤致患处疼痛、肿胀的新型中药外用制剂,扩大其在临床的使用范围,为中药复方外用制剂的发展提供借鉴。
1 材料
1.1 动物
健康SPF级雄性昆明种小鼠,体质量18~22 g,购于江西中医药大学动物中心,动物许可证号:SCXK(赣)2018-0003,动物实验经江西中医药大学实验动物伦理委员会批准,批准文号:JZSYDWLL-20200901。
1.2 试药
白芷饮片,江西江中中药饮片公司,批号160718,产地安徽;黄柏饮片,江西继中堂健康科技有限公司,批号180801,产地四川,上述药材均经江西中医药大学鉴定教研室葛菲教授鉴定,白芷为伞型科当归属植物白芷(Fisch. ex Hoffm.) Benth. et Hook. f.的干燥根,黄柏为芸香科黄柏属植物黄皮树Schneid.的干燥树皮,均符合《中国药典》2020年版质量要求。
对照品欧前胡素(批号110826-201616,质量分数99.6%)、盐酸小檗碱(批号110713-201814,质量分数86.7%),中国食品药品检定研究院;泊洛沙姆407(P407,批号GNC2192B)、泊洛沙姆188(P188,批号GNC33221B),德国BASF公司;聚乙二醇6000(PEG6000,批号810T032),北京索莱宝科技有限公司;聚乙二醇4000(PEG4000,批号M1005A)、聚乙二醇400(PEG400,批号D1101A)、甘油(批号M1101A),大连美仑生物技术有限公司;甲醇,色谱纯,西陇科学股份有限公司;磷酸,西陇化工股份有限公司;无水乙醇(批号2008239),西陇科学股份有限公司;纯水,实验室纯水仪自制。
1.3 仪器
EPED实验室级超纯水器,南京易普易达科技发展有限公司;Anto paar Physica MCR101型流变仪,奥地利安东帕公司;ZNCL-BS智能磁力搅拌器,西安安泰仪器科技有限公司;Agilent1260型高效液相色谱仪,美国安捷伦科技有限公司;Turbiscan Lab稳定性分析仪,法国Formulaction公司;BSA 124S型电子分析天平,德国Sartorius公司;PHS-3C型pH计,上海雷磁仪器有限公司;SU8010扫描电子显微镜(SEM),日本日立公司。
2 方法与结果
2.1 提取物的制备
在前期的提取工艺考察基础上,提取药材得到提取液,水浴蒸干后置于45 ℃真空干燥得提取物粉末。黄柏提取物:8倍量60%乙醇为溶剂,提取3次,每次1 h,投药量为5%(按原粉计,浸膏得率为13.42%);白芷提取物:10倍量75%乙醇为溶剂,提取3次,每次1 h,投药量为5%(按原粉计,浸膏得率为10.12%)。
2.2 助溶剂的筛选
采用法国Turbiscan Lab型近红外稳定性分析仪比较温敏凝胶的稳定性[5-6]。固定P407和P188的比例不变,以不同的助溶剂(PEG6000、PEG4000、甘油、PEG400)制备温敏凝胶,筛选最佳助溶剂;将样品置于样品瓶中,25 ℃下测定,每天扫描1次,连续测定7 d。体系整体动力学不稳定性结果如图1所示,由图1可知动力学不稳定性指数(TSI)值为PEG4000>甘油>PEG400>PEG6000,即以PEG6000为助溶剂时温敏凝胶的稳定性最佳,因此选择PEG6000作为凝胶助溶剂。
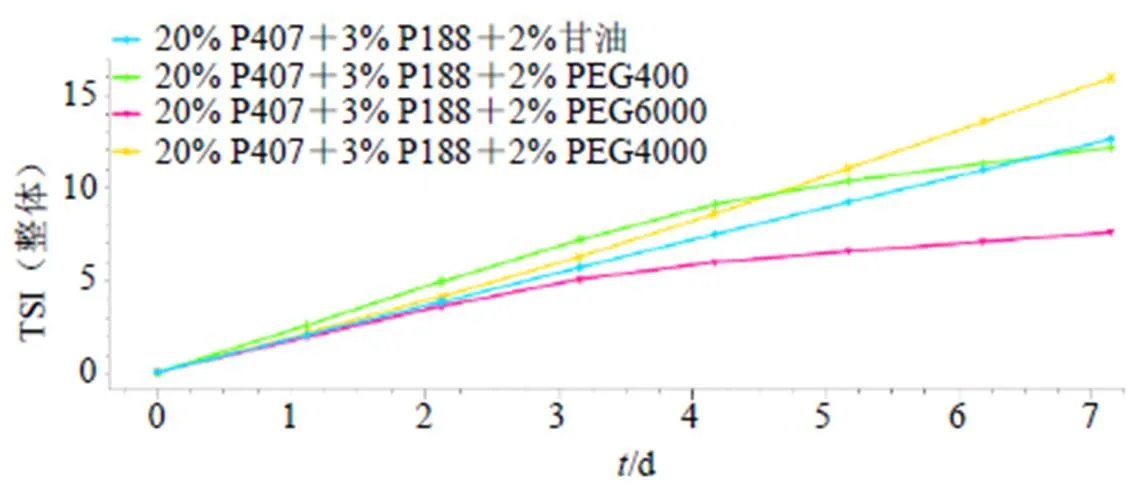
图1 稳定性扫描图
2.3 制备工艺
采用“冷溶法”制备温敏凝胶[7],将PEG6000溶于处方量的水中,并加入处方量的黄柏和白芷提取物,超声使其完全溶解,冰水浴下依次缓慢加入处方量的P407、P188,搅拌均匀,然后置于4~10 ℃冰箱冷藏24 h,使其充分溶胀,得到澄清、分散均匀的药物凝胶溶液。
2.4 胶凝温度(gelation temperature,Tg)的测定
采用“搅拌子法”测定温敏凝胶的g[8-9],取温敏凝胶液5 mL,加入搅拌子,并插入探针式温度计(准确度为0.1 ℃),使温度计的探针完全浸没在温敏凝胶液中,置于磁力搅拌器上,转速设置为200 r/min,持续缓慢升温,使凝胶液的温度上升速率为1~2 ℃/min,观察并记录凝胶完全凝结(不流动)时的温度,即为g,每个样品平行测定3次,取平均值。
2.5 处方优化
2.5.1 单因素考察 以g作为考察指标,对不同用量的P407(20%、21%、22%、23%、24%)、P188(1%、2%、3%、4%、5%)及PEG6000(1%、2%、3%、4%、5%)进行单因素考察,结果P407用量越高,g越低;P188用量越高,g越高;PEG6000用量越高,g越高,且PEG6000用量超过3%时凝胶黏度降低,用量为5%时温度加热至55 ℃仍无法完全胶凝。
2.5.2 Box-Behnken效应面法优化温敏凝胶基质处方 使用Design Expert 8.0.6软件,根据单因素考察的试验结果,选择P407用量(1)、P188用量(2)、PEG6000用量(3)为主要影响因素,并确定其用量范围:120%~24%、21%~5%、31%~3%,以g为评价指标进行处方优选,根据星点设计的原理,各因素设置3水平,用代码值−1、0、+1来表示,以g为评价指标进行处方优选,Box-Behnken效应面法实验的因素水平、实验设计及结果见表1。
2.5.3 方差分析与显著性检验 采用ANOVA分析实验数据,由表2的各回归系数的显著性检验可得,模型方程中1、2、3均为对g有极显著影响。
2.5.4 模型拟合 根据实验结果,应用Design Expert 8.0.6软件进行二次多项式逐步回归拟合,得到方程:g=30.66-4.341+1.752+1.943-0.4012-0.8313+0.3523-0.1412-0.01722-1.5432。通过方程可以看出,在测定范围内,随着1的升高,胶凝温度明显降低,而随着2、3的升高,胶凝温度明显升高。该模型<0.000 1,表明有极显著性差异;相关系数2=0.985 8,表明该模型预测值与测定值的相关性良好。失拟项=0.102 1>0.05,不具有显著性,表明方程拟合度和可信度良好。利用Design Expert 8.0.6软件绘制实验结果的二维等高线图和三维效应图见图2。

表1 Box-Behnken效应面法实验的因素水平、实验设计与结果
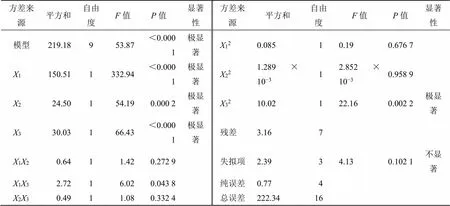
表2 各项因素回归系数和方差分析

图2 X1、X2、X3对Tg影响的效应面图与等高线图
2.5.5 优化工艺验证 通过分析结果,并将胶凝温度控制在34~36 ℃,从而得到最佳处方为1=20.10%,2=2.54%,3=2.00%;即P407 20.10%,P188 2.54%,PEG6000 2.00%。按优化工艺制备3批温敏凝胶,测定其g,实测值为(34.2±0.2)℃(=3),预测值为34.15 ℃,偏差为0.73%。
2.6 凝胶载药量的考察
2.6.1 载药量对温敏凝胶性状的影响考察 采用上述最优处方,考察不同载药量,按照“2.3”项方法制备载药量为2%、3%、4%、5%、6%、7%、9%、10%、12%、15%、20%(按原粉计,且黄柏-白芷1∶1)的凝胶,比较以下性状,结果见表3。
2.6.2 载药量对凝胶黏弹性区间及频率扫描曲线的影响考察 使用Anton Paar Physica MCR101型流变仪,试样用PP50不锈钢平行板(直径50 mm),间隙1 mm,测定储能模量(′)和损耗模量(″),测试均在(35.0±0.5)℃下进行。通过振幅扫描(应变为0.01%~100%,频率为10 rad/s)测定样品的线性黏弹区间,结果如图3所示,频率扫描(应变为1%,频率扫描范围0.1~100 Hz)如图4所示。
由上述结果可知,载药量对温敏凝胶的黏弹性及频率扫描曲线无显著性影响,但是随着载药量增加温敏凝胶的pH值也随之降低,并呈现出一定的pH值依赖性,当载药量过大时,温敏凝胶的胶凝温度开始下降,可能原因为载药量增加,pH值降低,溶液存在大量氢离子,从而影响了分子间氢键结合力,相邻分子间的缠结作用减弱,致使胶凝温度降低。综合以上结果确定最终凝胶载药量为5%。
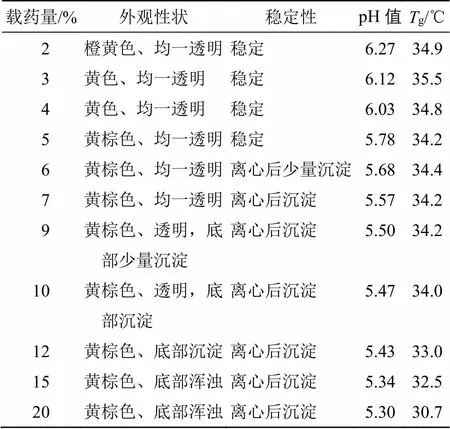
表3 不同载药量的考察
2.7 黄白温敏凝胶的质量评价
2.7.1 外观及性状观察 室温下,载药溶胶为黄棕色均匀分散的溶液,流动性好。相变温度以上(温度>34.2 ℃)载药凝胶为黄棕色的半固体,形态良好,透明均匀,有一定弹性,不能流动,见图5。

图3 不同载药量的线性黏弹区间图

图4 不同载药量的频率扫描曲线图
2.7.2 胶凝温度与胶凝时间的测定 采用“2.4”项下方法测定凝胶的胶凝温度为(34.2±0.2)℃,另取4 ℃冷藏24 h的温敏凝胶溶液,恢复至室温后,取5 mL于西林瓶中,放在35 ℃水浴锅中,以倒置西林瓶15 s凝胶溶液未发生流动时的时间作为该凝胶溶液的胶凝时间,平行测定3次,结果胶凝时间为(53.6±0.8)s。

图5 温敏凝胶形态
2.7.3 pH值的测定 使用pH计直接测定温敏凝胶的pH值,结果pH值为5.78±0.02,符合经皮给药制剂pH 5~7的要求。
2.7.4 离心、耐寒、耐热稳定性 取本品适量置于离心管中,分别于3000 r/min离心30 min、50 ℃和−20 ℃储存24 h,均未出现分层现象。
2.7.5 温敏凝胶的SEM观察 先将温敏凝胶制成冻干粉,取适量凝胶粉末,喷金,加速电压3.0 kV,采用场发射SEM[10-11]观察凝胶表面的微观结构形态及其孔径大小。结果温敏凝胶三维网状结构图见图6。

图6 温敏凝胶SEM图
2.7.6 温敏凝胶的渗透压的测定 采用Osmomat 030冰点渗透压计测定凝胶的渗透压[12],测得其平均渗透压为1302 mOsmol/kg,大于等渗溶液(280~320 mOsmol/kg),即其具有高渗作用,基于唐南平衡理论,表明该制剂应用于蛇虫咬伤所致的肿胀伤口,具有良好的消肿作用。
2.7.7 温敏凝胶的流变学性质考察[13-14]使用Anton Paar Physica MCR101型流变仪,试样用PP50不锈钢平行板(直径50 mm),间隙1 mm,除相变温度测定外其他均在(35.0±0.5)℃下进行测试。
(1)凝胶线性黏弹区(LVER):通过LVER测试结果可得到凝胶的内部三维网状结构被破坏所能承受的最大形变,振幅扫描(应变为0.01%~100%,频率为10 rad/s)测定样品的LVER的结果见图7。从图中可知应变()<1%,′>″,弹性占主体,既样品表现出凝胶结构,当>1%,′开始下降,当′=″时,凝胶结构完全被破坏,′<″,黏性占主体,表现出流体性质。因此,所有的动态振荡实验都需控制在1%以内。

图7 凝胶线性黏弹区间
(2)相变温度测定:在振荡模式下测量凝胶的溶胶-凝胶转变温度。频率固定在1 Hz,进行1%应变。样品以2 ℃/min的速率加热,温度范围在5~50 ℃。结果见图8和9。由图8可知,在34 ℃左右′和″相交,交点即其相变温度。在此温度前样品主要存在损耗模量,表现出明显的流体性质,相变温度后逐渐′>″,说明凝胶结构正在形成,且′和″趋于平缓,证明凝胶黏弹性趋于稳定。图9为通过复合黏度可表征样品整体的黏弹性质,随着温度的升高,样品的复合黏度发生突变,突变点即为凝胶的相变温度,与图8一致。
(3)频率扫描:频率扫描旨在描述样品在非破坏性变形范围内的时间相关特性,在振荡模式下对凝胶进行频率扫描(应变为1%,频率扫描范围0.1~100 Hz)。高频率指在较短时间尺度内的快速运动,而低频率指在较长时间尺度内的缓慢运动或静止状态。可用于表征凝胶内部结构的长期稳定性。结果如图10所示。在整个频率扫描范围内中,′曲线始终高于″曲线,表现出明显的以弹性为主的特性,且′较稳定,未出现显著的频率依赖性,表明凝胶始终具有稳定的三维网状结构。

图8 动态温度扫描图

图9 复合黏度随温度变化扫描图
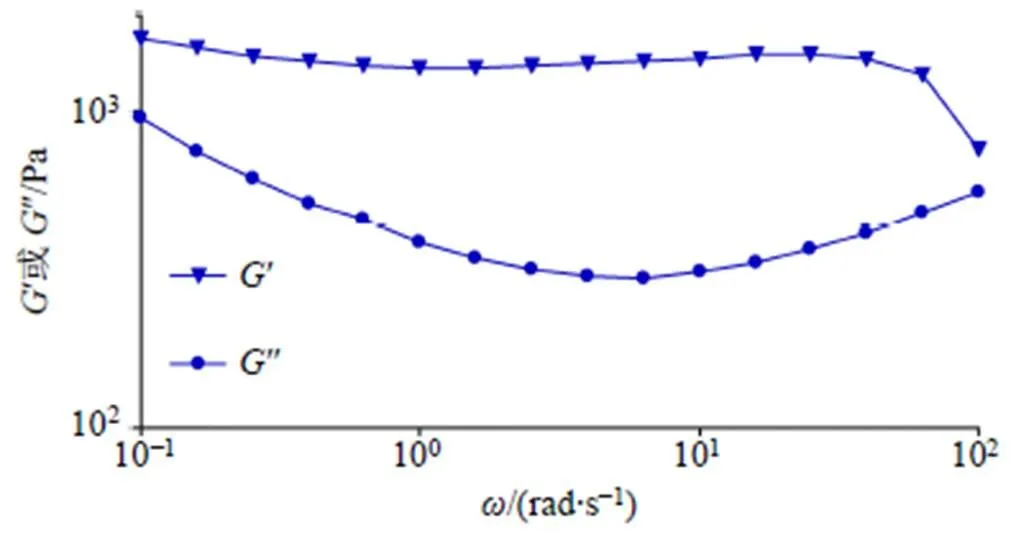
图10 频率扫描图
2.8 温敏凝胶离体经皮渗透性研究[15-16]
2.8.1 白芷中欧前胡素经皮渗透方法学的建立
(1)色谱条件:菲罗门C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液(75∶25);体积流量1.0 mL/min;检测波长300 nm;进样20 μL;柱温30 ℃。理论塔板数≥5000,分离度>1.5。
(2)对照品溶液的配制:精密称定欧前胡素对照品适量于量瓶中,加甲醇定容并制成欧前胡素质量浓度为14.75 μg/mL的对照品储备液,低温密封储存,备用。
(3)专属性试验:精密吸取欧前胡素对照品溶液、药物凝胶透皮接收液、空白凝胶透皮接收液各20 μL,按“2.8.1(1)”项色谱条件测定,记录色谱图(图11),结果表明方法专属性良好。
(4)线性关系考察:取欧前胡素对照品储备液,用甲醇依级稀释至7.38、3.69、1.84、0.92、0.46、0.23 μg/mL的系列欧前胡素对照品溶液,0.22 μm微孔滤膜滤过,将对照品溶液注入液相色谱仪,按“2.8.1(1)”项方法测定峰面积。以对照品质量浓度为横坐标(),峰面积积分值为纵坐标(),绘制标准曲线,结果显示欧前胡素的线性方程为=34.857-0.916 6,=1.000 0,结果表明欧前胡素在0.23~14.75 μg/mL线性关系良好。

图11 欧前胡素对照品(A)、药物凝胶透皮接收液(B)和空白凝胶透皮接收液(C)的HPLC图
(5)精密度试验:精密吸取0.92 μg/mL欧前胡素对照品溶液20 μL,按“2.8.1(1)”项方法重复进样6次,测定峰面积,结果欧前胡素峰面积的RSD为0.59%,表明仪器精密度良好。
(6)重复性试验:平行制备透皮供试品溶液6份,按“2.8.1(1)”项方法测定,计算的欧前胡素质量浓度的RSD为4.37%,结果表明该实验重复性良好。
(7)稳定性试验:取同一供试品溶液,分别于0、2、4、6、8、12、24 h进样,测定峰面积,计算其峰面积的RSD为0.34%。结果表明供试品溶液在24 h内稳定性良好。
(8)加样回收率试验:精密吸取1.88、3.76、7.36 μg/mL欧前胡素对照品储备液,用空白凝胶透皮接收液配制低、中、高质量浓度的质控样品,各平行3份,按“2.8.1(1)”项下色谱条件测定,并计算加样回收率,结果平均加样回收率为101.64%,RSD为2.08%。
2.8.2 黄柏中盐酸小檗碱经皮渗透方法学的建立
(1)色谱条件:菲罗门C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸溶液(50∶50)(每100毫升加十二烷基磺酸钠0.08 g);体积流量1.0 mL/min;柱温30 ℃,检测波长265 nm,进样量5 μL。
(2)对照品溶液的配制:精密称定盐酸小檗碱对照品适量于量瓶中,加甲醇定容并制成盐酸小檗碱质量浓度为125.00 μg/mL的对照品储备液,低温密封储存,备用。
(3)专属性试验:精密吸取盐酸小檗碱对照品溶液、药物凝胶透皮接收液、空白凝胶透皮接收液各5 μL,按“2.8.2(1)”项色谱条件测定,记录色谱图(图12),结果表明方法专属性良好。
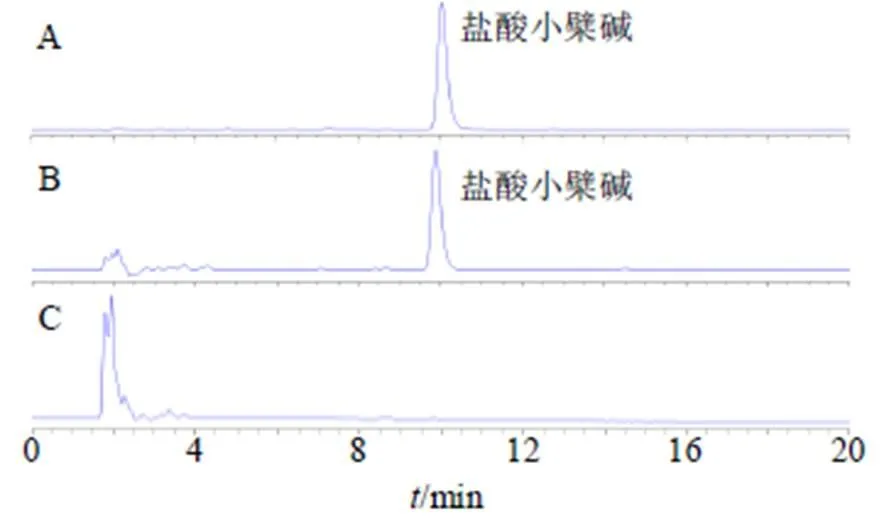
图12 盐酸小檗碱对照品(A)、药物凝胶透皮接收液(B)和空白凝胶透皮接收液(C)的HPLC图
(4)线性关系考察:取盐酸小檗碱对照品储备液,用甲醇依级稀释至62.50、31.25、15.63、7.81、3.91、1.96 μg/mL的系列盐酸小檗碱对照品溶液,0.22 μm微孔滤膜滤过,将对照品溶液注入液相色谱仪,按“2.8.2(1)”项方法测定峰面积。以对照品质量浓度为横坐标(),峰面积积分值为纵坐标(),绘制标准曲线,结果显示欧前胡素的线性方程为=11.231-10.604,=0.999 8,结果表明盐酸小檗碱在1.96~125.00 μg/mL线性关系良好。
(5)精密度试验:精密吸取15.63 μg/mL盐酸小檗碱对照品溶液5 μL,按“2.8.2(1)”项方法重复进样6次,测定峰面积,结果盐酸小檗碱峰面积的RSD为0.15%,表明仪器精密度良好。
(6)重复性试验:平行制备透皮供试品溶液6份,按“2.8.2(1)”项方法测定,计算盐酸小檗碱质量浓度的RSD为2.19%,结果表明该实验重复性良好。
(7)稳定性试验:取同一供试品溶液,分别于制备后0、2、4、6、8、12、24 h进样,测定峰面积,计算盐酸小檗碱峰面积的RSD为0.13%。结果表明供试品溶液24 h内稳定性良好。
(8)加样回收率试验:精密吸取15.63、31.25、62.50 μg/mL盐酸小檗碱对照品储备液,用空白凝胶透皮接收液配制低、中、高质量浓度的质控样品,各平行3份,按“2.8.2(1)”项色谱条件测定,并计算加样回收率,结果平均加样回收率为104.16%,RSD为0.38%。
2.8.3 小鼠离体皮肤的制备 选取18~22 g健康SPF级昆明雄性小鼠,剃除腹部毛发,麻醉后剃毛,快速分离腹部皮肤,用脱脂棉擦除皮下脂肪及黏液组织,生理盐水冲洗,滤纸吸干水分后用铝箔纸包裹,于−20 ℃冻存备用。
2.8.4 离体透皮渗透扩散装置及条件 采用改良Franz扩散池,扩散面积1.825 cm2,接收池容积为12 mL,恒温水浴温度控制在(37.0±0.5)℃,转速设定为300 r/min,每次取样量为1 mL。将制备好的小鼠腹部皮肤按照扩散池面积裁剪,置于扩散池与接收池之间,真皮层面向接收池。接收池中放入磁力搅拌子,并加入含30%乙醇溶液的生理盐水12 mL,使用前超声脱气。将1 mL凝胶均匀涂抹于皮肤表面,平行6份。分别于4、6、8、10、12、24 h精密移取接收液1 mL,同时立即补加等量的空白接收液,以保证接收液环境不变。接收液以0.22 µm的微孔滤膜滤过,备用。
2.8.5 数据分析[17]药物的累积透过量(Q)的计算公式如下。

表示有效扩散面积(1.825 cm2),为接收液总体积(12 mL),V为取样体积(1 mL),C为第次取样时接收液中药物的质量浓度,C表示第次取样时接收液中药物的质量浓度
以药物的Q为纵坐标,时间为横坐标,并采用零级、一级、Higuchi、Ritger-Peppas、Hixon-Crowell模型对-进行模型拟合,同时对曲线中的直线部分进行线性回归,求出的直线斜率即为稳态透皮速率[s,μg/(cm2·h)],实验结束后,取下皮肤,生理盐水洗净,将给药部分皮肤剪碎后,加入甲醇1 mL,超声30 min,于8000 r/min离心10 min,取上清液,0.22 μm微孔滤膜滤过,测定含量,并计算药物滞留量(s,s=/,为有效扩散面积,为溶解样品体积,为测得的药物质量浓度),结果见图13和表4。黄白温敏凝胶中欧前胡素与盐酸小檗碱的释药均Huguchi释放动力学方程,且Ritger-Peppas方程拟合系数均大于0.89。
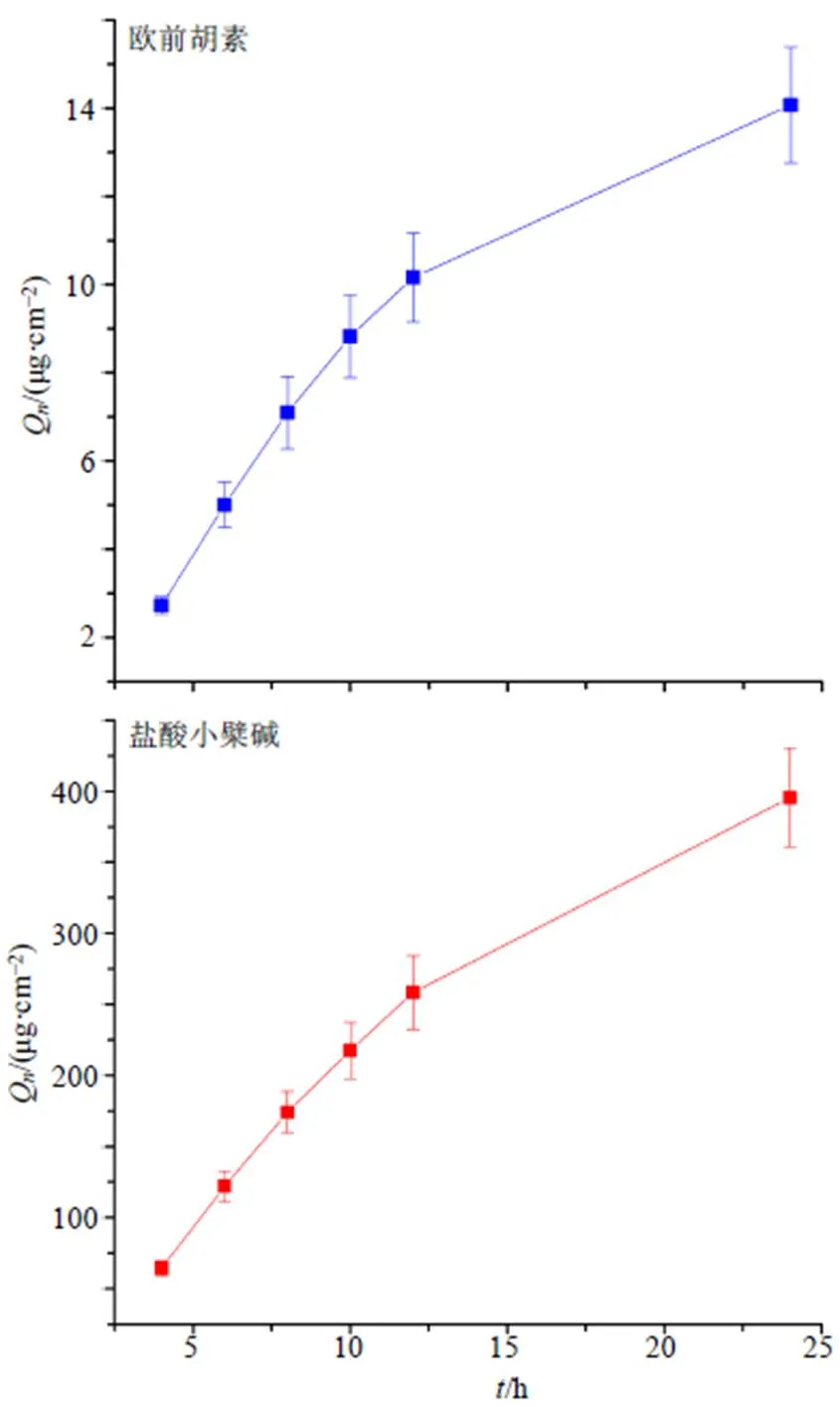
图13 温敏凝胶中欧前胡素和盐酸小檗碱累积透过量(, n = 5)
3 讨论
温敏凝胶是一种新型的智能缓释制剂,其凝胶过程不需要额外的添加剂和化学反应参与,且温度是生物体本身所具备的一种体征,故其自发现以来一直是医药领域的研究热点,已被应用于黏膜给药、注射给药、直肠给药及经皮给药等。
在凝胶剂的制备过程中,通常以水作为介质,故只能溶解水溶性药物,当需要在凝胶体系中加入不溶于水或难溶于水的药物时,亲水性助溶剂的使用是必要的。本研究使用Turbiscan Lab稳定性分析仪比较了不同助溶剂对温敏凝胶体系的稳定性影响,其优点在于:①温敏凝胶在常温下呈液态溶胶状态,符合Turbiscan Lab稳定性分析仪的测定要求;②仪器测量时采用非进入式方法,不稀释,无外力,不搅动,可直接表述分散体系的真实状态;③可准确、快速、完全地表征处方不稳定性和变化过程,为温敏凝胶的处方筛选和评价提供了理想手段。
本实验采用Box-Behnken响应面法[18]对处方进行了优化,二项式拟合效应面反映了P407、P188、PEG6000与温度的变化规律,且模型拟合度和可信度良好。此外,本研究还对温敏凝胶进行了表征,扫描电镜结果可看出温敏凝胶形成了一定的三维网状结构,且网状结构排列整齐,孔隙疏松,相互贯通;通过冰点渗透压仪测定其渗透压,发现以高分子材料制备的温敏凝胶剂具有高渗作用,基于唐南平衡理论,可知其作用于肿胀皮肤可以快速的反渗出肿胀部位的组织液,以达到良好的消肿止痛作用,这不仅解决了散剂由于矿物药加入,在溶解时放热和高浓度盐溶液环境带来的皮肤刺激性,同时水凝胶的使用也可以增加患者舒适性与适应性;同时还采用流变仪对温敏凝胶流变学性质进行了评价,流变学特性是凝胶剂的重要特征[19],相对于黏稠度、硬度、涂展性这类宏观且主观性质评价,流变学的精确度、可信度、重复性更高[20],且获得的参数对于分析凝胶结构、凝胶强度、黏弹性、胶凝行为、物理稳定性等具有更高价值和意义,并使凝胶剂的质量评价更趋科学化[21]。
表4 欧前胡素和盐酸小檗碱的经皮渗透动力学参数(,n = 5)
本实验采用Franz扩散池法研究了黄白温敏凝胶的体外经皮吸收行为,结果显示其中欧前胡素和盐酸小檗碱的累积渗透量Q-模型拟合均符合Huguchi释放动力学方程,表明药物释放存在一定的缓释效果,且Ritger-Peppas方程拟合系数大于0.89,说明释药机制骨架溶蚀作用。
由于本实验主要研究了完整皮肤的经皮渗透性,而临床实际情况为被蛇虫咬伤的破损皮肤,故后期应该增加其他更深入的研究从而更真实的描述药物的经皮吸收行为。
利益冲突 所有作者均声明不存在利益冲突
[1] 王志强, 陈思婷, 吴事仁, 等. 王万春运用中医药综合治疗毒蛇咬伤经验 [J]. 光明中医, 2017, 32(12): 1706-1708.
[2] Wang W, Wat E, Hui P C,. Dual-functional transdermal drug delivery system with controllable drug loading based on thermosensitive poloxamer hydrogel for atopic dermatitis treatment [J]., 2016, 6: 24112.
[3] Qi X J, Liu X Y, Tang L M,. Anti-depressant effect of curcumin-loaded guanidine-chitosan thermo-sensitive hydrogel by nasal delivery [J]., 2020, 25(3): 316-325.
[4] Gong C, Qi T, Wei X,. Thermosensitive polymeric hydrogels as drug delivery systems [J]., 2013, 20(1): 79-94.
[5] Bordes C, Snabre P, Frances C,. Optical investigation of shear- and time-dependent microstructural changes to stabilized and depletion- flocculated concentrated latex sphere suspensions [J]., 2003, 130(1/2/3): 331-337.
[6] 孙美洁, 郑剑平, 王浩, 等. 利用Turbiscan Lab稳定性分析仪研究水焦浆的稳定性 [J]. 石油学报: 石油加工, 2016, 32(6): 1164-1170.
[7] 卢浩扬, 林媛媛, 车俊秀, 等. 星点设计-效应面法优化芷芎散温敏凝胶的处方及其鼻黏膜渗透特性研究 [J]. 中草药, 2014, 45(13): 1845-1849.
[8] 梁浩明, 龙晓英, 卢彬. 黄芩苷外用温敏凝胶的处方设计及优化 [J]. 中国实验方剂学杂志, 2014, 20(24): 34-38.
[9] 刘媛媛. 温敏型眼用葛根素原位凝胶的制备与质量评价 [J]. 华西药学杂志, 2019, 34(3): 132-136.
[10] 潘亚辉, 高树中. 基于温度响应性纳米复合物对脐疗新制剂及药物释放的研究 [J]. 中华中医药杂志, 2019, 34(5): 2145-2149.
[11] 罗尧尧, 廖倩, 王婷, 等. 美洲大蠊温敏凝胶的制备及其促糖尿病大鼠创面修复作用考察 [J]. 中国实验方剂学杂志, 2020, 26(14): 164-172.
[12] 李春雨, 张丹参, 王树, 等. 珍珠滴眼凝胶的渗透压测定 [J]. 河北北方学院学报: 医学版, 2009, 26(1): 16-18.
[13] 唐随意. 布地奈德温敏凝胶灌肠液的研究 [D]. 武汉: 湖北中医药大学, 2019.
[14] 李曼. 托吡卡胺眼用温度敏感原位凝胶的研制 [D]. 重庆: 第三军医大学, 2014.
[15] 管咏梅, 宋昕祁, 刘佳, 等. 解郁安神凝胶贴膏剂的处方优选与质量评价 [J]. 中草药, 2019, 50(23): 5731-5738.
[16] 刘丽丽, 史畑女, 方蕾, 等. 马钱子总碱-白芍总苷脂质立方液晶纳米粒制备及体外评价 [J]. 中草药, 2019, 50(17): 4076-4083.
[17] 夏爱晓, 蒋正立, 李胜英, 等. 马来酸噻吗洛尔温敏凝胶的制备及体外透皮考察 [J]. 中国药师, 2020, 23(7): 1453-1456,1463.
[18] 甘帅, 章津铭, 江茂源, 等. 基于响应面法优选美洲大蠊口腔原位温敏凝胶的制备研究 [J]. 中草药, 2020, 51(8): 2134-2140.
[19] Pisal P B, Patil S S, Pokharkar V B. Rheological investigation and its correlation with permeability coefficient of drug loaded carbopol gel: Influence of absorption enhancers [J]., 2013, 39(4): 593-599.
[20] 郑学晶, 刘芳蓓, 裴莹, 等. 水凝胶流变学研究概况 [J]. 高分子通报, 2017(5): 1-10.
[21] Siska B, Snejdrova E, Machac I,. Contribution to the rheological testing of pharmaceutical semisolids [J]., 2019, 24(1): 80-88.
Selection and evaluation of prescription of temperature-sensitive-gel ofand(Yellow-white)
ZHU Wei-feng1, LIU Shui-ting1, WANG Wan-chun2, GUAN Yong-mei1
1. Key Laboratory of Modern Preparation of Traditional Chinese Medicine (TCM) of Ministry of Education, Jiangxi University of TCM, Nanchang 330004, China 2. Department of External Medicine, Affiliated Hospital of Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
To select and optimize theand(Yellow-white) thermosensitive in-situ gel, and to investigate its transdermal permeability.Using poloxamer 407, poloxamer 188, and PEG6000 as gel matrix materials, and taking gelation temperature as investigation index, Box-Behnken response surface method was used to optimize the gel matrix prescription. At the same time, the thermosensitive gel was characterized, and the transdermal permeability of drugs in the yellow-white thermosensitive in-situ gel was investigated by Franz transdermal diffusion cell.The best prescription of thermosensitive in-situ gel is P407 20.10%, P188 2.54%, PEG6000 2.00%, and the gelation temperature is (34.2 ± 0.2) ℃. Within 24 h, the cumulative permeation of imperatorin and berberine were (14.07 ± 1.34) and (395.72 ± 35.04) μg/cm2, respectively, and the release process of imperatorin and berberine followed Higuchi kinetic equation.The gel prepared in this study has temperature sensitivity and slow release, which can lay the foundation for clinical preparation for treating snake and insects bites.
yellow-white temperature sensitive in situ gel; optimization of prescription; Box-Behnken response surface methodology; percutaneous permeability; imperatorin; berberine hydrochloride; Higuchi kinetic equation; temperature sensitive; release slowly
R283.6
A
0253 - 2670(2021)07 - 1914 - 10
10.7501/j.issn.0253-2670.2021.07.008
2020-11-20
国家自然科学基金地区基金项目(82060722);江西省自然科学基金面上项目(20202BAB206081)
朱卫丰,教授,博士研究生导师,博士,研究方向为中药新剂型与新制剂研究。E-mail: zwf0322@126.com
管咏梅,博士,副教授,硕士生导师,研究方向为药物新剂型、新技术。Tel: (0791)87118614 E-mail: guanym2008@163.com
[责任编辑 郑礼胜]

