不同粒径波棱甲素纳米混悬剂的制备及药动学研究
杭凌宇,申宝德,沈成英,杨 阔,袁海龙*
·药剂与工艺·
不同粒径波棱甲素纳米混悬剂的制备及药动学研究
杭凌宇1, 2,申宝德2,沈成英2,杨 阔1,袁海龙2*
1. 江西中医药大学药学院,江西 南昌 330004 2. 空军特色医学中心 药学部,北京 100042
制备不同粒径波棱甲素纳米混悬剂(herpetrione nanosuspension,Her-NS),并探讨粒径对Her-NS口服生物利用度的影响。采用反溶剂沉淀法制备2种不同粒径Her-NS,采用单因素实验以平均粒径、多分散系数、稳定性指数为评价指标优化处方工艺参数,扫描电子显微镜(SEM)观察Her-NS形态,X射线衍射(XRD)分析晶型,透析法研究体外释放特性。通过SD大鼠比较2种不同粒径Her-NS口服药动学差异。以P188、P407为稳定剂分别制备了200、450 nm 2种不同粒径Her-NS(Her-NS200、Her-NS450),SEM显示2种粒径的Her-NS均为球状,XRD分析表明2种粒径Her-NS均为无定型态。体外释放度与药动学结果显示,与波棱甲素原料药比较,2种粒径Her-NS的累积释放度明显提高,Her-NS的达峰浓度(max)、药时曲线下面积(AUC0~t)均显著提高;Her-NS200的max、AUC0~t均高于Her-NS450。Her-NS可明显提高波棱甲素口服生物利用度,且粒径越小,生物利用度越高。
波棱甲素;反溶剂沉淀法;纳米混悬剂;粒径;体外释放;药动学;口服生物利用度
波棱瓜子是葫芦科波棱瓜属植物波棱瓜Wall.的干燥成熟种子,为藏医临床治疗肝病的常用药物之一[1]。波棱瓜子药用历史悠久,疗效确切,其味苦,性寒,能清腑热、胆热,具有清热解毒、去火降热、助消化的作用,用于治疗肝热、黄疸性传染型肝炎等[1]。现代研究表明,波棱瓜子具有保肝降酶、抗乙型肝炎病毒(hepatitis B virus,HBV)及抗肝纤维化等多种药理作用[2-3]。波棱甲素(herpetrione,Her)分子式为C30H32O10,相对分子质量552.579,是从波棱瓜子的中分离得到的活性木脂素单体化合物[4-5],其对-氨基半乳糖诱导的小鼠急性肝损伤具有明显的保护作用,可有效抑制HepG2.215细胞乙型肝炎表面抗原HBsAg和乙型肝炎e抗原HBeAg的表达及HBV-DNA的复制,并呈现一定的剂量相关性。但它在水中几乎不溶,属于难溶性木脂素类药物,口服生物利用度低,极大地限制了该药物的临床应用。
纳米混悬剂(nanosuspension,NS)是由药物粒子与少量稳定剂组成的亚微胶体分散体系[6-7],不同于传统意义上的基质骨架型纳米体系,NS辅料添加少,载药量高,尤其适用于难溶性中药有效成分及有效部位的开发[8]。近年来,NS的体内行为越来越受到关注。研究发现,粒径通过影响表观溶解度及其在生物膜上的通透性和转运途径从而影响NS的吸收和分布[9-11]。
本实验采用反溶剂沉淀法制备2种不同粒径的Her-NS,以平均粒径(PS)、多分散指数(PDI)及稳定性指数(SI)为指标,通过单因素实验优化处方和工艺,利用扫描电子显微镜(SEM)、X射线衍射分析(XRD)观察其形态、晶型变化,并进行初步的药动学研究。
1 仪器与试药
LCMS-2010EV高效液相色谱仪,日本岛津公司;Winner802纳米粒度仪,济南微纳颗粒仪器股份有限公司;BT125D分析天平,北京赛多利斯科学仪器有限公司;DF-101D集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;KH5200DB型数控超声波清洗器,昆山禾创超声仪器有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;WH861涡旋混合器,北京科尔德科贸有限公司;S-4800扫描电子显微镜,日本日立公司。
波棱甲素,质量分数≥95%,实验室自制,批号SPR190505-KZ01;泊洛沙姆188(P188)、泊洛沙姆407(P407)均购于北京凤礼精求商贸有限责任公司;羟丙甲纤维素HPMC-E15、HPMC-E50,购自安徽山河药用辅料有限公司;甲醇、乙腈为色谱纯;其他试剂为分析纯。
SD大鼠,雄性,体质量(200±20)g,SPF级,北京科宇动物养殖中心,动物许可证号SCXK(京)2018-0010。动物实验经空军特色中心伦理委员会批准,批准文号:空特(科研)第2020-148-PJ01。
2 方法与结果
2.1 波棱甲素纳米混悬剂(Her-NS)的制备
采用反溶剂沉淀法制备Her-NS[12-13]。称取50 mg Her粉末,溶于0.25 mL乙醇溶液中,超声使其充分溶解。然后在磁力搅拌条件下,将含有Her的乙醇溶液快速倒入到5 mL含有一定量稳定剂溶液中,减压旋蒸挥去有机溶剂,补充适量去离子水定容至原体积,即得Her-NS。
2.2 粒径分析
取适量Her-NS,加蒸馏水稀释20倍,采用纳米粒度仪测定PS与PDI,重复测定3次,取平均值。
2.3 SI的测定
取适量Her-NS于离心管中,1500 r/min离心30 min,取上层混悬液,加蒸馏水稀释20倍,采用纳米粒度仪测定PS与PDI,重复测定3次,取平均值,Her-NS的稳定性通过SI进行评估,SI值越接近1,表示Her-NS越稳定。
SI=离心前PS/离心后PS
2.4 单因素考察
本实验以纳米混悬剂的PS、PDI和SI为评价指标,分别对稳定剂种类、稳定剂用量、联合稳定剂比例、药物与稳定剂比例、搅拌转速5个因素进行考察。
2.4.1 稳定剂种类的筛选 固定稳定剂用量为0.6%,药物与稳定剂比例为2∶1,搅拌转速600 r/min,考察P188、P407、羟丙基甲基纤维素(HPMC)E15和HPMC E50[14]对Her-NS的PS、PDI和SI的影响,结果见图1和表1。以HPMC系列作为稳定剂,所制备的混悬液不稳定,易产生药物黏壁的现象。单独以P407为稳定剂时,Her-NS的PDI虽然小于0.3(SI>0.75),但粒径较大;单独以P188为稳定剂时,纳米混悬剂的粒径小,但PDI大于0.3或SI<0.60;因此,选择将P188和P407联用作为Her-NS的稳定剂。
2.4.2 稳定剂用量的筛选 固定药物与稳定剂比例为2∶1,稳定剂(P188-P407)比例为2∶1,搅拌转速600 r/min,搅拌时间20 s,稳定剂用量分别为0.2%、0.4%、0.6%、0.8%,按照“2.1”项下方法制备Her-NS,考察联合稳定剂用量对PS、PDI和SI的影响,结果见表2。随着稳定剂用量的增加,纳米混悬剂的PS及PDI呈先降低后升高趋势,当稳定剂用量为0.6%时,PS、PDI和SI最佳。
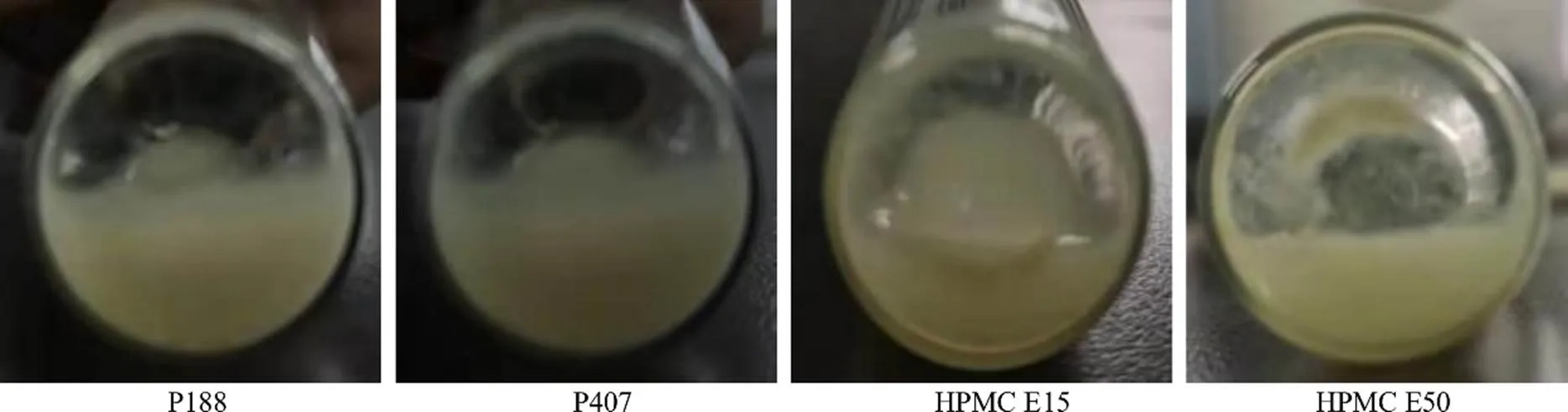
图1 稳定剂种类的影响
表1 稳定剂种类对Her-NS的PS、PDI和SI的影响 (,n = 3)
与P188比较:*<0.05
*< 0.05P188
2.4.3 稳定剂比例的筛选 固定药物与稳定剂比例为2∶1,稳定剂用量为0.6%,搅拌转速600 r/min,搅拌时间20 s,P188-P407比例分别为4∶1、2∶1、1∶1、1∶2,按照“2.1”项下方法制备Her-NS,并测定PS、PDI和SI,结果见表3。随着P407比例的增加,NS溶液PDI减小、SI增大,继续增加P407,Her-NS的粒径和PDI、SI无明显变化。当2种稳定剂比例达到1∶1时,可获得粒径相对较低,溶液状态良好,PDI合格、SI>0.75的NS。
表2 稳定剂用量对Her-NS的PS、PDI和SI的影响(,n = 3)
与稳定剂用量为0.6%组比较:*<0.05
*< 0.05the stabilizer dosage of 0.6% group
表3 稳定剂比例对Her-NS的PS、PDI和SI的影响(, n = 3)
与稳定剂比例1∶1组比较:*<0.05
*< 0.05the stabilizer ratio 1:1 group
2.4.4 药物与稳定剂比例的筛选 固定P188-P407比例分别为2∶1,稳定剂用量为0.6%,搅拌转速600 r/min,搅拌时间20 s,按照“2.1”项下方法制备Her-NS,对药物与稳定剂的比例(5∶1、5∶3、1∶1)进行考察,并测定PS、PDI和SI,结果见表4。当药物与稳定剂比例为5∶3时,各项指标较优。
2.4.5 搅拌速度 固定P188-P407比例分别为2∶1,药物与稳定剂的比例2∶1,稳定剂用量为0.6%,搅拌时间20 s,搅拌速度分别为400、600、800 r/min,按照“2.1”项下方法制备Her-NS,并测定PS、PDI和SI,结果见表5。Her-NS的粒径随搅拌速度增大而减小,当转速为400 r/min时,可获得粒径为450 nm左右的Her-NS(Her-NS450),当转速为600、800 r/min时,可获得粒径为200 nm左右的Her-NS(Her- NS200),但当转速为800 r/min时,PDI明显增加,SI减小,可能是由于转速过大导致液体产生气泡,使NS稳定性降低。
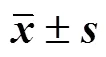
表4 药物与稳定剂比例对Her-NS的PS、PDI和SI的影响(, n = 3)
与药物与稳定剂比例5∶3组比较:*<0.05
*< 0.05the 5:3 group of drug and stabilizer ratio
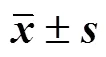
表5 搅拌速度对Her-NS的PS、PDI和SI的影响(, n = 3)
与搅拌速度600 r∙min−1组比较:*<0.05
*< 0.05the stirring speed 600 r∙min−1group
2.4.6 工艺条件的确定 称取稳定剂P407和P188(P407与P188比例1∶1,质量浓度6 mg/mL),置于5 mL去离子水中,搅拌使其充分溶解,得到稳定剂溶液。称取波棱甲素粉末50 mg,溶于0.25 mL乙醇溶液中,超声使其充分溶解,分别在400、600 r/min转速的磁力搅拌条件下,将含有药物的有机溶液快速倒入到稳定剂溶液中混合均匀,持续搅拌 20 s,减压挥去有机溶剂,补充适量去离子水定容至原体积,即得Her-NS450、Her-NS200。以PS、PDI和SI为指标进行测定,结果见表6。
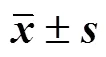
表6 Her-NS最佳工艺条件验证(, n = 3)
2.5 Her-NS的表征
2.5.1 形态观察 SEM观察Her-NS和波棱甲素原料药的形态,将样品适当稀释后,将Her-NS制剂滴在锡纸上,然后在20 mA电流下用金钯导电层溅射镀膜1 min,并在10 kV的加速激励电压下进行观察,Her-NS的形态见图2,波棱甲素原料药呈球状及不规则块状,棱角分明,大小不一,粒径在5~40 µm(图2-A);Her-NS200呈均匀球状(图2-B),粒径在150~200 nm;Her-NS450呈球状(图2-C),可看到纳米粒之间有黏附,其长径和短径不同;短径小于400 nm,长径在600~800 nm。
2.5.2 晶型表征 采用XRD分别对2种粒径的Her-NS及波棱甲素原料药晶型进行扫描分析。分别对波棱甲素原料药、P188、P407、波棱甲素与P188、P407的物理混合物及2种粒径的Her-NS样品进行XRD分析。工作条件:Cu靶,管电压40 kV,管电流60 mA。扫描速率2º/min,扫描2范围为3º~60º。结果(图3)显示,不同粒径的Her-NS及波棱甲素原料药相同的位置上均无衍射峰,说明波棱甲素制备成不同粒径的Her-NS,制备过程不会影响药物的晶型。

图2 Her-NS的SEM图
2.5.3 稳定性考察 将Her-NS200、Her-NS450在室温条件下分别放置7 d,每天取样,蒸馏水稀释20倍测定PS和PDI,结果如图4,Her-NS200、Her-NS450在室温条件下放置7 d,粒径分别在200、450 nm左右,PDI在0.25左右,表明Her-NS在7 d内物理稳定。
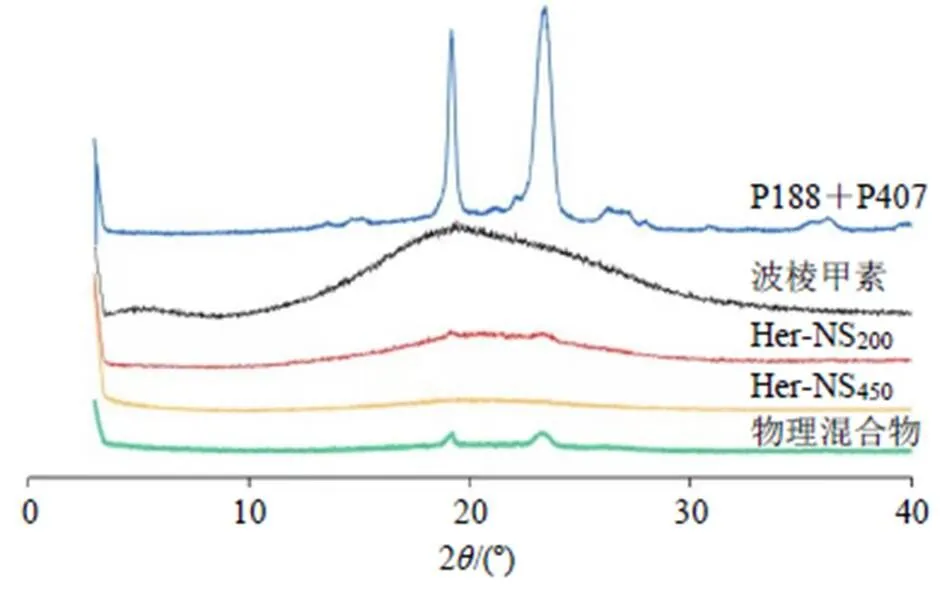
图3 Her-NS的XRD图
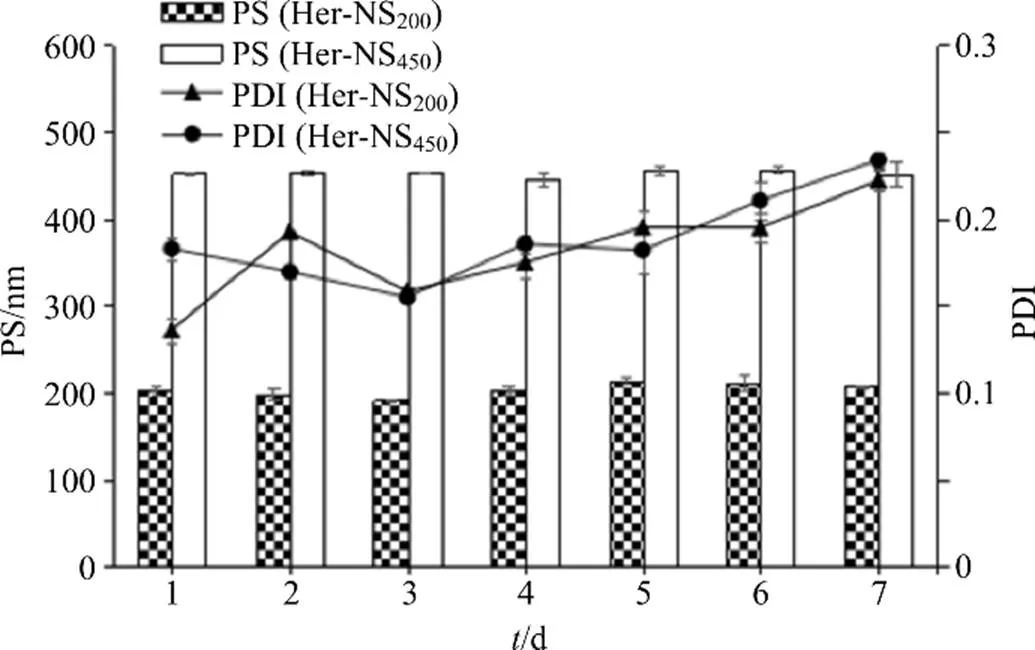
图4 Her-NS的粒径和PDI随时间的变化(n = 3)
2.6 体外释放度研究
2.6.1 色谱条件 色谱柱为Inertsil®ODS-3(250 mm×4.6 mm,5 μm),流动相为乙腈-2%醋酸水溶液(30∶70),检测波长280 nm,柱温30 ℃,进样量20 μL,体积流量1.0 mL/min,理论塔板数按波棱甲素峰计算不低于4500,色谱图见图5。
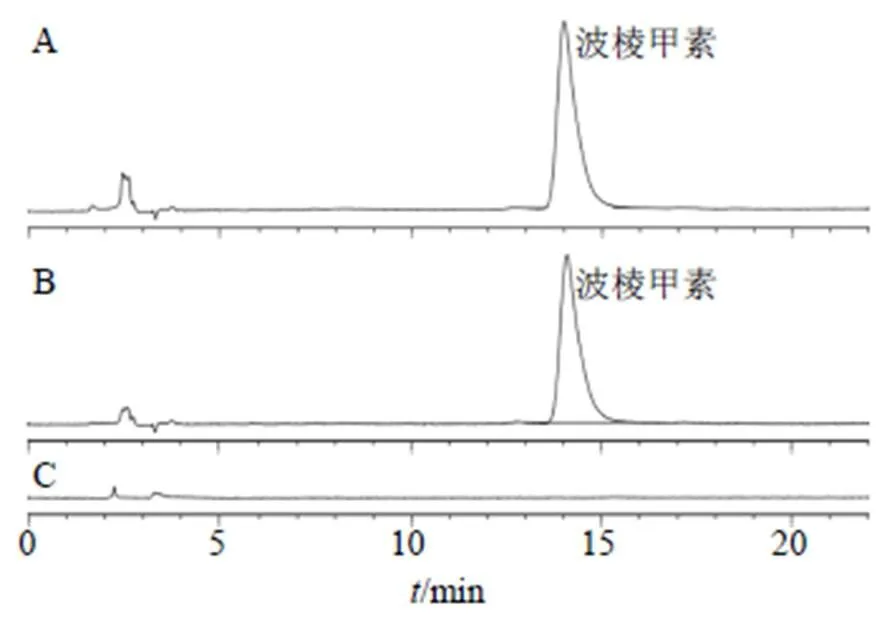
图5 波棱甲素对照品(A)、Her-NS样品(B)、空白(C)的HPLC图
2.6.2 对照品溶液的配制 精密称取波棱甲素对照品6.97 mg,置于10 mL量瓶中,加入一定量的甲醇超声溶解并定容至刻度,配成波棱甲素质量浓度为697 μg/mL的对照品储备液。
2.6.3 供试品溶液的配制 精密吸取新鲜制备的Her-NS 0.1 mL于10 mL量瓶中,加适量甲醇超声溶解,定容,滤过,精密吸取续滤液1 mL于10 mL量瓶中,甲醇定容至刻度线,摇匀即得供试品溶液。
2.6.4 线性关系考察 精密吸取对照品储备液用甲醇稀释成34.850、27.880、13.940、6.970、3.485 μg/mL的波棱甲素对照品溶液,用甲醇稀释并定容至刻度线,摇匀HPLC法依次测定各个质量浓度,以药物质量浓度()对峰面积()作线性回归,绘制标准曲线,得线性回归方程=25 051-52.926,=0.999 9,线性范围为3.485~34.850 μg/mL。
2.6.5 方法学验证 分别取低、中、高(3.485、13.940、34.850 μg/mL)3个质量浓度的波棱甲素对照品溶液,分别连续进样HPLC测定6次,计算各个质量浓度的精密度,结果显示,低、中、高质量浓度的波棱甲素对照品溶液RSD值分别为0.94%、0.19%、0.23%。表明仪器精密度良好。
按“2.6.3”项下制备供试品溶液,分别于0、1、2、4、8、12、24 h按色谱条件测定峰面积,观察峰面积比值变化情况,其RSD为1.71%,表明供试品溶液稳定性良好。
按照“2.6.3”项下分别制备6份供试品溶液,按色谱条件测定峰面积,计算NS中波棱甲素的量,其RSD为0.52%,表明该方法重复性良好。
精密量取已测定含量的同一供试品溶液9份各1 mL,分别加入对照品的量与其在NS中的量的比值为0.8∶1、1∶1、1.2∶1,每个比例3份,按“2.6.1”项下色谱条件进样测定,记录峰面积,计算加样回收率。结果低、中、高不同质量浓度的平均回收率分别为101.12%、102.74%、101.17%,RSD值均小于1.81%。表明回收率符合要求。
2.6.6 测定方法 采用透析袋扩散法测定Her- NS200、Her-NS450和波棱甲素在PBS(pH 7.4)中的释放行为。取溶液2 mL(相当于20 mg波棱甲素)及等质量浓度的波棱甲素溶液于截留相对分子质量8000的透析袋内,以200 mL蒸馏水作为溶出介质,控制温度为(37.0±0.5)℃,转速为100 r/min,于释放后1、2、4、6、8、12、16、22、24 h取样1 mL,同时补足等温等量的溶出介质,样品经微孔滤膜滤过,通过HPLC测定含量(以波棱甲素计)。并绘制释放度曲线,见图6。结果显示,在12 h内,Her-NS200、Her-NS450和波棱甲素的累积释放率分别为49.78%、40.76%、21.95%。在24 h内,分别在透析袋外检测到85.88%、80.10%、35.41%。在24 h内,与波棱甲素原料药相比,Her-NS200、Her-NS450的释放度显著提高(<0.05),粒径越小,累积释放度越大。
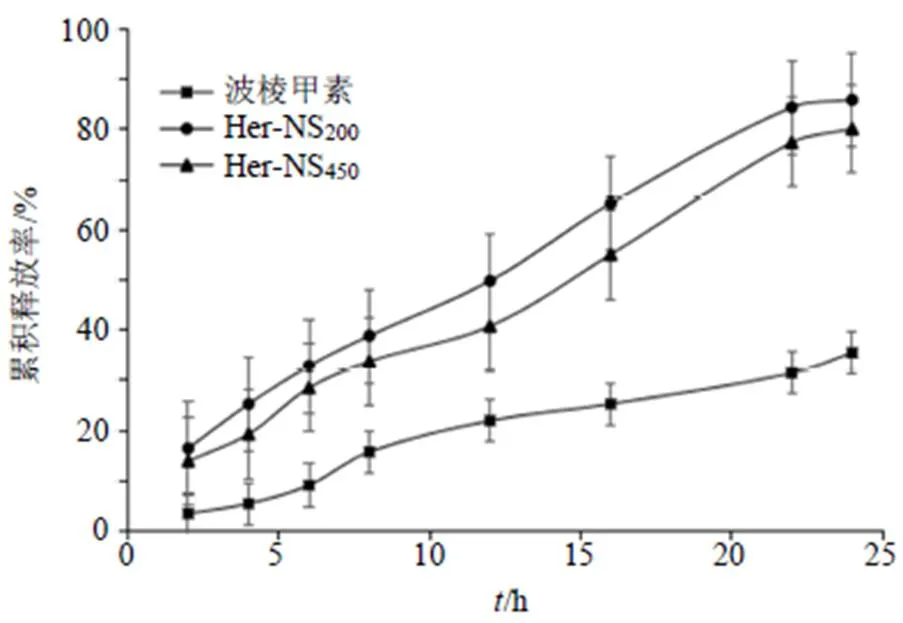
图6 Her-NS200、Her-NS450和波棱甲素原料药在PBS (pH 7.4) 中的体外药物释放曲线(n = 3)
2.7 体内药动学研究
2.7.1 给药方案与样品采集 SD大鼠18只,随机分为3组,每组6只,给药前禁食12 h,不禁水,分别ig给药Her-NS200、Her-NS450及波棱甲素原料药(0.5% CMC-Na配制的波棱甲素混悬液)。每只大鼠给药剂量为250 mg/kg(以波棱甲素计),给药后分别在0.083、0.25、0.5、1、2、3、4、6、8、12 h于大鼠眼底静脉丛取血,所得血样放置肝素浸润的离心管中,6000 r/min离心10 min后吸取上清液,待测。
2.7.2 血浆样品处理 精密移取空白血浆0.2 mL,置于具塞离心管中,加入600 μL的甲醇沉淀蛋白,涡旋振摇30 s,8000 r/min离心10 min,吸取上清液,在25 ℃下用氮气吹干,残渣加入100 μL甲醇溶解,充分涡旋振荡,8000 r/min离心10 min,取上清液40 μL进样分析。
2.7.3 色谱条件 色谱柱为Inter Sustain®C18(250 mm×4.6 mm,5 μm),流动相为乙腈-2%醋酸水溶液(30∶70),检测波长280 nm,柱温30 ℃,进样量40 μL,体积流量1.0 mL/min,理论塔板数按波棱甲素峰计算不低于4500。色谱图见图7。
2.7.4 方法专属性 取“2.7.2”项预处理后的空白血浆、空白血浆加标样品和含药血浆样品各40 μL进样分析,结果见图7。大鼠血浆中内源物质对波棱甲素的测定无干扰,该方法专属性强。
2.7.5 线性关系考察 取空白血浆0.2 mL,分别精密加入系列的波棱甲素对照品溶液,涡旋混匀,配制成0.945 1、1.890、3.780、5.671、7.561、9.451 μg/mL质量浓度的标准血浆样品。按“2.7.2”项下处理血浆样品,按“2.7.1”项色谱条件进行药物测定,以药物质量浓度()对峰面积()作线性回归,得标准曲线方程=47 700+29 285,=0.999 3,线性范围为0.945 1~9.451 μg/mL。
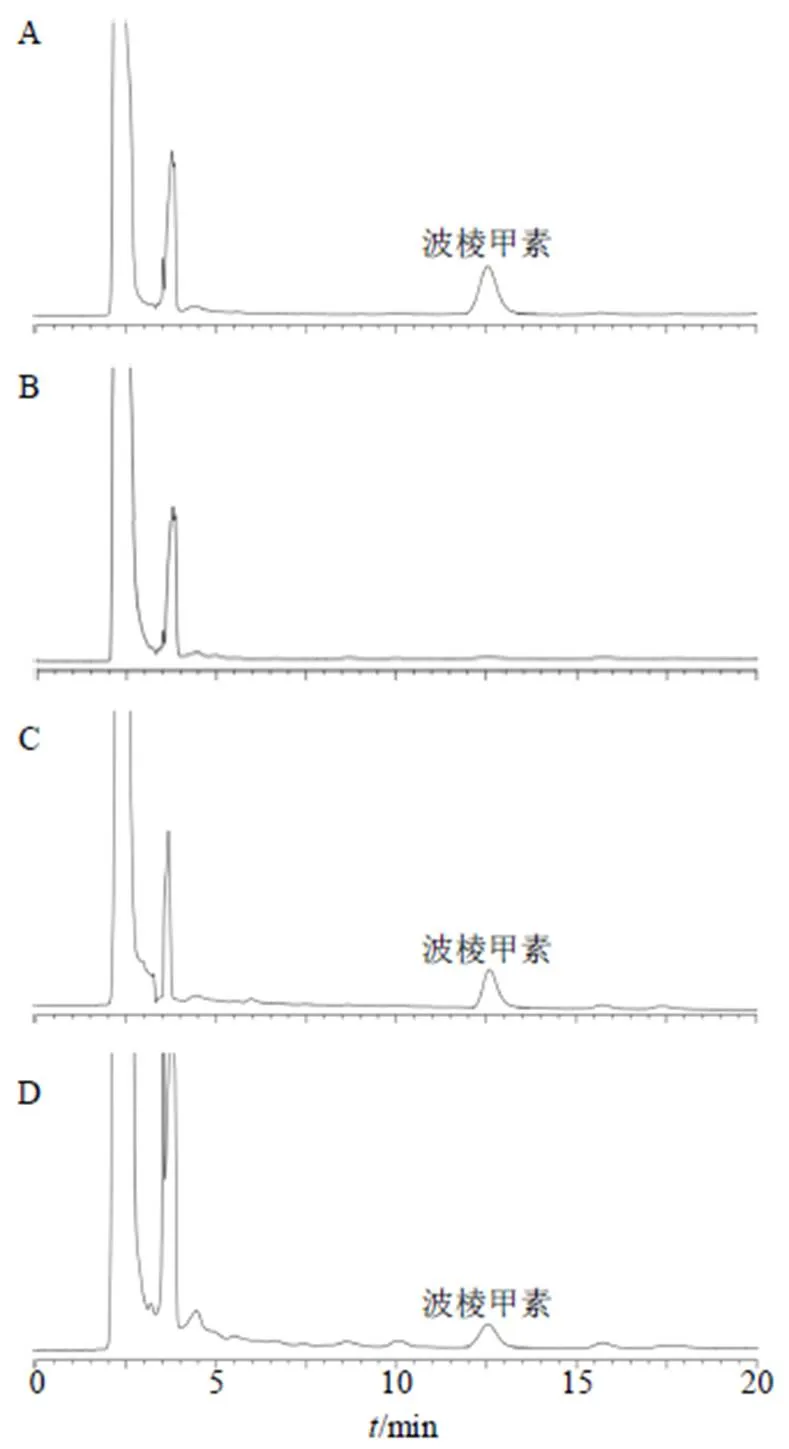
图7 波棱甲素对照品(A)、空白血浆样品(B)、空白血浆样品+波棱甲素对照品(C)和大鼠给药Her-NS1 h后血浆样品(D)的HPLC图
2.7.6 回收率试验 分别取高、中、低(7.561、3.780、0.945 1 μg/mL)3个质量浓度的加药血浆,经处理后进样测定,每个质量浓度平行测定5次,计算血浆药物质量浓度,所得质量浓度与实际质量浓度的比值即为回收率。高、中、低3个质量浓度的平均回收率分别为97.66%、101.35%、97.40%,RSD分别为1.19%、2.60%、2.67%(=5)。符合生物样品分析方法的基本要求。
2.7.7 精密度试验 分别取高、中、低(7.561、3.780、0.945 1 μg/mL)3个质量浓度的加药血浆按“2.7.2”项下方法处理,按“2.7.1”项色谱条件,进样测定,1 d内连续测定3次,计算日内精密度,每天测定1次并连续测定3 d,计算日间精密度。高、中、低3个质量浓度的日内精密度RSD分别为1.65%、1.93%、1.06%。日间精密度RSD则分别为1.78%、2.44%、2.36%(=3)。符合生物样品分析方法的基本要求。
2.7.8 稳定性试验 分别取高、中、低(7.561、3.780、0.945 1 μg/mL)3个质量浓度的加药血浆,各个血浆样品反复冻融3次,经处理后进样测定,考察其稳定性。高、中、低3种质量浓度的RSD分别为1.34%、3.23%、2.26%,结果显示,反复冻融不影响血浆样品的测定。
2.7.9 定量限和检测限 取波棱甲素对照品溶液,逐步稀释,HPLC测定各质量浓度对应信噪比(/)。以/=10为定量限,以/=3为检测限。结果显示,定量限为0.9 μg/mL,检测限为0.2 μg/mL。
2.7.10 血药浓度–时间曲线 以血药质量浓度对时间作图,血浆药物质量浓度-时间曲线见图8,药动学参数见表7,药-时曲线经拟合显示Her-NS在大鼠体内动力学行为符合二室模型。由图8和表7可知,大鼠ig给药后,2种粒径的Her-NS均在30 min达到血药峰浓度(max),max分别为(15.50±1.83)、(11.84±0.59)mg/L,与波棱甲素原料药相比,Her-NS的达峰时间(max)是波棱甲素的0.6倍,Her- NS200、Her-NS450max是波棱甲素(6.67±0.68)mg/L的2.32、1.78倍。表明Her-NS入血快,且血药浓度高。Her-NS200、Her-NS450的药-时曲线下面积(AUC0~t)分别为(32.55±7.69)、(27.18±4.50)mg/(L·h),分别是波棱甲素(12.84±0.81)mg/(L·h)的2.54、2.12倍。Her-NS中的max和AUC0~t较波棱甲素原料药都有了显著提高(<0.01),可见,Her-NS较波棱甲素更容易被吸收,Her-NS显著提高了波棱甲素的体内生物利用度。
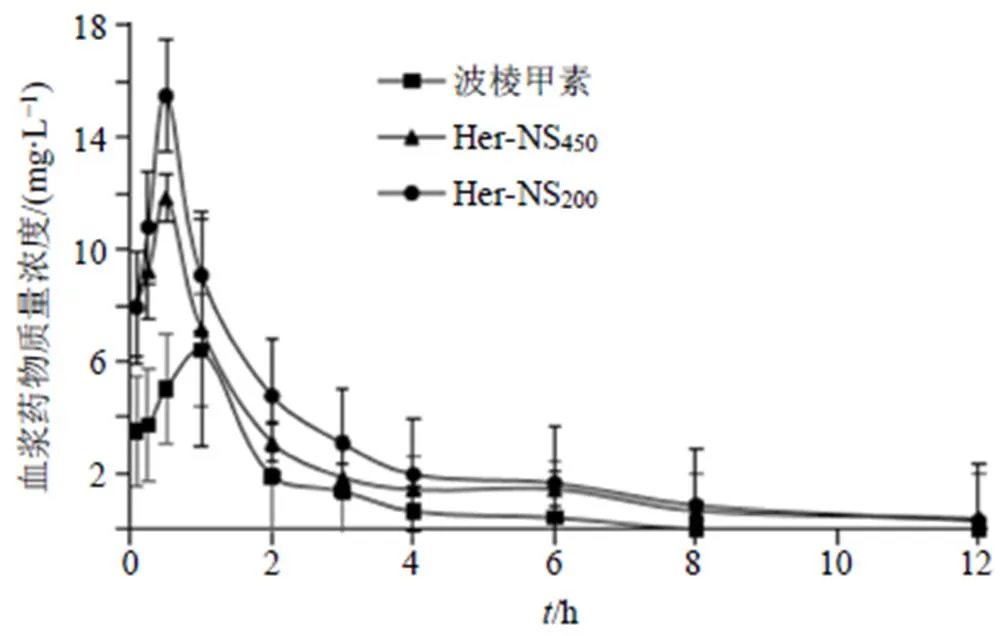
图8 Her-NS和波棱甲素(给药剂量250 mg∙kg−1)的血药浓度-时间曲线(, n = 6)
表7 大鼠ig给药Her-NS后的主要药动学参数(,n = 6)
与波棱甲素组比较:*<0.05**<0.01
*< 0.05**< 0.01herpetrione group
3 讨论
本实验采用反溶剂沉淀法制备纳米混悬剂,通过单因素实验优化,成功制备了2种不同粒径的Her-NS,即Her-NS-200、Her-NS-450。粒径分别为200 nm和450 nm左右;PDI小于0.2,SI大于0.75。表明粒径分布均匀[15]。本实验考察了稳定剂种类、稳定剂用量、联合稳定剂比例、药物与稳定剂比例、搅拌转速等因素对Her-NS粒径及PDI的影响,结果显示稳定剂的种类及搅拌转速对其影响较显著,这可能由于不同稳定剂对维持不同药物的NS体系效果不同,添加稳定剂是维持纳米混悬剂稳定性的主要方法,良好的稳定剂可以为纳米混悬剂提供足够的空间位阻或静电排斥力,以阻止粒子聚集[15-17]。在本研究中,单一稳定剂P188的应用虽然能够获得较小粒径的Her-NS,但是粒径分布较大,不稳定。研究报道,应用联合稳定剂可更好的保证纳米混悬剂的稳定性。本研究参考文献报道[14],应用联合稳定剂P188和P407,结合实验优化比例,从而得到较稳定的Her-NS。P188和P407均为聚合物,能够为Her-NS提供足够的空间位阻,以阻止粒子聚集,保证Her-NS的稳定。混合过程的搅拌转速可能影响沉淀过程的纳米粒形成与成长,低转速下,溶液分散慢,在反溶剂中聚集沉淀快,导致纳米粒粒径较大;而转速过高则因能量过度输入,打破体系原有平衡,导致已获得的纳米粒聚集,分布变差,PDI变大[13]。通过单因素实验,本研究确定将P188和P407联用作为Her-NS的稳定剂,所制备的NS粒径小、粒径分布较窄。本实验主要是探讨粒径对Her-NS药动学的影响,在确定处方的基础上,通过控制不同工艺参数获得不同粒径的Her-NS。扫描电镜结果显示,Her-NS200、Her-NS450均呈圆球状;XRD结果显示Her原料药及不同粒径的Her-NS均为无定型态,表明纳米化过程不会影响波棱甲素的形态及晶型。
体外释放度实验结果显示,Her-NS200、Her- NS450与波棱甲素原料药相比,Her-NS的累积释放度显著提高(<0.05),表明将波棱甲素制成Her-NS能提高其体外释放度。NS粒径与释放度呈负相关,这是因为随着粒径的减小,较大的比表面积导致NS[9]的溶解度较高[9,18]。
药动学实验结果显示,2种粒径的Her-NS的AUC0~t和max均显著高于波棱甲素(<0.01);表明波棱甲素制成纳米混悬剂后,生物利用度显著提高。这主要是因为波棱甲素纳米化后,粒径显著降低,增加波棱甲素的溶出及与胃肠道的黏附性,促进了波棱甲素的吸收,进而提高了波棱甲素的口服生物利用度。此外,显著延长的MRT0~t也有利于生物利用度的增加。Her-NS200的AUC0~t和max高于Her-NS450,说明粒径小更有助于生物利用度的改善。两者差异不显著,这与文献报道的不一致[9,18],分析可能原因如下:Her-NS口服进入胃肠道,受复杂的胃肠道环境如不同的pH值,消化酶等的影响,导致Her-NS在胃肠道有轻微聚集,降低了粒径差异,导致吸收差异不显著。
利益冲突 所有作者均声明不存在利益冲突
[1] 中华人民共和国卫生部药品标准•藏药 (第1册) [S]. 1995: 64.
[2] 杭凌宇, 申宝德, 沈成英, 等. 藏药波棱瓜子抗肝病现代研究进展 [J]. 中草药, 2020, 51(2): 549-556.
[3] 刘美琳, 张梅. 藏药波棱瓜子的现代研究进展 [J]. 中药与临床, 2016, 7(2): 99-102,105.
[4] Kaouadji M, Favre B J. Herpetrione, trimeric lignoid isolated from[J]., 1983, 24(52): 5881-5884.
[5] Guo J J, Yue P F, Lv J L,. Development and/evaluation of novel herpetrione nanosuspension [J]., 2013, 441(1/2): 227-233.
[6] Pawar S S, Dahifale B R, Nagargoje S P,. Nanosuspension technologies for delivery of drugs [J].2017, 4(2): 59-66.
[7] 罗开沛, 李小芳, 罗佳, 等. 纳米混悬技术在中药制剂中的应用及发展趋势 [J]. 中草药, 2016, 47(6): 865-871.
[8] Md S, Kit B, Jagdish S,. Development andevaluation of a zerumbone loaded nanosuspension drug delivery system [J]., 2018, 8(7): 286.
[9] Wang X H, Liu Y, Shen C Y,. Effect of particle size onandbehavior of astilbin nanosuspensions [J]., 2019, 52: 778-783.
[10] Shen C, Yang Y, Shen B,. Self-discriminating fluorescent hybrid nanocrystals: Efficient and accurate tracking of translocation via oral delivery [J]., 2017, 10(1): 436-450.
[11] Xia F, Fan W F, Jiang S F,. Size-dependent translocation of nanoemulsions via oral delivery [J]., 2017, 9(26): 21660-21672.
[12] Ahmadi Tehrani A, Omranpoor M M, Vatanara A,. Formation of nanosuspensions in bottom-up approach: Theories and optimization [J]., 2019, 27(1): 451-473.
[13] Shen B D, Wu N, Shen C Y,. Hyperoside nanocrystals for HBV treatment: Process optimization,andevaluation [J]., 2016, 42(11): 1772-1781.
[14] 程佳慧, 刘喜纲, 常金花, 等. 不同稳定剂种类对齐墩果酸纳米混悬剂溶出度的影响 [J]. 中国医院药学杂志. DOI:42. 1204. R. 20201016. 1446. 008.
[15] Tuomela A, Hirvonen J, Peltonen L. Stabilizing agents for drug nanocrystals: Effect on bioavailability [J]., 2016, 8(2): E16.
[16] Xie Y K, Shi B K, Xia F,. Epithelia transmembrane transport of orally administered ultrafine drug particles evidenced by environment sensitive fluorophores in cellular and animal studies [J]., 2018, 270: 65-75.
[17] Du J, Li X G, Zhao H X,. Nanosuspensions of poorly water-soluble drugs prepared by bottom-up technologies [J]., 2015, 495(2): 738-749.
[18] Bi C, Miao X Q, Chow S F,. Particle size effect of curcumin nanosuspensions on cytotoxicity, cellular internalization,pharmacokinetics and biodistribution [J]., 2017, 13(3): 943-953.
Preparation andpharmacokinetic behaviors of herpetrione nanosuspensions
HANG Ling-yu1, 2, SHEN Bao-de2, SHEN Cheng-ying2, YANG Kuo1, YUAN Hai-long2
1. College of Pharmacy, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China 2. Department of Pharmacy, Air Force Medical Center, Beijing 100042, China
To prepare herpetrione nanosuspension (Her-NS) with different particle sizes, and explore the effects of particle size on the oral bioavailability.Her-NS with two different particle sizes were prepared by anti-solvent precipitation method, and optimized by single factor experiments with average particle size, polydispersity index, and stability index as evaluation indexes. The morphology of Her-NS was observed by scanning electron microscope (SEM), and the physical state was analyzed by X-ray diffraction (XRD). The drug release of Her-NS was evaluated by dialysis method. The oral pharmacokinetics of Her-NS with two different particle sizes were compared using SD rats.Her-NS with two different particle sizes around 200 nm (Her-NS200) and 450 nm (Her-NS450) were successfully prepared with P188 and P407 as stabilizers. SEM showed that Her-NS with two different particle sizes were all spherical in shape, and the XRD analysis showed that Her-NS with two different particle sizes were amorphous.release and pharmacokinetic results showed that the cumulative release and themaxand AUC0—tof Her-NS with two different particle sizes were significantly increased as compared to coarse Her, but themaxand AUC0—tof the Her-NS200were higher than those of Her-NS450.NS can significantly improve the oral bioavailability of Her, and the small particle size is more significant.
herpetrione; anti-solvent precipitation method; nanosuspension; particle size;release; pharmacokinetics; oral bioavailability
R283.6
A
0253 - 2670(2021)07 - 1898 - 08
10.7501/j.issn.0253-2670.2021.07.006
2020-11-23
国家自然科学基金资助项目(81573697);国家自然科学基金资助项目(81873092);国家重大新药创制(2016ZX09101073)
杭凌宇,博士研究生,研究方向为中药制剂工程技术研究。E-mail: 445914871@qq.com
袁海龙,博士,研究员,博士生导师,研究方向为中药新型给药系统。Tel: (010)66928505 E-mail: yhlpharm@126.com
[责任编辑 郑礼胜]

