矿物药青礞石对戊四唑点燃癫痫大鼠肠道菌群的影响
袁 鹏,马瑜璐,刘圣金*,房 方,杨文国,卞 勇,徐晨昱,张志杰,奥•乌力吉,段金廒*
矿物药青礞石对戊四唑点燃癫痫大鼠肠道菌群的影响
袁 鹏1,马瑜璐1,刘圣金1*,房 方1,杨文国1,卞 勇1,徐晨昱1,张志杰2,奥•乌力吉3,段金廒1*
1. 南京中医药大学药学院/江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心/国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023 2. 中国中医科学院中药研究所,北京 100700 3. 内蒙古民族大学,内蒙古 通辽 028000
研究青礞石对戊四唑(pentylenetetrazol,PTZ)点燃癫痫大鼠肠道菌群的影响,从肠道微生态环境视角探讨青礞石治疗癫痫疾病可能的作用机制。以青礞石粉末为研究对象,用PTZ点燃法建立大鼠癫痫动物模型,实验分为对照组、模型组、卡马西平组和青礞石组(高剂量组为临床用量的20倍、低剂量组为临床用量的5倍)。给药4周后,取各组大鼠结肠内容物,通过16S rRNA测序对各组大鼠肠道菌群的多样性进行分析,利用UPARSE、SPSS 18.0等对结果进行生物信息学及统计学分析。α多样性分析可知,模型组大鼠肠道菌群的Chao 1、Ace丰富度指数与对照组相比没有显著性变化;与对照组、模型组相比,青礞石组尤其是高剂量组对细菌群落丰富度有显著影响(<0.05)。Shannon、Simpson群落多样性指数分析结果显示,模型组与对照组无显著性差异;青礞石组对群落多样性干预不明显。青礞石主要干预肠道菌群的丰富度、卡马西平主要干预肠道菌群的多样性。β多样性各组层级聚类均能较好地分开,其中青礞石高剂量组与低剂量组部分样本不能明显分开,2组样本可归为一类,对照组、模型组可归为一类,卡马西平组单独归为一类。3D-主成分分析(3D-principal component analysis,3D-PCA)、3D-主坐标分析(3D-principal co-ordinates analysis,3D-PCoA)结果显示,各组菌群结构轮廓均能明显分开,青礞石低剂量组介于对照组和模型组之间,菌群结构轮廓部分与模型组、对照组有重合交叉,且有偏向对照组的明显趋势。非度量多维尺度(nonmetric multidimensional scaling,NMDS)分析结果显示,对照组、模型组、青礞石组集中在一个区域,青礞石组与模型组、对照组有重合交叉,青礞石高剂量组、低剂量组对肠道菌群结构有相似的干预效果。物种组成门水平分析可知,各组大鼠的优势菌群主要有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),其中厚壁菌门占比最大,其次是拟杆菌门。模型组疣微菌门相对丰度较对照组显著增加(<0.01),模型组变形菌门的相对丰度最高;青礞石干预后疣微菌门相对丰度下降,变形菌门相对丰度有不同程度降低。属水平分析可知,与对照组相比,模型组中norank_f__Muribaculaceae(<0.05)、菌属(<0.01)相对丰度显著增加,乳杆菌属显著减少(<0.05);青礞石干预后可降低菌属、升高乳杆菌属的相对丰度。另外,线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析可知厚壁菌门的瘤胃球菌科(Ruminococcaceae)在模型组中显著富集,给予青礞石干预后,瘤胃球菌科相对丰度显著降低。青礞石对PZT点燃癫痫大鼠肠道菌群物种组成的丰富度、多样性具有明显的调节作用,可有效干预肠道微生态的重建。
矿物药;青礞石;癫痫;戊四氮;结肠;肠道菌群;脑-肠轴;作用机制
青礞石始载于宋《嘉祐补注神农本草经》(简称《嘉祐本草》),属镁类矿物药,系变质岩类黑云母片岩(biotite schist)或绿泥石化云母碳酸盐片岩(mica carbonate by chloritization)。其性平,味甘、咸,归肺、心、肝经;具坠痰下气、平肝镇惊之功效,用于顽痰胶结、咳逆喘急、癫痫发狂、烦躁胸闷、惊风抽搐[1-3]。
癫痫(epilepsy)是最常见的神经系统疾病之一,是一种反复性、持久性、具有致痫倾向特征的慢性脑部疾病,会带来严重的神经、认知、心理和社会后果,影响着全世界各年龄段5000万人的生活,其发生与大脑中异常过度或同步的神经活动有关[4-5]。癫痫的病因复杂,包括后天结构损伤、遗传、感染、代谢、免疫和未知等因素[6]。越来越多的研究表明,肠道菌群可能在癫痫中发挥着潜在作用,肠道菌群作为人体肠道的重要组成部分,参与宿主营养代谢、维持肠道黏膜屏障结构完整性、免疫调节等生理活动[7]。人体内存在的脑-肠轴(brain-gut axis)是大脑与胃肠道之间的关键通路,肠道菌群和大脑可以通过中枢和肠道神经系统以及内分泌、免疫和代谢途径实现双向沟通[8-9]。大脑通过迷走神经、免疫系统、神经内分泌系统调节肠道菌群,肠道菌群产生神经递质和调质影响肠神经系统,从而调节中枢神经系统[10-11]。肠道菌群通常与脑-肠轴间保持着稳态关系,如肠道菌群的失调会引起多种神经紊乱,导致中枢神经系统疾病,癫痫与脑-肠轴的稳态失衡密切相关[12]。
在前期研究的基础上[13-14],青礞石对癫痫临床疗效可靠,本研究采用16S rDNA高通量测序技术对大鼠肠道菌群的多样性进行分析,研究青礞石对PTZ点燃癫痫大鼠肠道微生物的影响,探讨青礞石治疗癫痫疾病可能的作用机制。
1 材料
1.1 动物
清洁级雄性SD大鼠购于浙江省医学科学院,合格证号:SCXK(浙)2019-0002,共40只,体质量180~220 g。大鼠购入后适宜条件下适应性喂养1周,自由饮食饮水,动物饲养于屏障环境中,12 h昼夜交替,室温20~24 ℃,相对湿度50%左右。动物实验通过南京中医药大学实验动物伦理委员会的批准,批准文号为201910A029
1.2 药材与试剂
青礞石药材由亳州矿石专营店提供(批号20140412),经南京中医药大学中药鉴定学教研室吴德康教授鉴定为青礞石,经南京大学地球科学与工程学院孔庆友教授鉴定为变质岩类黑云母片岩,样品留存于南京中医药大学中药鉴定学教研室。卡马西平片(批号X1395,北京诺华制药有限公司);戊四唑(pentylenetetrazol,PTZ)(批号1002905179,美国Sigma公司);E.Z.N.A.®soil DNA试剂盒(Omega Bio-tek,美国);AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,美国);聚乙二醇400(PEG 400,化学纯,上海凌峰化学试剂有限公司)。
1.3 主要仪器
ABI GeneAmp®9700型基因扩增仪(ABI,美国);NanoDrop2000超微量分光光度计(Thermo Fisher Scientific,美国);DYY-6C电泳仪(北京市六一仪器厂)。
2 方法
2.1 动物模型的建立
采用PTZ点燃法制备癫痫大鼠模型[13-15],用生理盐水将PTZ配成质量浓度为0.01 g/mL的溶液,每天固定时间ip给予大鼠35 mg/kg PTZ进行造模。持续给药4周后,停1周,再以同剂量PTZ进行测试,参照Racine分级标准[16-17],包括有无惊厥、面部阵挛、节律性点头、前肢阵挛及跌倒等特征,以大鼠连续表现5次II级或II级以上惊厥反应为达到点燃标准。I级标准:面部阵挛;II级标准:面部阵挛并伴节律性点头;III级标准:面部阵挛、伴节律性点头及前肢阵挛;IV级标准:面部阵挛、伴节律性点头、前肢阵挛及后肢站立;V级标准:面部阵挛、伴节律性点头、前肢阵挛、后肢站立并跌倒。大鼠若出现Ⅴ级无明显间歇的癫痫持续状态发作,给予7%水合氯醛1 mL缓解发作。实验期间,观察并记录大鼠的体质量变化、精神状态、癫痫发作情况。
2.2 给药样品的制备
卡马西平片溶于生理盐水,配成质量浓度为0.02 g/mL的卡马西平溶液。青礞石药材去除石英等杂质,置玛瑙研钵中研磨成细粉,过药典6号筛,用PEG 400为介质配成0.5 g/mL青礞石混悬液,每次给药前超声混匀。
2.3 分组、给药与采样
实验动物共分为5组,给予生理盐水的大鼠(8只)作为对照组;造模成功的大鼠随机均分为4组,即模型组,卡马西平阳性对照组,青礞石高、低剂量组。对照组和模型组ig给予5 mL/kg生理盐水;卡马西平组按5 mL/kg剂量ig给药;青礞石高、低剂量组按青礞石临床用量的20倍、5倍(临床等效剂量)设计给药高、低剂量,高剂量组按4 mL/kg剂量ig给药,低剂量组按1 mL/kg剂量ig给药。每天固定时间给药1次,持续给药4周。每周称体质量2次,并根据体质量变化调整剂量。最后1次给药后次日,异氟烷吸入麻醉后处死各组大鼠取结肠内容物,置于−80 ℃冰箱中待测。
2.4 小肠内容物DNA提取和高通量测序
依据E.Z.N.A.®soil DNA试剂盒说明书进行细菌总DNA提取,DNA浓度和纯度利用NanoDrop 2000超微量分光光度计进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量。使用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)扩增细菌16S rRNA的V3-V4可变区。PCR产物利用2%琼脂糖凝胶进行回收,利用AxyPrep DNA Gel Extraction Kit进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST检测定量,Illumina Miseq平台进行测序。本研究的测序由上海美吉生物医药科技有限公司完成。
2.5 生物信息学和统计分析
运用UPARSE软件,根据97%的相似度对序列进行OTU(operational taxonomic units)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。利用OTU聚类产生的稀释曲线对取样深度情况进行分析,并进行α多样性(α diversity)分析,包括衡量物种丰富度的指数(chao1、Ace)和衡量样本多样性的指数(Shannon、Simpson)等,比较各组样品间丰度和多样性。菌群结构分析,对各组生物样本肠道菌群进行β多样性(β diversity)样本层级聚类分析(hierarchical clustering tree)、主成分分分析(principal component analysis,PCA)、主坐标分析(principal co-ordinates analysis,PCoA)、非度量多维尺度(nonmetric multidimensional scaling,NMDS)分析等。
2.6 统计分析
3 结果
3.1 大鼠一般情况及模型建立
各组大鼠体质量随时间增加,增速相似,无明显差异。造模大鼠1周左右毛色逐渐发黄,第2周开始出现Ⅱ级惊厥反应,造模第4周,大鼠出现Ⅱ级及以上惊厥反应;造模测试中,大鼠多出现连续5次Ⅱ级或Ⅱ级以上惊厥反应,达到PTZ点燃癫痫大鼠模型标准。32只大鼠用于PTZ模型制备,过程中死亡8只,造模成功率为75.0%。
3.2 OTU及稀释曲线分析
对各组大鼠肠道内容物样品中细菌16S rRNA(V3-V4区)进行PCR扩增和测序分析,共得到1 360 324条有效序列。物种OTU数目排序等级与丰度曲线显示,各组曲线平滑下降,表明各组大鼠内容物菌群物种丰富、多样性程度较高,物种均匀度较好,见图1-a。Pan物种分析显示随着样本数目的增加,各组总OTU数目增加趋势逐步减缓并趋于恒定(曲线上升趋于平缓),见图1-b;Core物种分析显示随着样本数目的增加,各组样本共有的OTU数目逐渐下降并趋于恒定(曲线下降趋于平缓),见图1-c。采用对序列进行随机抽样的方法,以抽到的序列数与其所能代表各分类学水平的数目构建稀释曲线,结果物种数目在2000以上时,Shannon稀释曲线趋向平坦,说明测序数据量合理,提供样本足够多,测序深度可靠,见图1-d。
3.3 肠道菌群α多样性分析
各组大鼠Chao 1、Ace细菌群落丰富度指数和Shannon、Simpson群落多样性指数,见图2。结果显示,模型组大鼠细菌群落的Chao 1、Ace丰富度指数与对照组相比没有显著性变化;与对照组、模型组相比,青礞石组尤其是高剂量组对群落丰富度有较大影响,卡马西平组对群落丰富度没有显著性影响。Shannon、Simpson群落多样性结果显示,模型组与对照组无显著性差异;与对照组、模型组相比,卡马西平组有显著性影响,青礞石组对群落多样性干预不明显。结果表明,用PTZ点燃法制备癫痫大鼠模型对其肠道菌群的丰富度、多样性没有显著性影响;青礞石主要干预肠道菌群丰富度、卡马西平主要干预肠道菌群的多样性。
3.4 肠道菌群结构β多样性分析
在OTU水平对大鼠肠道菌群进行层级聚类分析及3D-PCA、3D-PCoA、NMDS分析,见图3。层级聚类结果显示,对照组、模型组、卡马西平组及青礞石组样本基本能分开归类,对照组、模型组可归为一类,青礞石高、低剂量组可归为一类,卡马西平组单独归为一类,部分模型组样本与青礞石组归为一类。说明各组大鼠肠道菌群结构发生了一定程度的变化,且青礞石高、低剂量组对肠道菌群结构有相似的干预效果。
3D-PCA、3D-PCoA分析结果显示,对照组、模型组、卡马西平组、青礞石组菌群结构轮廓均能明显分开,除少数样本外,各组多数样本能较为集中分布,大鼠肠道菌群结构发生了明显的变化。青礞石低剂量组介于对照组和模型组之间,部分与模型组、对照组重合交叉,且有向对照组偏离的明显趋势。说明青礞石、卡马西平对大鼠肠道菌群结构均有明显的干预作用,青礞石低剂量组对肠道菌群结构的干预更趋近于对照组。卡马西平组、青礞石高剂量组对大鼠肠道菌群结构的影响差异性更大。NMDS分析结果显示,对照组、模型组、青礞石组集中在一个区域,青礞石低剂量组与高剂量组、模型组、对照组均有交叉重合,说明青礞石高、低剂量组对肠道菌群结构有相似的干预效果,且有利于PTZ癫痫大鼠肠道菌群的结构恢复与重建。以上结果与聚类分析结果相一致。

图1 OTU、稀释曲线分析
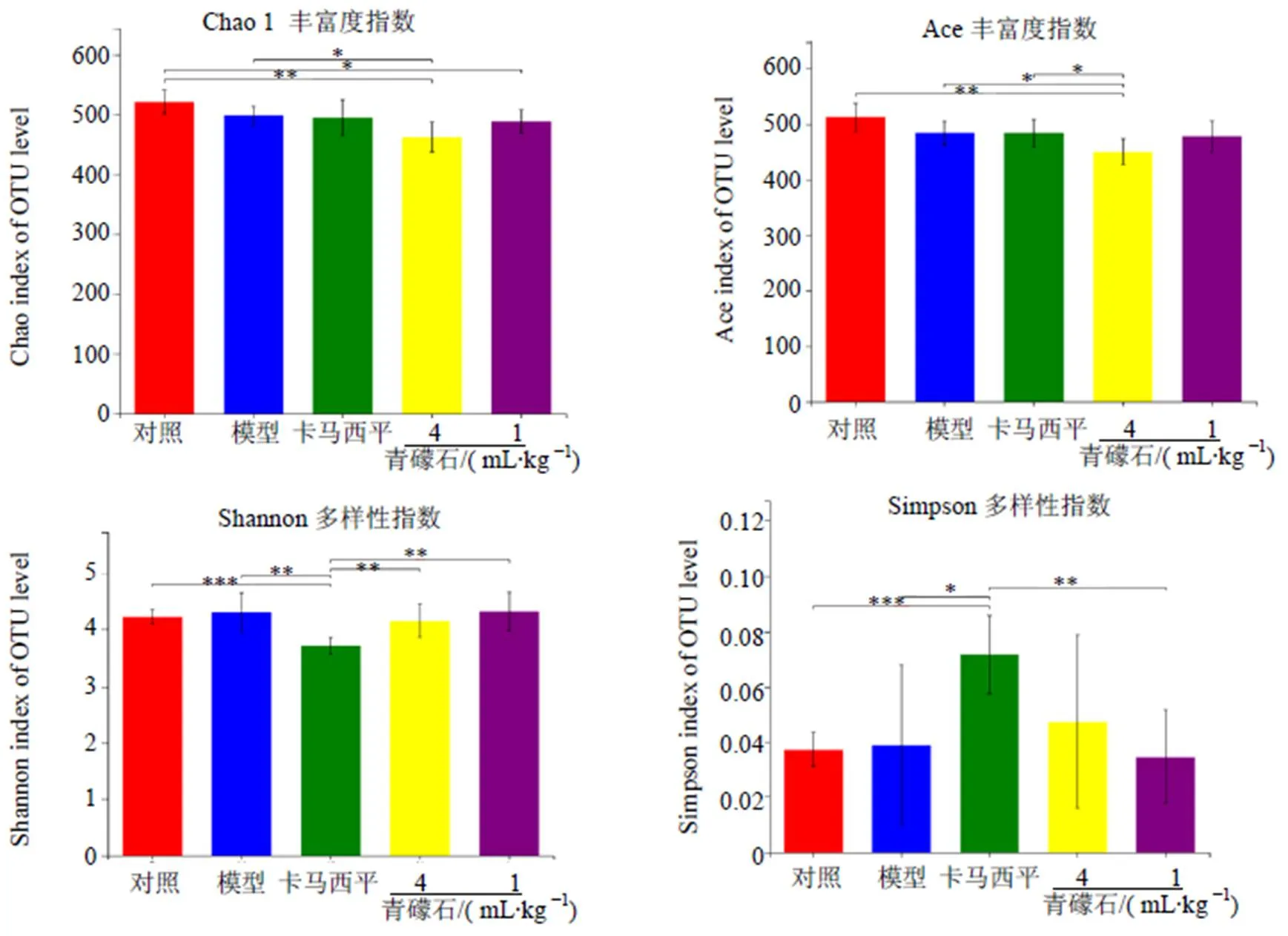
*P<0.05 **P<0.01 ***P<0.001

B-对照组 M-模型组 K-卡马西平组 H-青礞石4 mL·kg −1组 L-青礞石1 mL·kg −1组,图4、5同
3.5 肠道菌群物种组成分析
如图4所示,在门水平上,组间肠道菌群组成存在一定差异。各组大鼠的优势菌群主要集中于5个门:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),其中厚壁菌门在各组中占比最大,其次是拟杆菌门。模型组大鼠肠道内容物中检测到稀有菌群疣微菌门相对丰度较对照组显著增加(<0.01),青礞石、卡马西平干预后,疣微菌门相对丰度均显著减少(<0.05)。模型组大鼠中变形菌门的相对丰度最高,在对照组和青礞石、卡马西平组大鼠体内都有不同程度降低。青礞石组大鼠肠道内容物的拟杆菌门相对丰度高于对照组和模型组,厚壁菌门与拟杆菌门比值降低。各组间单物种及对照组与模型组比较Post-hoc图见图5。

*P<0.05 **P<0.01 ***P<0.001 a-各组菌群平均水平 b-组间多物种比较 c-各组物种Venn图 d-各组样本与物种关系Circos分析

*P<0.05 **P<0.01 ***P<0.001
如图6所示,在属水平上,各组大鼠中主要优势菌群有28种(图6-a),其中具有显著差异的菌群有7种(图6-b),分别是norank_f_Muribaculaceae、乳杆菌属、unclassified_f_ Lachnospiraceae、梭菌属_sensu_stricto_ 1、unclassified_f_Ruminococcaceae、拟杆菌属、菌属。与对照组大鼠相比,模型组大鼠中norank_f_Muribaculaceae、相对丰度显著增加,乳杆菌属显著减少(图7-a)。给予青礞石、卡马西平干预后,乳杆菌属相对丰度显著升高,Akkermansia菌属相对丰度降低。乳杆菌属的相对丰度各组存在显著差异(对照组25.14%,模型组10.00%,卡马西平组38.06%,青礞石高剂量组15.56%,青礞石低剂量组16.41%,<0.01)。青礞石对癫痫大鼠中乳杆菌属、Akkermansia菌属具有趋向对照组的调节作用(图7-b、c)。
3.6 LEfSe多级物种差异判别分析
采用线性判别效应大小LEfSe分析(linear discriminant analysis)方法,比较各组大鼠从门到属的菌群变化,分析青礞石与癫痫可能相关的特定菌,见图8。结果显示,各组大鼠肠道菌群差异显著,不同剂量青礞石干预后大鼠肠内的拟杆菌门相对丰度显著增加。疣微菌门及菌属在模型组大鼠肠道内中显著富集,疣微菌门和菌属在对照组大鼠肠道菌群组成中相对丰度非常低,癫痫造模后,这些稀有菌群相对丰度显著升高,给予不同剂量青礞石后相对丰度显著降低,接近对照组。厚壁菌门瘤胃球菌科(Ruminococcaceae)微生物在模型组大鼠肠内呈显著富集,青礞石给药后富集程度均降低。
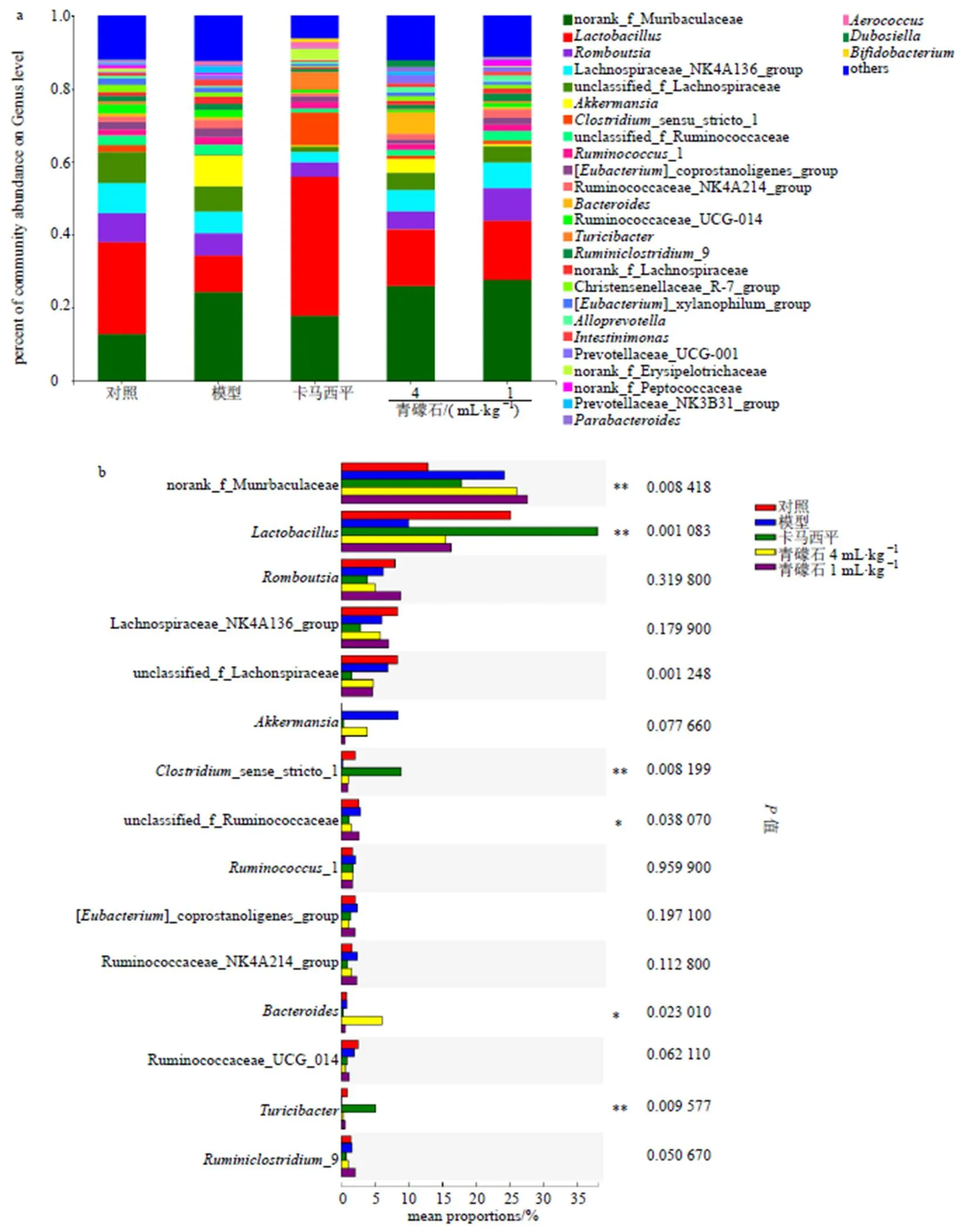
*P<0.05 **P<0.01 ***P<0.001 a-各组菌群平均水平 b-组间多物种比较

*P<0.05 **P<0.01 a-对照组与模型组比较Post-hoc图 b-乳杆菌属组间箱线比较 c-Akkermansia菌属组间箱线比较
4 讨论
4.1 青礞石对PTZ点燃癫痫大鼠肠道菌群的干预
青礞石对PTZ点燃癫痫大鼠肠道菌群的物种组成的丰富度、多样性具有明显的调节作用,可达到肠道微生态的重建。3D-PCA、3D-PCoA分析结果显示,各组大鼠肠道菌群结构发生了明显的变化,菌群结构轮廓明显分开,青礞石组对大鼠肠道菌群结构有明显的干预作用。模型组大鼠肠道内容物中检测的疣微菌门比例较对照组大鼠显著增加(<0.01),青礞石、卡马西平干预后,疣微菌门比例均显著减少(<0.05),与相关研究结果一致,疣微菌门与神经性疾病密切相关,可能是影响癫痫的发生、发展的重要菌门之一,疣微菌门对癫痫的发生、发展具有促进作用[18-19]。青礞石能显著降低癫痫大鼠变形菌门的相对丰度,变形菌门的异常高表达在癫痫大鼠体内可引起炎症反应,主要物种组成的厚壁菌门和拟杆菌门尚可通过产生短链脂肪酸对肠道免疫系统和神经系统产生积极的调节作用[20]。癫痫大鼠中乳杆菌属相对丰度显著降低,菌属显著增加,给予不同剂量的青礞石后,乳杆菌属的相对丰度显著上升,菌属显著降低。乳杆菌能够增加抑制性神经递质γ-氨基丁酸(γ-aminobutyric acid,GABA)的含量,控制神经元的异常放电,从而抑制癫痫的发作,乳杆菌被认为是一种益生菌,常被用来治疗癫痫[21-22]。Bagheri等[23]给予癫痫大鼠益生菌干预后发现GABA增加,癫痫的发展程度显著降低。菌属与神经疾病有关,对癫痫的发作、发展具有重要的影响[18-19]。在Lum等[24]研究中模型组大鼠中瘤胃球菌科相对丰度也显示出升高趋势,治疗组大鼠中瘤胃球菌科相对丰度有不同程度地降低。本研究LEfSe分析结果显示,瘤胃球菌科属于厚壁菌门,青礞石干预后能降低癫痫大鼠瘤胃球菌科相对丰度。瘤胃球菌科与谷氨酸、谷氨酰胺呈正相关[25],谷氨酸作为一种兴奋性神经递质,对癫痫的发生具有促进作用。癫痫的发作涉及神经元电活动的异常阵发性变化,并与兴奋性和抑制性神经递质的不平衡有关[26]。青礞石可能通过对癫痫大鼠免疫系统、神经系统产生了积极的调节作用,通过降低体内的炎症反应或调节兴奋性、抑制性神经递质的释放,最终达到干预癫痫的发作、发展过程。

a-LEfSe多级物种层级树图 b-LDA判别分析图
a-LEfSe multilevel species hierarchy tree diagram b-LDA discrimination
图8 差异物种判别分析
Fig. 8 Differential species discriminant analysis
4.2 矿物元素与肠道菌群密切相关
青礞石属于镁类矿物药,主要为含K、Mg、Fe、Al的硅酸盐 [K(Mg·Fe)2(A1Si3O10)(OH,F)2],主含Si、Fe、Mg、Al、Ca、K、Na,尚含Li、Ba、Ni、Zn、Ti、Sr、Se、Mo、Mn、Co、V、Sn等多种金属元素[27-29]。研究表明,矿物元素与肠道菌群存在复杂的协同拮抗作用,对肠道微生态的重建有重要的影响[30-32]。研究发现,Wilson病患者肠道内厚壁菌门丰度与粪便Cu浓度呈负相关,拟杆菌门丰度与粪便中Cu浓度呈正相关[30]。梭菌属、拟杆菌属、属、嗜胆菌属、产碱杆菌属、属、博代氏杆菌属和属等肠道微生物具有一定的砷抗性,Fe可改变结肠肠道微生物结构从而影响砷的甲基化和毒性[31]。给予仔猪含过量Fe的饲料,通过检测其肠道菌群含量的变化,发现由于存在大量Fe2+仔猪肠道通透性增加,炎症加剧,增强了细菌的易感性[32]。
4.3 癫痫与“脑-肠轴”
癫痫的发作常伴有胃肠道功能异常,如恶心、呕吐、腹泻等,癫痫患者脑电图中的点纤薄与肠道蠕动波具有相关性[33-34],这些均说明癫痫的发作、发展与胃肠道系统密切相关。肠道菌群不仅通过神经系统,而且通过内分泌系统、免疫系统和代谢系统对大脑产生影响,这种肠道和大脑之间的双向通信称之为“脑-肠轴”[8]。“脑-肠轴”是通过中枢神经系统(central nervous system,CNS)和多种肠神经系统(enteric nervous system,ENS)将大脑和肠道功能联系起来的双向应答系统。例如,肠道微生物可产生神经递质,通过迷走神经影响中枢神经系统;肠道微生物可作用于免疫系统,使血液中促炎细胞因子和抗炎细胞因子水平发生改变,影响中枢神经系统,改变脑功能;肠道微生物通过调节肠道内细胞激素的分泌,如脑肠肽、瘦素等物质直接作用于脑,实现脑和肠之间的信息交流[35-36]。有研究对PTZ点燃癫痫大鼠给予益生菌处理,与模型组相比,益生菌处理后的大鼠癫痫发作程度显著下降,水迷宫结果更优且具有显著性,脑组织中GABA浓度显著提升[22]。黄晓利等[37]研究癫痫儿童肠道微生物、Th17细胞水平和血清中白细胞介素-6(interleukin,IL-6)、IL-17A等含量的变化,结果显示模型组较对照组在属水平上菌群呈显著差异,模型组双歧杆菌、拟杆菌、放线菌比例显著低于对照组,厚壁菌、变形菌比例及阪崎肠杆菌比例显著高于对照组(<0.05),其中阪崎肠杆菌感染可导致发育缓慢及癫痫、脑膜炎等发生,可能是引发癫痫的原因之一。与炎症反应有关的Th17细胞、IL-6及IL-17A水平在模型组中显著升高,而双歧杆菌数量显著降低,研究表明双歧杆菌可降低Th17细胞表达和IL-17A的分泌,双歧杆菌的减少可促进癫痫的发展。
大量研究证实,人体内存在的“脑-肠轴”是大脑和胃肠道之间关键调控通路,而肠道菌群为该通路的重要参与者,肠道菌群可通过“脑-肠轴”的3条途径(免疫、神经内分泌和迷走神经)对大脑发挥作用,影响大脑发育、功能和行为。肠道微生物群的变化可影响外周和中枢神经系统,导致脑功能改变,从而参与了中枢神经系统疾病的发病机制[38-39]。青礞石中矿物元素通过对肠道菌群的影响,干预“脑-肠轴”这一关键调控通路,对大脑发挥作用。肠道微生物群对外周和中枢神经系统的影响,导致脑功能改变,参与癫痫疾病的发病机制。影响“脑-肠轴”双向通信途径产生的神经递质、相关炎症因子及Na+、K+、Ca2+等离子通道变化减缓神经细胞去极化反应及爆发性放电可能为青礞石治疗癫痫、发挥效应的关键因素。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 207.
[2] 江苏新医学院. 中药大辞典 (上册) [M]. 上海: 上海人民出版社, 1977: 1742-1743.
[3] 国家中医药管理局中华本草编委会. 中华本草 [M]. 上海: 上海科学技术出版社, 1998: 293-295.
[4] Fisher R S, Acevedo C, Arzimanoglou A,. ILAE official report: A practical clinical definition of epilepsy [J]., 2014, 55(4): 475-482.
[5] Dahlin M, Prast-Nielsen S. The gut microbiome and epilepsy [J]., 2019, 44: 741-746.
[6] WHO. Epilepsy: A public health imperative [R]. Geneva: World Health Organization, 2019.
[7] Thursby E, Juge N. Introduction to the human gut microbiota [J]., 2017, 474(11): 1823-1836.
[8] Bienenstock J, Collins S. 99th Dahlem conference on infection, inflammation and chronic inflammatory disorders: Psycho-neuroimmunology and the intestinal microbiota: Clinical observations and basic mechanisms [J]., 2010, 160(1): 85-91.
[9] Grenham S, Clarke G, Cryan J F,. Brain-gut-microbe communication in health and disease [J]., 2011, 2: 94.
[10] Cryan J F, Dinan T G. Mind-altering microorganisms: The impact of the gut microbiota on brain and behaviour [J]., 2012, 13(10): 701-712.
[11] Rea K, Dinan T G, Cryan J F. The microbiome: A key regulator of stress and neuroinflammation [J]., 2016, 4: 23-33.
[12] Mulle J G, Sharp W G, Cubells J F. The gut microbiome: A new frontier in autism research [J]., 2013, 15(2): 337.
[13] 刘圣金, 吴露婷, 吴德康, 等. 矿物药青礞石对PTZ点燃癫痫大鼠脑组织中氨基酸神经递质含量的影响 [J]. 质谱学报, 2016, 37(6): 533-541.
[14] 吴露婷, 刘圣金, 吴德康, 等. 矿物药青礞石对戊四氮点燃癫痫大鼠干预作用研究 [J]. 中药材, 2016, 39(1): 155-159.
[15] 王丽, Ono J, Walson P D. 大鼠戊四唑点燃模型的建立 [J]. 药学学报, 1993, 28(7): 486-489.
[16] Sahu S, Dutta G, Mandal N,. Anticonvulsant effect ofLinn. on pentylenetetrazole induced seizure: A behavioral and EEG study in rats [J]., 2012, 141(1): 537-541.
[17] Racine R J. Modification of seizure activity by electrical simulation. II. Moter seizure [J]., 1972, 32(3):281-294.
[18] Peng A, Qiu X, Lai W,. Altered composition of the gut microbiome in patients with drug-resistant epilepsy [J]., 2018, 147: 102-107.
[19] Gerhardt S, Mohajeri M H. Changes of colonic bacterial composition in Parkinson’s disease and other neurodegenerative diseases [J]., 2018, 10(6): E708.
[20] Şafak B, Altunan B, Topçu B,. The gut microbiome in epilepsy [J]., 2020, 139: 103853.
[21] Olson C A, Vuong H E, Yano J M,. The gut microbiota mediates the anti-seizure effects of the ketogenic diet [J]., 2018, 174(2): 497.
[22] Gómez-Eguílaz M, Ramón-Trapero J L, Pérez-Martínez L,. The beneficial effect of probiotics as a supplementary treatment in drug-resistant epilepsy: A pilot study [J]., 2018, 9(6): 875-881.
[23] Bagheri S, Heydari A, Alinaghipour A,. Effect of probiotic supplementation on seizure activity and cognitive performance in PTZ-induced chemical kindling [J]., 2019, 95: 43-50.
[24] Lum G R, Olson C A, Hsiao E Y. Emerging roles for the intestinal microbiome in epilepsy [J]., 2020, 135: 104576.
[25] Sun Y, Su Y, Zhu W Y. Microbiome-metabolome responses in the cecum and colon of pig to a high resistant starch diet [J]., 2016, 7: 779.
[26] Parashar A, Udayabanu M. Gut microbiota regulates key modulators of social behavior [J]., 2016, 26(1): 78-91.
[27] 赵明. 矿物学导论 [M]. 北京: 地质出版社, 2010: 202-205.
[28] 刘圣金, 吴德康, 林瑞超, 等. 矿物药青礞石无机元素的ICP-MS分析 [J]. 药物分析杂志, 2010, 30(11): 2067-2074.
[29] 刘圣金, 吴德康, 林瑞超, 等. 矿物药青礞石、煅青礞石无机元素的ICP-MS分析 [J]. 中国药房, 2011, 22(19): 1777-1780.
[30] 舒山. Wilson病患者肠道微生物多样性及其与临床相关性分析 [D]. 合肥: 安徽中医药大学, 2016.
[31] 於海燕. 铁对砷代谢及毒性效应影响的体外胃肠模拟研究 [D]. 南京: 南京大学.
[32] 陈群, 乐国伟, 施用晖, 等. 铁对患肠炎仔猪生长性能·消化率及肠道微生物的影响 [J]. 安徽农业科学, 2006, 34(16): 3982.
[33] Kshirsagar V Y, Nagarsenkar S, Ahmed M,. Abdominal epilepsy in chronic recurrent abdominal pain [J]., 2012, 7(3): 163-166.
[34] Nikiforova A S. Stress-induced gastrointestinal motility is responsible for epileptic susceptibility [J]., 2014, 82(4): 442-451.
[35] Stilling R M, Dinan T G, Cryan J F. Microbial genes, brain & behaviour-epigenetic regulation of the gut-brain axis [J]., 2014, 13(1): 69-86.
[36] 林璋, 祖先鹏, 谢海胜, 等. 肠道菌群与人体疾病发病机制的研究进展 [J]. 药学学报, 2016, 51(6): 843-852.
[37] 黄晓利, 曾定元, 龙易勤, 等. 癫痫儿童肠道菌群种类及Th17细胞水平的临床研究 [J]. 免疫学杂志, 2020, 36(1): 64-68.
[38] Bienenstock J, Kunze W, Forsythe P. Microbiota and the gut-brain axis [J]., 2015, 73(Suppl 1): 28-31.
[39] Zhu X, Han Y, Du J,. Microbiota-gut-brain axis and the central nervous system [J]., 2017, 8(32): 53829-53838.
Effects of mineral Chinese medicineon gut microbiota in PTZ- kindled epileptic rats
YUAN Peng1, MA Yu-lu1, LIU Sheng-jin1, FANG Fang1, YANG Wen-guo1, BIAN Yong1, XU Chen-yu1, ZHANG Zhi-jie2, AO·Wuliji3, DUAN Jin-ao1
1. State Administration of Traditional Chinese Medicine Key Laboratory of Chinese Medicinal Resources Recycling Utilization, National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China 3. Inner Mongolia University for Nationalities, Tongliao 028000, China
To study the effect ofon the gut microbiota in pentylenetetrazol (PTZ)-kindled epileptic rats, and explore the possible mechanism ofin the treatment of epilepsy from the perspective of intestinal micro-ecological environment.Takingpowder as the research object, the rat epilepsy animal models were established by the PTZ kindling method. The experiment was divided into blank group, model group, carbamazepine group, andgroup (the high-dose group was 20 times of the clinical drug, the low-dose group was five times). After 4 weeks of treatment, the colon contents of each group of rats were taken, and the diversity of the gut microbiota of each group of rats were analyzed by 16S rRNA sequencing, and the results were analyzed in bioinformatics and statistics using UPARSE, SPSS 18.0, etc.The α-diversity analysis showed that, compared with the blank group, the Chao 1 and Ace richness index of the gut microbiota flora in the model group had no significant change; Compared with the blank group and the model group, thegroup, especially the high-dose group, had a significant impact on the richness of gut microbiota flora (<0.05). The results of Shannon and Simpson index analysis showed that there was no significant difference between the model group and the blank group.mainly interfered with the richness of gut microbiota flora, and carbamazepine mainly interfered with the diversity of gut flora. The results showed that the hierarchical clustering of each group of β-diversity could be well separated. Some of the samples inhigh-dose group and low-dose group could not be separated obviously, and the two groups of samples could be classified into one group. The blank group and the model group could be classified into one group, and the carbamazepine group could be classified into one group. The results of 3D-PCA and 3D-PCoA analysis showed that the bacterial structure outline of each group could be obviously separated. The low-dosegroup was between the blank group and the model group, and the part of the outline of the bacterial structure diversity outline overlapped with the model group and the blank group, and tended to the blank group. The NMDS analysis results showed that the blank group, the model group and thegroup are located in one region, with thegroup overlapping with the model group and the blank group. The high-dose and low-dose ofs groups had similar intervention effects on the gut microbiota flora diversity. The composition analysis on phylum level showed that Firmicutes, Bacteroidetes, Verrucomicrobia, Proteobacteria, and Actinobacteria were the dominant bacteria in each group. Firmicutes accounted for the largest proportion, followed by Bacteroidetes. The richness ratio of Verrucomicrobia in the model group was significantly higher than that in the blank group (< 0.01), and the relative richness of Proteobacteria in the model group was the highest. Afterintervention, the richness of Verrucomicrobia decreased and the relative richness of Proteobacteria decreased in some degrees. Analysis on genus level showed that compared with the control group, the relative richness of norank_f_Muribaculaceae (< 0.05) and(< 0.01) in epileptic rats was significantly increased, andwas significantly reduced (< 0.05). The intervention ofcould reduce the relative richness ofand increase that of the. In addition, the linear discriminant analysis effect size (LEfSe) analysis showed that the Ruminococcaceae of Firmicutes was significantly enriched in the model group, and the relative richness of that was significantly reduced after the intervention of.has a significant regulatory effect on the richness and diversity structure and composition of the gut microbiota of PTZ-kindled epileptic rats, and can effectively interfere with intervene in the reconstruction of the intestinal micro-ecology.
mineral Chinese medicine;; epilepsy; pentylenetetrazol; colon; gut microbiota; brain-gut axis; mechanism of action
R285
A
0253 - 2670(2021)07 - 2011 - 13
10.7501/j.issn.0253-2670.2021.07.019
2020-09-13
国家自然科学基金项目(81673566);全国矿物药资源普查项目(2019);江苏省研究生科研与实践创新计划项目(KYCX18-1608);2017年中医药公共卫生服务补助专项“全国中药资源普查项目”(财社〔2017〕66号)
袁 鹏,硕士生,主要从事中药鉴定、品质评价及质量标准研究。Tel: (025)85811511 E-mail: xiaoxihu775@163.com
刘圣金,副教授,硕士生导师,主要从事中药鉴定、品质评价及质量标准研究。Tel: (025)85811511 E-mail: lsj@njucm.edu.cn
段金廒,教授,博士生导师,主要从事中药资源化学与资源循环利用研究。Tel: (025)85811116 E-mail: dja@njucm.edu.cn
[责任编辑 潘明佳]

