miR-145靶向KLF5抑制膀胱癌BIU-87细胞增殖、侵袭、迁移的机制研究
孔令伟,吕宪宝
膀胱癌(bladder cancer,BCa)又称膀胱尿路上皮癌,多发于男性,位居男性肿瘤发病率的第9位,死亡率的第8位[1-2]。临床上BCa复发率很高,膀胱癌细胞迁移侵袭肌层、膀胱周围组织或血管,严重影响BCa转移、复发和预后[3-4]。因此探究影响膀胱癌细胞增殖、侵袭和迁移的新靶点,对于临床上治疗BCa意义重大。人微小核糖核酸(microRNA,miRNA)可与mRNA结合,从而参与调控细胞增殖、分化、凋亡等进程[5]。miR-145具有抑癌作用,影响肿瘤侵袭和增殖,研究表明,miR-145在膀胱癌组织中下调,抑制膀胱癌细胞上皮间质转化,但是关于miR-145调控膀胱癌细胞增殖、侵袭和迁移的相关机制不明[6]。锌指蛋白转录因子5(zinc finger protein transcription factor 5,KLF5)广泛表达在人体不同组织中,高表达时有助于肿瘤增殖、侵袭和迁移,是恶性肿瘤发生发展的关键因子[7]。在BCa中,miR-145能否通过靶向调控KLF5,进而抑制膀胱癌细胞增殖、侵袭、迁移尚不清楚,因此本研究测定miR-145 mimic转染后BIU-87细胞miR-145、KLF5及相关蛋白表达水平,分析其对BIU-87细胞增殖、侵袭、迁移的影响,探究调控机制。
1 材料与方法
1.1 试剂和仪器
RMPI 1640培养液(货号:31800)、特级胎牛血清(货号:S9000)、总RNA提取试剂盒(货号:R1200)、RP1100通用RT-PCR试剂盒(货号:RP1100)均购自北京索莱宝科技有限公司;兔抗人KLF5(货号:FNab04600)、兔抗人PI3K(货号:FNab09857)、兔抗人PCNA(货号:FNab06215)、兔抗人MMP-9(货号:FNab05247)、兔抗人MMP-2(货号:FNab05238)、兔抗人E-cadherin(货号:FNab02617)、羊抗兔二抗(货号:FNSA-0015)均购自武汉菲恩生物科技有限公司;兔抗人AKT(货号:K10080-ZRF)、兔抗人p-AKT(货号:K10770-IZK)均购自北京百奥莱博科技有限公司;miR-145mimic、miR-145阴性对照序列购自上海生工生物公司;VeritiTMPCR仪购自美国赛默飞世尔科技公司;BMM-300型正置三目金相显微镜购自上海巴拓仪器有限公司;ZF-388型全自动凝胶成像分析系统购自上海嘉鹏科技有限公司。
1.2 细胞系和转染
正常膀胱组织细胞系(SV-HUC-1)和膀胱癌细胞系(BIU-87)均购自中科院上海细胞库。用含有10%胎牛血清的RMPI 1640培养液常规培养,隔天换液,在37 ℃、5%CO2,相对湿度98%的培养箱中培养至贴壁面积占培养皿的80%~90%,胰酶消化传代,取对数生长期细胞用于后续实验。将BIU-87细胞以1×105个/孔接种到24孔板上,待BIU-87细胞密度在50%融合状态时弃去培养液,更换成opti-RMPI 1640,根据LipofectamineTM2000转染试剂盒说明书操作,分别转染miR-144无规则序列、miR-145 mimics序列。实验分组:①对照组(转染时加入等量培养液后的BIU-87细胞);②miR-145阴性对照组(转染miR-144无规则序列后的BIU-87细胞);③miR-145 mimic组(转染miR-145 mimics序列后的BIU-87细胞);④SV-HUC-1细胞作为SV-HUC-1组。转染6 h后终止转染操作,更换成完全培养液继续常规培养BIU-87细胞,24 h后收集细胞,荧光显微镜下观察细胞转染效率。
1.3 RT-qPCR检测转染后BIU-87细胞miR-145表达水平
收集SV-HUC-1细胞和转染后BIU-87细胞,加入Trizol试剂以提取各组细胞中总RNA,按照说明构建PCR反应体系20 μl。PCR扩增条件:95 ℃预变性300 s,95 ℃变性30 s,65 ℃退火60 s,72 ℃延伸30 s,共进行40个循环,75 ℃终末延伸5 min。miR-145上游引物序列:5′-CGCGCTCGAGCCCAGAGCAATAAGCCACAT-3′,下游引物序列:5′-GGTGTCGTGGAGTCGGCAATTCAGTTGAG-3′;内参U6上游引物序列:5′-ATTGGAACGATACAGAGAAGATT-3′,下游引物序列:5′-GGAACGCTTCACGAATTTG-3′。设置6个复孔,采用2-ΔΔCT法对miR-145表达水平进行定量分析。
1.4 蛋白印迹法(Western blotting,WB)测定转染后BIU-87细胞KLF5、PI3K、AKT、p-AKT、PCNA、MMP-9、MMP-2、E-cadherin表达水平
加入100 μl含有苯甲基磺酰氟(PMSF)的细胞裂解液,充分裂解细胞,刮铲收集蛋白,使用BCA试剂盒测定总蛋白含量,10 μl缓冲液混合(按照每4 μl蛋白样品加入1 μl蛋白上样缓冲液(5×)的比例,混合均匀后100 ℃预处理10 min,50 μg/孔上样,凝胶电泳分离目标蛋白,80 V 30 min,120 V 90 min,电泳,湿法转膜,5%脱脂奶粉封闭后,以1∶1 000的稀释比例加入一抗,4 ℃下孵育过夜,PBS洗涤3次,以1∶1 000的稀释比例加入二抗,室温杂交1 h,PBS洗涤3次,ECL法显色,测定条带灰度值,蛋白相对含量=目标蛋白灰度值/内参蛋白灰度值。
1.5 MTT法测定转染后BIU-87细胞活性
按照分组设置6个复孔,用RMPI 1640培养液调整BIU-87细胞密度,以1×104个/孔种到96孔板上,常规培养48 h,之后加入25 μl MTT溶液(5 mg/ml),继续常规培养4 h,弃培养液,加入DMSO溶液150 μl,恒温振荡器震荡10 min(37 ℃,100 rpm),用多功能酶标仪测定各孔样品在490 nm处吸光度(OD值)。计算转染后的BIU-87细胞活性,BIU-87细胞活性(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.6 Transwell小室侵袭实验测定转染后BIU-87细胞侵袭能力
用RMPI 1640培养液稀释Matrigel基质胶(20 μg/μl),随后50 μl稀释后的Matrigel基质胶加入到Transwell板上室中,37 ℃放置3 h,之后在超净台上风干使其凝聚成人工基底膜。按照分组在设置的6个复孔上室加入转染后的BIU-87细胞(200 μl,5×105个/孔),下室加入600 μl RMPI 1640培养液。培养箱常规培养48 h,用镊子取出Transwell小室,用棉签擦拭基底膜细胞,双蒸水漂洗3次,甲醇固定15 min,结晶紫(0.1%)染色15 min,双蒸水漂洗3次,分别选取上、下、左右、中五个视野计数,结果取平均值。
1.7 划痕实验测定转染后BIU-87细胞体外迁移能力
按照分组设置6个复孔,用RMPI 1640培养液调整BIU-87细胞密度,以5×105个/孔接种到6孔板上,培养箱培养,待细胞密度平铺6孔板底部约80%时,用灭菌后的200 μl枪头垂直于孔板,轻划出细胞划痕,每孔划4~5条平行划痕,PBS清洗3次。加入无血清RMPI 1640培养液,培养箱培养48 h,培养结束后用甲醇固定15 min,光学显微镜观察并拍照,计算BIU-87细胞迁移能力,BIU-87细胞迁移能力(%)=(初始两侧距离-观察时两侧距离)/初始两侧距离×100%。
1.8 双荧光素酶实验检测miR-145与KLF5靶标关系
1.8.1 荧光素酶报告实验突变型载体的制备 生物学信息网站TargetScan分析KLF5序列3′端非编码区域(3′UTR)区域存在1个miR-145结合位点,根据荧光素酶报告基因质粒pMIR构建KLF5 3′UTR荧光素酶报告基因质粒。pMIR质粒克隆近野生型(KLF5-wt)和突变型(KLF5-mt)的3′UTR下游位点。
1.8.2 荧光素酶测试报告实验 用RMPI 1640培养液调整BIU-87细胞密度,以1×104个/孔种到96孔板,培养过夜后,用LipofectamineTM2000将miR-145阴性对照与KLF5-野生型(wt)、miR-145 mimic与KLF5-野生型(wt)或KLF5-突变型(mt)共转染,设置6个复孔,转染24 h后,100 μl/孔加入Dual-GLO® Substrate/Buffer,15 min后测定吸光度,之后100 μl/孔加入stop &glo®Substrate/Buffer,10 min后测定吸光度,荧光素酶的相对活性以前后荧光强度比值表示。
1.9 数据统计与分析

2 结果
2.1 转染效率
荧光场下可见miR-145阴性对照组和miR-145 mimics组BIU-87细胞呈明显绿色荧光,对照组无荧光,说明转染成功。经白场和荧光场对比观察,BIU-87细胞转染效率达到85%,可用于后续实验,见图1。
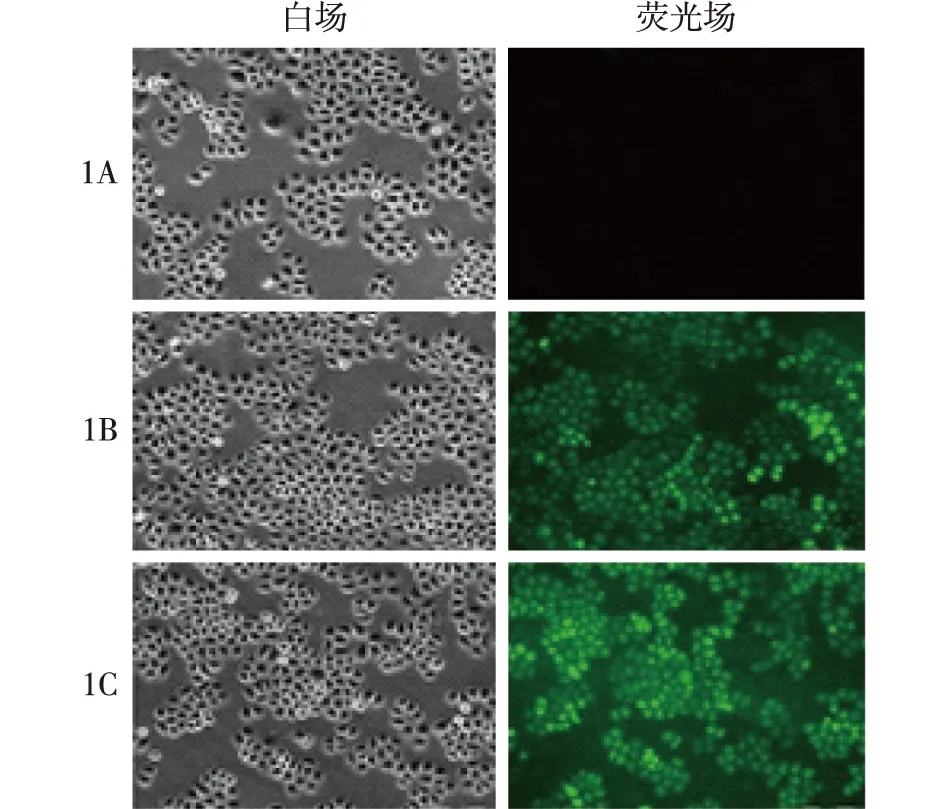
1A:对照组;1B:miR-145阴性对照组;1C:miR-145 mimics组图1 BIU-87细胞转染情况(×200)
2.2 不同细胞中miR-145、KLF5、PI3K、AKT、p-AKT表达水平
与SV-HUC-1细胞组相比,BIU-87细胞对照组miR-145表达水平明显降低(P<0.05),AKT表达水平无明显变化(P>0.05),KLF5、PI3K表达水平和p-AKT水平显著升高(P<0.05);与对照组、miR-145阴性对照组相比,miR-145 mimics组miR-145表达水平显著升高(P<0.05),AKT表达水平无明显变化(P>0.05),KLF5、PI3K表达水平和p-AKT水平明显降低(P<0.05),见图2和表1。
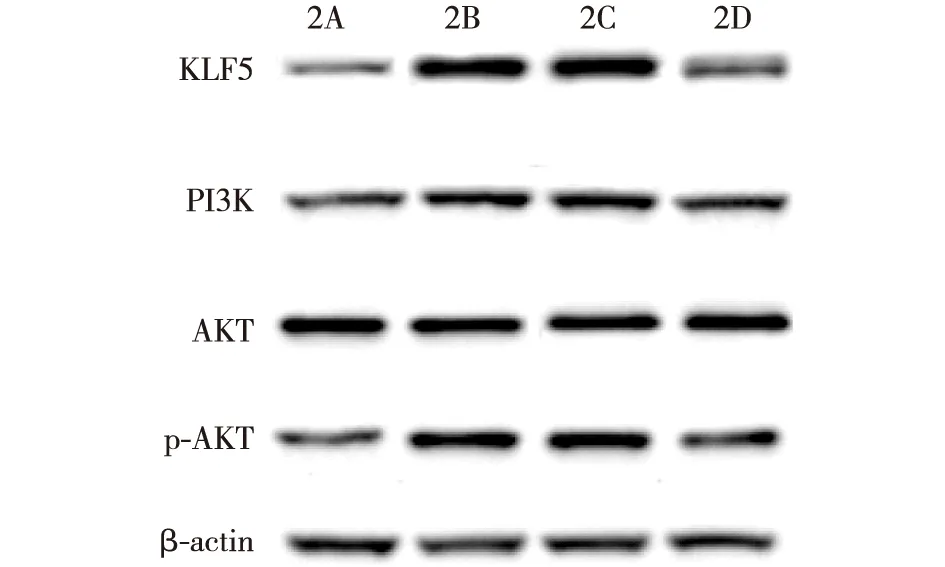
2A:SV-HUC-1细胞组;2B:对照组;2C:miR-145阴性对照组;2D:miR-145 mimics组图2 不同细胞中KLF5、PI3K、AKT、p-AKT表达水平
表1 不同细胞中miR-145、KLF5、PI3K、AKT、p-AKT表达水平
2.3 miR-145 mimic转染后BIU-87细胞活性
与对照组相比,miR-145mimics组细胞活性明显降低(P<0.05),miR-145阴性对照组BIU-87细胞活性无明显变化(P>0.05),见图3。

注:与对照组相比,*P<0.05;与miR-145阴性对照组相比,#P<0.05图3 miR-145 mimic转染后BIU-87细胞活性
2.4 miR-145 mimic转染后BIU-87细胞侵袭能力
与对照组相比,miR-145mimics组BIU-87细胞通过Matrigel到达滤膜底层的细胞数明显减少(P<0.05),miR-145阴性对照组细胞数无明显变化(P>0.05),见图4和图5。

4A:对照组;4B:miR-145阴性对照组;4C:miR-145 mimics组图4 miR-145 mimic转染后BIU-87细胞侵袭能力(×100)
2.5 miR-145 mimic转染后BIU-87细胞迁移能力
与对照组相比,miR-145 mimics组BIU-87细胞体外迁移能力明显降低(P<0.05),miR-145阴性对照组BIU-87细胞体外迁移能力无明显变化(P>0.05),见图6和图7。
2.6 miR-145 mimic转染后BIU-87细胞PCNA、MMP-9、MMP-2、E-cadherin表达水平
与对照组、miR-145阴性对照组相比,miR-145 mimics组PCNA、MMP-9、MMP-2表达水平明显降低(P<0.05),E-cadherin表达水平显著升高(P<0.05),见图8和表2。
表2 miR-145 mimic转染后BIU-87细胞PCNA、MMP-9、MMP-2、E-cadherin表达水平
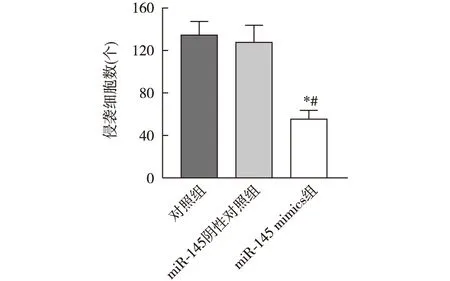
注:与对照组相比,*P<0.05;与miR-145阴性对照组相比,#P<0.05图5 miR-145 mimic转染后BIU-87细胞侵袭能力

6A:对照组;6B:miR-145阴性对照组;6C:miR-145 mimics组图6 miR-145 mimic转染后BIU-87细胞迁移能力(×100)
2.7 miR-145与KLF5靶标关系
Targetscan分析表明,miR-145序列3′UTR区存在1个KLF5结合位点。荧光素酶报告实验显示,与pMIR-KLF5-mt+miR-145阴性对照组比较,KLF5-wt+miR-145 mimic组的荧光素酶相对活性显著升高(P<0.05)而pMIR-KLF5-mt+miR-145 mimic组的荧光素酶相对活性差异无统计学意义(P>0.05),见图9和表3。

表3 BIU-87细胞荧光素酶的相对活性

注:与对照组相比,*P<0.05;与miR-145阴性对照组相比,#P<0.05图7 miR-145 mimic转染后BIU-87细胞迁移能力

8A:对照组;8B:miR-145阴性对照组;8C:miR-145 mimics组图8 miR-145 mimic转染后BIU-87细胞PCNA、MMP-9、MMP-2、E-cadherin表达水平
3 讨论
miR-145具有组织特异性、时序性、保守性的特点,作为抑癌基因参与调控肿瘤细胞增殖、分化[8]。本研究发现,与SV-HUC-1细胞组相比,BIU-87细胞对照组miR-145表达水平明显降低,提示在BIU-87细胞中miR-145低表达,其抑癌功能受到抑制。miR-145在大鼠脑动脉血管平滑肌(VSMC)细胞中低表达,上调miR-145表达水平,可靶向抑制MMP-9 表达水平,从而抑制VSMC细胞迁移、增殖[9]。膀胱癌T24细胞中miR-145低表达,上调miR-145表达水平后,能够抑制PLCε、N-cadherin、V-cadherin表达,促进E-cadherin表达,从而降低T24细胞迁移能力[6]。本研究发现,miR-145 mimics组miR-145表达水平较对照组、miR-145阴性对照组显著升高,说明miR-145 mimic转染成功,miR-145表达水平上调。与对照组、miR-145阴性对照组相比,miR-145 mimics组细胞活性、侵袭能力、迁移能力明显降低,说明上调miR-145表达水平能够抑制BIU-87细胞增殖、迁移、侵袭,但是miR-145调控何种信号通路参与此进程还有待研究。

9A:pMIR-KLF5-wt+miR-145阴性对照;9B:miR-145 mimic+KLF5-wt;9C:miR-145 mimic+KLF5-mt图9 miR-145 mimic与KLF5-wt或KLF5-mt共转染后BIU-87细胞图
KLF5能够参与肿瘤细胞增殖、侵袭和迁移进程[10]。KLF5直接与TNFAIP2基因启动子结合并激活其转录,可通过调控Rac1和Cdc42促进乳腺癌细胞的增殖,迁移和侵袭[11]。本研究发现,与SV-HUC-1细胞组相比,BIU-87细胞对照组KLF5表达水平显著升高,提示KLF5与膀胱癌有关,可能参与其发生发展进程。石东亮等[12]研究发现,KLF5是miR145潜在结合位点,上调miR145表达水平能够靶向下调KLF5表达水平,从而抑制K1细胞侵袭和增殖。本研究发现,与对照组、miR-145阴性对照组相比,KLF5表达水平明显降低,TargetScan数据库预测显示miR-145序列3′UTR区存在1个KLF5结合位点,双荧光素酶实验证实KLF5是miR-145作用靶点,说明上调miR-145表达水平可能靶向调控KLF5表达,从而抑制BIU-87细胞增殖、迁移和侵袭。
PI3K/AKT信号通路在肿瘤发生发展和肿瘤细胞增殖、凋亡进程中发挥重要作用[13]。夏迎晨等[14]研究发现,miR-145能够抑制PI3K/AKT和MAPK信号通路活性,从而降低肺癌A549细胞侵袭和转移能力。本研究发现,与SV-HUC-1细胞组相比,BIU-87细胞对照组PI3K表达水平和p-AKT水平显著升高,提示在BIU-87细胞中PI3K/AKT信号通路激活,促进细胞增殖、迁移和侵袭。与对照组、miR-145阴性对照组相比,miR-145 mimic组PI3K表达水平和p-AKT水平明显降低,说明上调miR-145水平能够抑制PI3K/AKT信号通路活性,降低细胞增殖、迁移和侵袭能力。PCNA能够反映细胞增殖活性,PCNA表达水平增加,说明细胞增殖活性强,沉默PCNA基因表达可上调Caspase-3、Bax表达,下调Bcl-2表达,从而抑制甲状腺癌细胞的增殖、促进凋亡[15]。MMP-9和MMP-2类属于锌依赖性蛋白水解酶,能够降解细胞外基底膜和基质,促进细胞侵袭和迁移[16]。E-cadherin是癌细胞侵袭和黏附能力的重要标记物,上调E-cadherin白表达表达水平,下调Vimentin和N-cadherin表达水平,能够缓解EMT诱导膀胱癌转移[17]。本研究发现,miR-145 mimics组PCNA、MMP-9、MMP-2表达水平较对照组、miR-145阴性对照组相比显著降低,E-cadherin表达水平显著升高,提示miR-145可靶向下调KLF5表达水平,阻断PI3K/AKT信号通路活性,下调PCNA、MMP-9、MMP-2表达水平,上调E-cadherin表达水平,从而抑制BIU-87细胞增殖、迁移和侵袭能力。
综上所述,在BIU-87细胞中,miR-145低表达,KLF5高表达,miR-145可靶向调控KLF5,可能通过阻断PI3K/AKT信号通路活性,抑制BIU-87细胞增殖、迁移和侵袭能力。但具体如何调控信号通路还有待进一步研究。

