原发性肝细胞肝癌微血管侵犯的术前预测及其模型的建立
姚岚清,陈钟
原发性肝癌是全球第四大最常见的恶性肿瘤,并且是第二大最常见的死亡原因[1]。我们中心位于南通,它是中国肝癌的高发地区,具有很高的代表性[2-3]。原发性肝癌的病理类型可分为三大类:肝细胞肝癌(hepatocellular carcinoma,HCC),肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)和肝细胞胆管癌混合型(HCC-ICC),HCC占肝癌的绝大多数,占85%~90%。目前,肝癌的治疗仍以手术切除为基础[4-5],但术后复发率仍然很高。已有研究表明微血管侵犯(microvascular invasion,MVI)是肝癌切除术后HCC患者复发的重要危险因素[6-11]。
我们通常依靠术后病理诊断MVI,也可以根据临床证据做出预测。肝癌患者MVI的术前预测可指导手术方式的选择[12],并可以与药物治疗相结合[13],从而减少肿瘤的复发和转移。先前的研究提出了许多MVI危险因素,例如年龄,甲胎蛋白(AFP),嗜中性粒细胞,谷氨酰胺肽酶,淋巴细胞,乙型肝炎,乙型肝炎病毒(HBV)DNA含量,门脉高压症,巴塞罗那肝病临床(BCLC)分期 ,肿瘤大小,数量,肿瘤影像学特征等[14-15],以及患者血清中的某些肿瘤标志物和DNA[16-18]。我们将所有这些可能的危险因素纳入我们的研究,将术前实验室检查指标和影像学指标结合起来分析。实验室指标包括:异常凝血酶原(PIVKA-Ⅱ),γ-谷氨酰转肽酶同工酶Ⅱ(GGT-Ⅱ),血小板计数(PLT),乙型肝炎,乙型肝炎病毒(HBV)DNA含量,甲胎蛋白(AFP),中性粒细胞计数(NE),淋巴细胞计数(LY),中性粒细胞计数/淋巴细胞计数比率(NLR),国际标准化比率(INR)。术前影像学指标包括:肝硬化,肿瘤数目,肿瘤直径,边缘状况,动脉期增强是否均匀,肿瘤周围增强以及是否与主血管相邻。为建立一个好的预测模型,我们收集了2012年10月至2020年8月间南通大学附属医院肝胆外科二病区行肝癌切除 术的162例HCC患者的临床数据,并进行了统计分析,以全面探讨HCC患者MVI的危险因素。
1 资料与方法
1.1 纳入及排除标准 纳入标准:①术前肝功能分级(child分级)A级或B级;②术前未行任何抗肿瘤治疗及降期治疗术者;③行肝癌切除术;④术后病理诊断为HCC患者。
排除标准:①复发型或混合型肝癌;②术前已有肝外转移者;③既往有恶性肿瘤病史者;④影像诊断已有血管癌栓者。
本研究经南通大学附属医院伦理委员会审批通过。
1.2 观察指标 我们应用EXCEL中的简单随机抽样方法抽选出162例病例,并将患者所有的资料录入到数据库中,影像资料是由我院两位工作时间超过10年的影像科医生在不知道患者资料的前提下分开读片,并由影像科主任审核得出结果。一般指标:年龄、性别、乙肝、Child-pugh分级。影像学指标:肝硬化、肿瘤数目、最大肿瘤直径、边缘是否光滑、动脉期强化是否均匀、瘤周强化、毗邻血管主干。实验室指标:术前异常凝血酶原(PIVKA-Ⅱ)、γ谷氨酰转肽酶同工酶Ⅱ(GGT-Ⅱ)、血小板计数(PLT)、乙肝病毒核酸定量(HBV-DNA)、甲胎蛋白(AFP)、中性粒细胞计数(NE)、淋巴细胞计数(LY)、中性粒细胞计数/淋巴细胞计数比值(NLR)、国际标准化比值(INR)。
1.3 MVI的诊断 本文入组病例根据《原发性肝癌诊疗规范》2019年版本所描述的“7 点”基线取材法,按1∶1分别在肿瘤3点、6点、9点、12点位置的癌与癌旁组织交界处取材;在肿瘤内至少取材1 处;距肿瘤边缘≤1 cm(近癌旁)和>1 cm(远癌旁)范围的瘤周组织分别取材1块。因为多结节性肝癌具有单中心和多中心两种起源方式,所以在不能排除肝内转移的情况下,应该对单个肿瘤直径≤3 cm的肝癌组织,全部取材分析。诊疗规范中MVI定义为:在电子显微镜下于内皮细胞衬覆的血管腔内发现癌细胞巢团,以癌旁门静脉分支为主(含包膜内血管)(图1)。本文入组病例的切片结果由2位工作时间超过10年的病理科医师在不知道患者资料的前提下分开审核。

1a:微血管癌栓阳性患者切片;1b:微血管侵犯阴性患者切片图1 肝细胞肝癌患者肿瘤病理切片(HE ×100)
1.4 统计学分析 采用SPSS 26.0软件,利用受试者工作特征曲线(receiver operating characteristic,ROC)取约登指数(敏感度+特异度-1)最大时为临界值,确定各指标预测MVI的最佳临界值。用χ2检验进行单因素分析,将差异有统计学意义的指标纳入多因素Logistic回归模型分析MVI的独立危险因素,P<0.05为差异有统计学意义。根据独立危险因素的风险系数(B)建立预测模型:P=1/1 +[e(B0-B1×X1-B2×X2-B3×X3-BN×XN)]。
2 结果
2.1 一般资料 162例患者,男139例,女23例;年龄≥59岁有75例,年龄<59岁有87例;肝功能Child分级A级144例,B级18例;乙型肝炎患者128例,无肝炎患者34例,病理结果提示MVI阳性患者60例,MVI阴性患者102例。
2.2 影像学资料 肝硬化患者96例,无肝硬化患者66例;肿瘤单发143例,多发19例;边缘光滑100例,不光滑62例;动脉期强化均匀76例,强化不均匀86例;瘤周强化58例,不强化104例;毗邻血管主干83例,不毗邻79例。HCC是患者影像特点见图2。
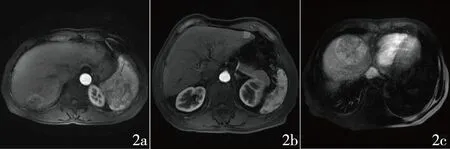
2a:肿瘤边缘光滑,边缘强化;2b:肿瘤动脉期强化均匀,边缘有凸起不光滑;2c:肿瘤边缘光滑,边缘强化,内部强化不均匀图2 肝细胞肝癌患者肿瘤影像特点
2.3 实验室资料 γ谷氨酰转肽酶同工酶Ⅱ(GGT-Ⅱ)阳性患者87例,阴性患者75例。采用ROC曲线分析PIVKA-Ⅱ、PLT、AFP、NE、LY、NLR、INR、肿瘤最大直径各个指标预测MVI的发生情况(图3),取约登指数对应的值作为临界值,结果如下:PIVKA-Ⅱ取516 mAU/ml,PLT取169.5×109/L,NE取值3.105×109/L,NLR取值1.896,AFP取值50.38 ng/ml,肿瘤最大直径取值5.65 cm。而LY和INR的P值>0.05,差异无统计学意义。各指标ROC曲线结果见表1。

图3 通过ROC曲线获取各个指标的约登指数

表1 各指标ROC曲线结果
2.4 HCC患者MVI的危险因素分析 单因素分析结果显示:HCC患者的PIVKA-Ⅱ≥516 ng/ml、GGT-Ⅱ阳性、PLT≥169.5×109/L、NE≥3.105×109/L、NLR≥2.32、AFP≥50.38 ng/ml、最大肿瘤直径≥5.65 cm、动脉期不均匀强化、瘤周强化是HCC患者发生MVI的危险因素(P<0.05)(表2)。

表2 HCC患者MVI影响因素的单因素分析
将单因素分析中影响HCC 患者发生MVI的临床指标纳入多因素Logistic回归模型中分析得出:PIVKA-Ⅱ≥516 mAU/ml、NE≥3.105×109/L、肿瘤最大直径≥5.65 cm,是HCC患者发生MVI的独立危险因素(P<0.05)(表3)。
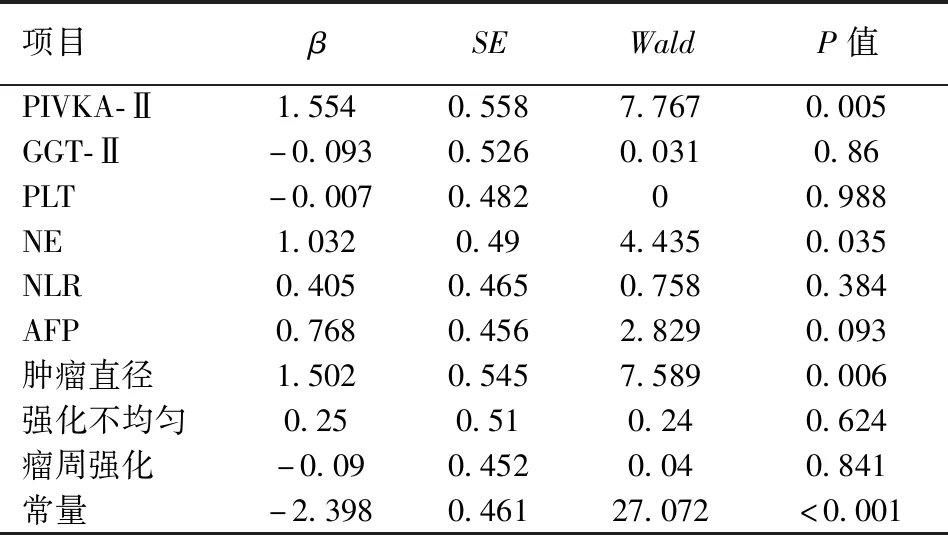
表3 HCC患者MVI影响因素的logistic多因素回归分析
2.5 预测模型的建立 根据Logistic 回归分析结果,我们将三个独立危险因素(PIVKA-Ⅱ≥516 mAU/ml赋值为1,PIVKA-Ⅱ<516 mAU/ml赋值为0;NE≥3.105×109/L赋值为1,NE<3.105×109/L赋值为0;肿瘤最大直径≥5.65 cm赋值为1,肿瘤最大直径<5.65 cm赋值为0)纳入我们创建的MVI的预测模型:P=1/1+[e(2.398-1.554×X1-1.032×X2-1.502×X3)](X1、X2、X3分别对应PIVKA-Ⅱ、NE、肿瘤最大直径的赋值),我们使用ROC曲线测试了模型的区分度(曲线下面积:0.862,95%CI:0.803-0.921)(图4),使用霍斯默莱梅肖(Hosmer-Lemeshow)拟合度检验检测模型的校准度(P=0.635)(图5),并用R语言绘制了列线图(图6)。我们认为P>0.5(列线图上的分数超过116分)具有很高的MVI发生概率。
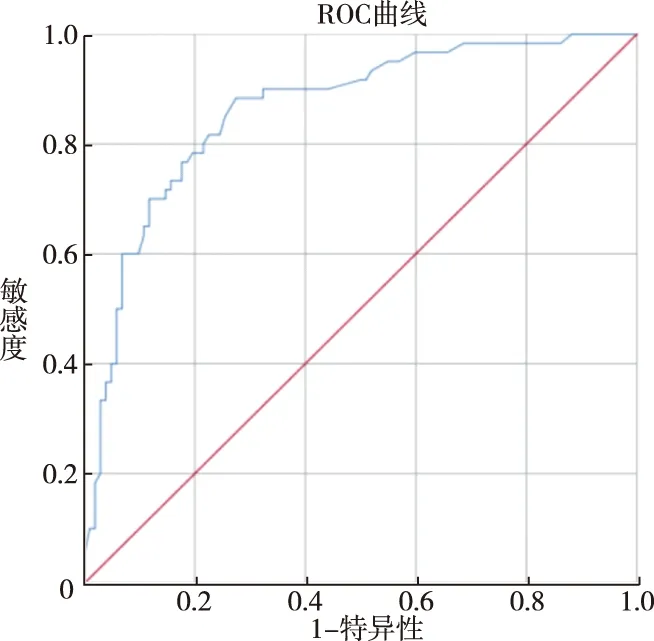
图4 预测模型区分度的ROC曲线
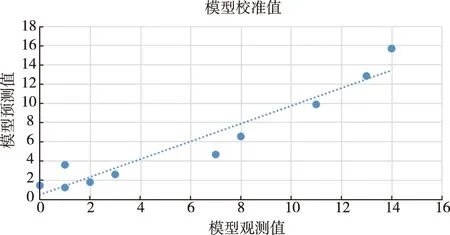
图5 预测模型校准度的散点图

图6 预测模型的列线图
2.6 验证预测模型 按照之前相同的纳入排除标准和简单随机抽样方法,我们从2019年1月至2020年6月间南通大学附属医院肝胆外科一病区随机选择了50例术后病理诊断为原发性肝细胞癌的患者。在该队列中,病理诊断提示有10例MVI患者和40例无MVI患者。我们使用建立的模型对50例患者进行了术前MVI的预测。MVI阳性预测的准确性为6/10(60%),MVI阴性预测的准确性为32/40(80%)。总体准确度为38/50(76%)。预测模型的敏感性为71%,特异性为83%。
3 讨论
HCC患者当前的治疗策略是手术切除,结合药物治疗。随着科学技术的进步,患者的预后和生活质量得到了明显改善。然而,肿瘤的复发和转移仍然限制了患者的长期生存,MVI仍然是HCC患者手术切除后肿瘤复发的关键危险因素[19]。在我们的研究中,37%的患者发生了MVI,表明术前MVI预测的重要性。在选择手术切除方法时,对于高度怀疑MVI阳性的患者,肝功能良好的,首选解剖性肝切除[20-22],对于肿瘤直径较大超过肝段的患者,优先采用肝叶或者半肝切除。对于发生MVI风险低的患者,我们则可以行保证切缘的局部切除和楔形切除,从而降低患者出血、感染的风险和对肝功能的影响,提高患者的近期预后[23]。
对于怀疑MVI阳性的患者,可以在术前或术中行经动脉化学栓塞治疗(TACE)[24-25]。靶向或免疫药物可在手术后及时投入使用,从而最大程度的杀灭患者肝内残存的癌细胞。对于发生MVI风险低的患者,经济条件好的家庭,在充分告知利弊后由患方决定是否尽早使用药物治疗;而对于经济条件差的家庭,如果病理提示MVI阴性则可在一定程度上减少家庭的经济负担[26]。
异常凝血酶原和γ谷氨酰转肽酶同工酶Ⅱ都可以通过术前检测肝癌酶谱得到,而异常凝血酶原数值的变化更具有规律性,它也成为本研究的一个重点[27]。Poté和Nicolas 曾提出异常凝血酶原与MVI的发生有关[28],之后便没有了更深入的研究,也没有与之相关的预测模型的建立。我们知道人体在缺乏维生素K的情况下,肝细胞不能合成正常的凝血因子(Ⅱ、Ⅶ、Ⅸ、Ⅹ),而只能合成异常凝血酶原。HCC患者由于凝血酶原前体羧化不足,从而生成大量的异常凝血酶原,随着肿瘤的进展,当瘤周微血管受到侵犯时(发生MVI),其所供给的那部分肝细胞受到影响,异常凝血酶原的值便随之升高。从本文研究的数据我们可以发现异常凝血酶原与MVI的发生呈高度正相关,甚至比肿瘤直径更敏感。因此HCC患者在术前对于异常凝血酶原值的测定就很有意义。
肿瘤的发生与炎症有关[29]。肿瘤的发生发展过程离不开炎症反应所提供的微环境。本研究得出NE(≥3.105×109/L)是MVI的独立危险因素。也有中心得出NLR是独立的危险因素[30]。肿瘤的发生刺激了局部炎症反应的开始,同时也意味着机体免疫功能的下降,随着肿瘤的进展,NE和LY两者的平衡被逐渐打破,形成了一个恶性循环,这可能导致了肿瘤微环境的改变,从而一定程度上促成了MVI的发生。但是由于大部分病例NE和LY的指标都在正常范围,且数值的上下区间很小,在统计学上,这种数值波动范围很小的变量要依赖于大的样本量才能得出更加准确的结果,故炎症反应与MVI的发生之间的关系有待多中心大样本量的研究去进一步论证支持。
现如今对于AFP的研究已经很成熟[31]。它是原发性肝细胞癌的主要血清生物标志物,主要来源于胚胎肝细胞,原发性肝癌病理上分为高、中、低分化肝细胞肝癌,一定意义上就是与原始胚胎肝细胞的相似程度。随着肿瘤的进展,这些“胚胎肝细胞”(肝癌细胞)增多,AFP值升高。本中心多因素分析得出的P值为0.093,认为AFP不是MVI发生的独立危险因素。对于临界值的选择,有的中心选择200 ng/ml,有的选择400 ng/ml,但是在样本量足够的情况下,我们认为还是通过ROC曲线分析得出约登指数所对应的AFP值更有说服力。
HCC患者MVI的发生与肿瘤的大小相关[32]。病程越长,肿瘤直径越大,血液供应就越丰富,MVI发生的可能性就越高。大多数中心分析使用的肿瘤直径临界值为5 cm。当直径超过5 cm时,发生MVI的风险将增加。本中心采用ROC曲线分析得出肿瘤直径≥5.65 cm是HCC患者发生MVI的独立危险因素,这与绝大部分中心所得结果一致。
通过影像学诊断肝癌是临床上的重要步骤,借助影像去发现病灶,进行定位,测量其大小,排除其他地方的病变等。很多中心通过分析CT、MRI中肿瘤的特性寻找到了规律[33-36]。造影剂在肿瘤组织里排出要比正常组织慢,而肿瘤内部组织质地的不规则,尤其血供的不规则就会造成强化的不均匀,瘤体质地软硬的参差不齐,特别是坏死的组织,容易脱落随着血流转移,从而增加了MVI的风险,同样的情况还会出现在门静脉期及延迟期的不均匀强化。瘤周包膜的强化是肿瘤周围新生的血管受压形成,本文在单因素分析过程中发现肿瘤的不均匀强化和瘤周强化与MVI的发生存在一定的相关性(P<0.05),虽然最终多因素分析结果不是独立危险因素,但仍然存在研究的价值。也有中心提出肿瘤形态的不规则与MVI发生有关[37],本中心研究发现这集中表现在直径>5 cm的肿瘤,而对于一些小肝癌,肿瘤形态大多规则。
沈锋曾在2016年提出了一个预测模型[38]。他们收集了1 004例接受肝切除的HBV相关HCC患者的数据,得出与MVI相关的7个术前因素是:肿瘤直径,包膜的不完整,肿瘤多发,乙型肝炎病毒DNA>104 IU/mL,血小板计数<100×103/μl,甲胎蛋白水平>20 ng/mL,以及对比增强磁共振成像上的典型肿瘤形态。这与我们中心单因素分析得到的结果基本一致,但是依然存在一些局限的地方。血小板和甲胎蛋白水平的临界值并不是通过ROC曲线得到的,而在临床上绝大部分患者的血小板计数都是正常的,因此对结果的可信度造成一定的影响。肿瘤包膜的完整性主要是通过术后的病理诊断,而术前诊断依赖于影像医生的主观判断,从而会产生误差。最后,这个预测模型研究对象是合并乙肝的患者,并不适用于没有肝炎感染的HCC患者。本中心将2012年至2020年我科所有行肝癌切除的患者纳入数据库,借助EXCEL随机筛选,根据纳入排除标准,最终将162例病理诊断为肝细胞肝癌的患者纳入研究,做到了随机性原则。我们基于前人的研究,将所有可能与MVI发生相关的指标全部纳入,将单因素分析有意义的指标纳入到多因素Logistic 回归中去研究,所纳入的风险因素越多,多因素分析得出的结果就越准确,也就是与MVI发生的相关性越高。由于每个中心所纳入多因素分析的指标不同,所得出的结果自然有差异。我们对预测模型进行了外部验证,而不是内部验证,从而大大提高了预测模型的准确性和临床适用性。但是由于样本量并不是很大,属于单中心的研究,故本研究存在一定的局限性。
综上所述,异常凝血酶原≥516 mAU/ml、NE≥3.105×109/L、肿瘤最大直径≥5.65 cm,是HCC患者发生MVI的独立危险因素,与HCC患者的MVI发生有关,根据这3个指标构建的预测模型有助于HCC患者MVI的术前预测,从而指导患者手术切除策略的选择,有一定的临床意义。

