非小细胞肺癌组织SNORA56基因性状分析及临床样本验证
林升华,王旖婷,蒋金霞,苏芸萱,李世康*
(1.广西医科大学 第一附属医院 胸外科,广西 南宁 530000; 2.桂平市人民医院 心胸外科,广西 桂平 537200; 3.桂平市人民医院 检验科,广西 桂平 537200)
肺癌是世界上发生率和死亡率最高的恶性肿瘤,我国肺癌五年生存率为19.8%[1].肺癌依据组织学分类可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC).NSCLC主要包括肺鳞状细胞癌(lung squamous cell carcinomas,LUSC)和肺腺癌(lung adenocarcinoma,LUAD),LUSC占所有肺癌的30%~35%,以中央型肺癌为主.LUAD约占35%~40%,是非吸烟患者中发生率最高的类型,腺癌以周围型多见,中央型也可见到.NSCLC占肺癌发生总数的85%,死亡率达80%~90%[2],大约70%患者确诊时已处于晚期,失去手术机会.肺癌晚期患者的5年生存率低于15%,肺癌早期患者通过合理治疗,5年生存率可高达80%,NSCLC患者即使处于进展期,在行肺癌根治术后结合其他合理辅助治疗,其5年生存率依旧可达35%~50%[3].NSCLC的早期发现、早期治疗对提高患者5年生存率至关重要.已有临床试验证实痰液中snoRNA检测对诊断肺癌有74.6%的敏感性和83.6%特异性[4].然而snoRNA种类繁多,最近发现的SNORA56在肺癌组织中的表达异常及其基因性状不明,目前仍缺乏这方面的研究.本研究通过癌症基因组图谱 (the cancer genome atlas, TCGA) 公共数据集并结合临床样本, 探究SNORA56在肺癌组织中的表达,分析其在NSCLC诊断及患者预后的影响,探索其基因性状,验证此性状的可重复性,分析SNORA56表达与NSCLC患者临床相关数据的关系,评估SNORA56表达量对NSCLC患者的诊断、预后的价值,并通过基因富集分析寻找SNORA56影响肺癌发展的可能通路.
1 材料与方法
1.1 数据收集
从SNORic数据库 (http:// bioinfo.life.hust.edu.cn/SNORic/) 下载SNORA56表达数据[5],SNORA56对应的RPKM(Reads Per Kilobase per Million mapped reads)数据经过R语言“limma”程序包进行校正预处理,随后对SNORA56相对表达量进行分析, 下载TCGA相应临床资料数据, 对临床病理相关性分析和预后进行分析.使用Spearman相关性分析TCGA肺癌患者SNORA56表达与拷贝数变异的相关性,|R2|>0.3及错误发现率(false discovery rate,FDR)<0.05被认为具有显著相关性.
1.2 基因集富集分析
采用基因集富集分析 (gene set enrichment analysis, GSEA)软件进行分析[6-7].基于1.1所标准化的mRNA数据,按SNORA56表达水平是否高于均数,将病例分为SNORA56高表达组和SNORA56低表达组.本研究利用GSEA网站MsigDB数据库中获得HALLMARK.gmt数据集;然后, 按缺省加权富集统计的方法进行富集分析, 设置随机组合次数为1 000次,在GSEA软件中分别对LUAD和肺鳞癌的数据进行分析,阈值设置为FDR<0.05.
1.3 临床样本采集
收集于2018年至2019年在广西医科大学第一附属医院胸外科手术的NSCLC患者的癌组织及癌旁组织标本,其中LUSC患者的12对,LUAD患者的18对,共30对.所有患者术前均未接受任何治疗,包括介入治疗或者放化疗、靶向治疗及免疫治疗.肺癌组织及癌旁组织于手术切除30 min内采集至甲醛溶液,迅速放至-80 ℃的样本收集冰箱进行存储,同时记录收集患者的相关临床信息.
1.4 实时荧光定量 PCR(qRT-PCR)检测mRNA表达
用TRIzol试剂(Invitrogen)从新鲜冷冻的肺癌样品中提取总RNA,用QIAGEN FFPE RNeasy试剂盒(QIAGEN GmbH,Hilden,Germany)从甲醛固定的肺癌样品中提取总RNA.用NanoDropND-2000分光光度计(Thermo Scientific,Rockford,IL,USA)测量RNA纯度和质量,用逆转录酶(Promega,Madison,WI,USA)对SNORA56进行逆转录.在CFX96 Touch序列检测系统(Bio-Rad,Hercules,CA,USA)上用SYBR Green qPCR SuperMix-UDG试剂(Invitrogen)进行qRT-PCR检测. GAPDH和β-actin分别用作新鲜冷冻肺癌标本及FFPE样品的标准化对照.使用2-ΔΔCT方法计算SNORA56相对表达水平[8].SNORA56相应的引物ACA56为Forward:5′-TCTGGCTCGTGGGACTC-TAG-3′;Reverse:5′-TGACGCTGGACAGAAGAACTC-3′.
1.5 统计学方法
对临床样本患者年龄、性别、T分期、是否有淋巴结转移、是否复发等指标进行量化赋值, 使用SPSS 24.0软件进行统计学分析,通过两独立样本t检验分析两组数据之间的差异,多于3组之间的数据差异使用单因素方差分析进行比较.同时,使用Kaplan-Meier 曲线(简称K-M曲线)对患者进行生存分析.P<0.05认为具有统计学差异.
2 结果
2.1 数据集筛选和临床病理学参数相关性分析
在SNORic数据库上下载得到含有SNORA56表达量的NSCLC癌旁组织样本91例,其中,LUSC 45例,LUAD 46例;NSCLC癌组织样本989例,其中,LUSC 476例,LUAD 513例. 通过对临床数据进行评估和筛选,最后确认所有989例病例均含有完整临床病理参数和生存资料,根据mRNA测序结果数据,LUSC癌组织样本中SNORA56表达量为(27.029±33.723),LUAD癌组织样本中SNORA56表达量为(16.780±24.167).如果NSCLC癌组织中某一样本SNORA56表达大于均数,则定义为SNORA56高表达,低于均数则定义为SNORA56低表达.据此得出,LUSC癌组织中SNORA56高表达146例,低表达330例;LUAD癌组织中SNORA56高表达157例,低表达356例.
2.2 基于TCGA分析NSCLC癌组织与癌旁组织中SNORA56差异表达
对TCGA数据库中snoRNA在NSCLC癌组织和癌旁组织中的表达水平进行分析,结果显示, SNORA56在NSCLC癌组织中的mRNA表达水平,LUSC癌组织中的表达量为(27.029±33.723),LUAD癌组织中的表达量为(16.780±24.167),明显高于癌旁组织中snoRNA的表达水平,LUSC癌旁组织中的表达量为(1.264±2.340),LUAD癌旁组织中的表达量为(0.917±2.220)(P<0.000 1),具有统计学差异(表1、2,图1、2).分析476份LUSC癌组织和45份LUSC癌旁组织,发现SNORA56表达水平与患者年龄、性别、T分期、M分期及癌症是否复发无关(P>0.05),与是否有淋巴结转移有关(P=0.02<0.05,图3).分析513份LUAD癌组织和46份LUAD癌旁组织,发现SNORNA56表达水平与患者年龄、性别、T分期、M分期、是否有淋巴结转移及癌症是否复发均无关(P>0.05,图4).如图5、6所示,SNORA56表达水平与肺癌患者预后无显著关系,LUSC组(Log-rank2=1.248,P=0.27);LUAD组(Log-rank2=0.067,P=0.80),SNORA56低表达与高表达患者无论在LUSC组还是LUAD组,生存预后均无统计学差异.
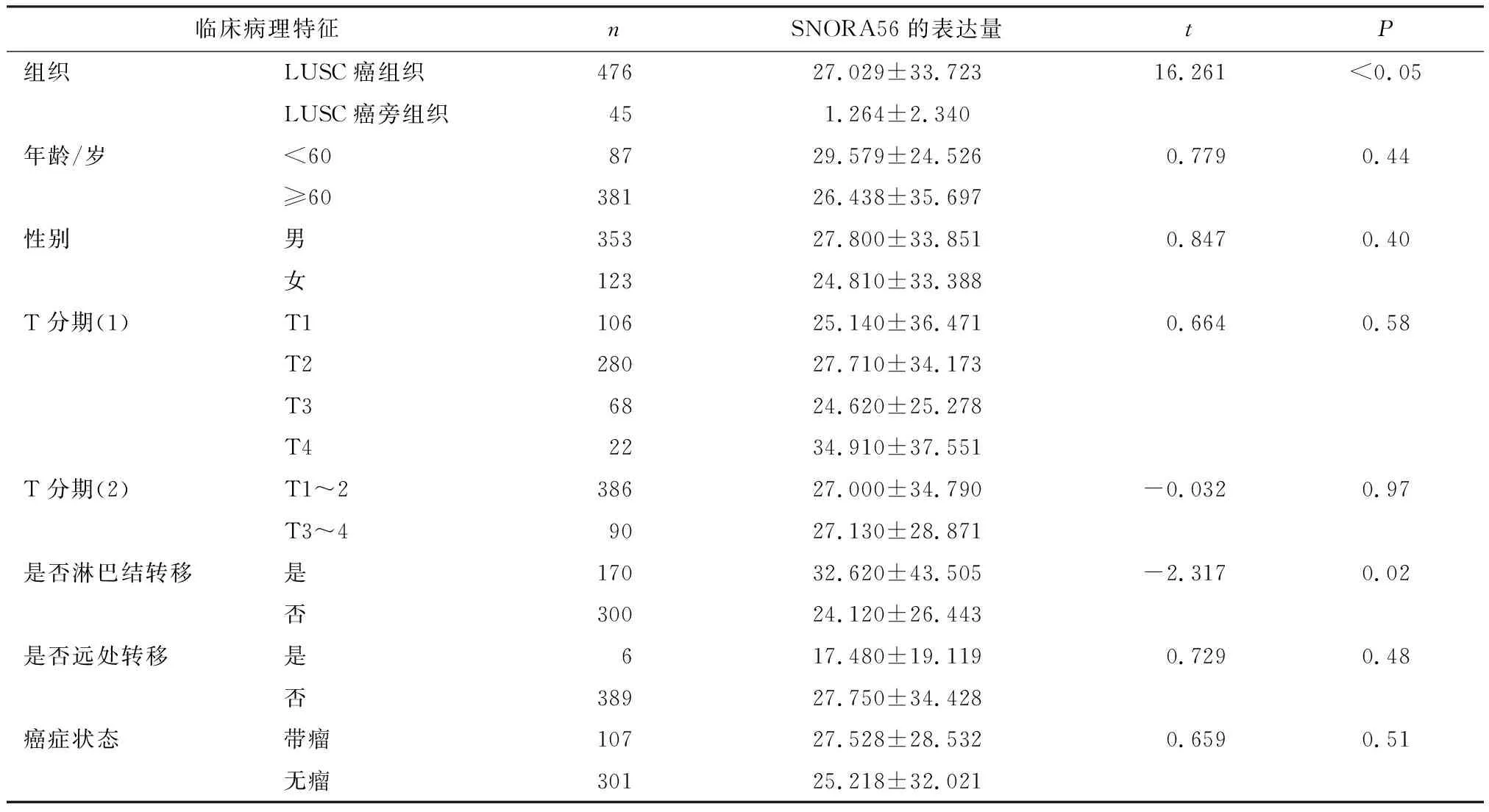
表1 LUSC患者临床资料相关性分析Table 1 Correlation analysis of clinical data in patients with LUSD
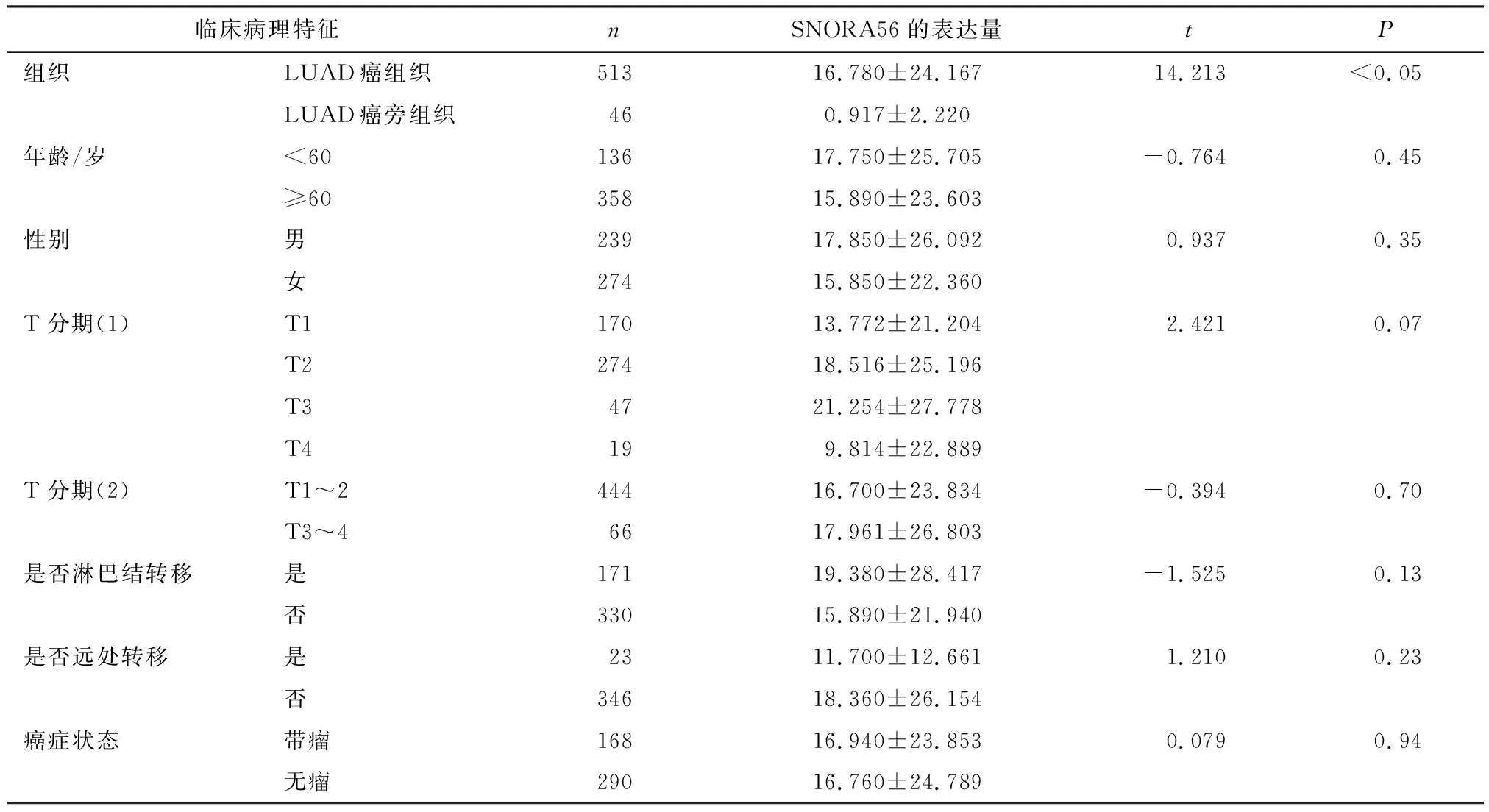
表2 LUAD患者临床资料相关性分析Table 2 Correlation analysis of clinical data in patients with LUAD
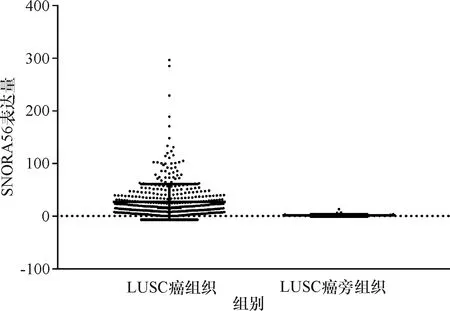
图1 SNORA56在LUSC患者癌组织和癌旁组织中的表达Fig.1 Expression of SNORA56 in carcinoma and para-cancerous tissues of patients with LUSC
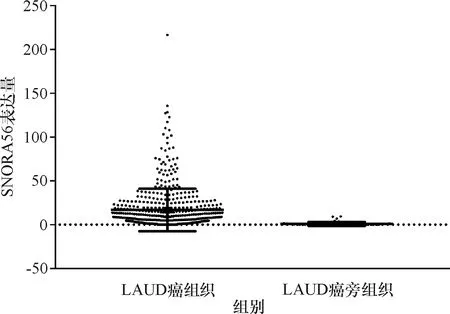
图2 SNORA56在LUAD患者癌组织与癌旁组织中的表达Fig.2 Expression of SNORA56 in carcinoma and para-cancerous tissues of patients with LUAD
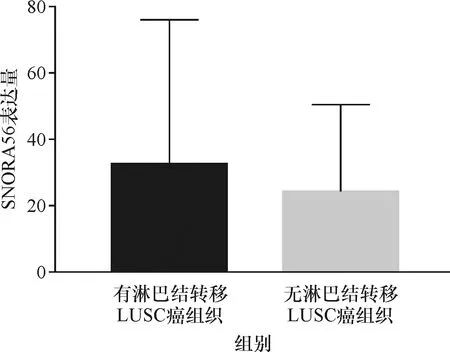
图3 SNORA56在有淋巴结转移与无淋巴结转移的LUSC患者癌组织中的表达(TCGA数据)Fig.3 Expression of SNORA56 in carcinoma tissues of LUSC patients with and without lymph node metastasis(data from TCGA)
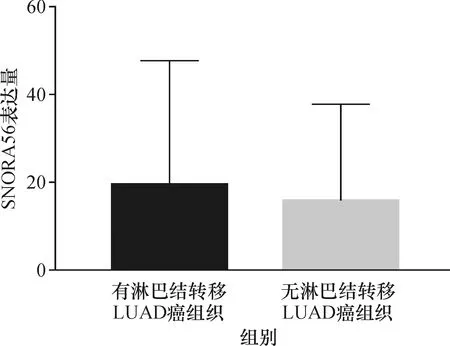
图4 SNORA56在有淋巴结转移与无淋巴结转移的LUAD患者癌组织中的表达Fig.4 Expression of SNORA56 in carcinoma tissues of LUAD patients with and without lymph node metastasis

图5 SNORA56表达状态与LUCS患者预后关系Fig.5 Relationship between SNORA56 expression status and prognosis of LUSC patients

图6 SNORA56表达状态与LUAD患者预后关系Fig.6 The relationship between SNORA56 expression status and prognosis of LUAD patients
2.3 SNORA56功能基因集富集分析
最后,本研究根据NSCLC患者SNORA56的表达水平均值将肺癌患者分为高表达组和低表达组,随后使用GSEA法对相应的数据进行通路分析,结果提示, 在LUAD SNORA56高表达的样本中存在13条显著富集信号通路 (FDR<0.05),且其中11条相关信号通路富集最为显著(FDR<0.05).最终通过韦恩图分析发现,在LUAD和LUSC中,共同存在9条相关信号通路,其中Myc Targets V1、 Mtorc1 Signaling、Myc Targets V2、E2f Targets及 G2M Checkpoint相关信号通路提示SNORA56极有可能通过影响细胞周期凋亡而影响肺癌的发展,Oxidative Phosphorylation和Fatty Acid Metabolism相关信号通路提示SNORA56极有可能通过影响氧化磷酸化及脂质代谢对肺癌的发生发展起相关作用.
2.4 SNORA56的表达水平与其拷贝数变异的相关性
本研究通过SNORic数据库对SNORA56的mRNA表达水平与其拷贝数的相关性分析.结果显示,在LUAD中,SNORA56 mRNA与相应基因组所在位置的拷贝数存在正相关的关系(|R2|=0.236 9,P=2.17e-7).SNORA56 mRNA的表达水平与拷贝数变异存在相同的趋势(|R2|=0.226 6,P=4.45e-6).由此可见,SNORA56在肺癌中的表达差异可能是因为其中基因组水平上突变而导致的结果,进而影响肺癌的发生发展.
2.5 SNORA56在临床肺癌样本中的差异表达
本研究做了30对临床样本SNORA56的PCR分析,标本选择为同一NSCLC患者的癌组织及癌旁组织,排除不同个体组织比较的各因素的影响.结果提示(图7),30对NSCLC患者临床样本中,NSCLC患者癌组织中SNORA56表达水平比癌旁组织偏高有16对样本,表达偏低有4对样本.T检验结果显示(表3),SNORA56在NSCLC患者癌组织(0.001 629±0.000 321)中的表达水平明显高于癌旁组织(0.000 624±0.000 520),具有显著统计学差异(P=0.004 0<0.05).SNORA56在有淋巴结转移的LUSC患者癌组织明显高于无淋巴结转移的LUSC患者癌组织(图8),有统计学差异(P=0.036 2<0.05).SNORA56表达水平与性别无关(P>0.05).

图7 SNORA56在NSCLC患者癌组织与癌旁组织中的表达Fig.7 Expression of SNORA56 in carcinoma and para-cancerous tissues of patients with NSCLC

表3 SNORA56与30对NSCLC患者样本各临床指标相关性分析Table 3 Correlation analysis between SNORA56 and clinical related indicators of 30 pairs of samples of patients with NSCLC
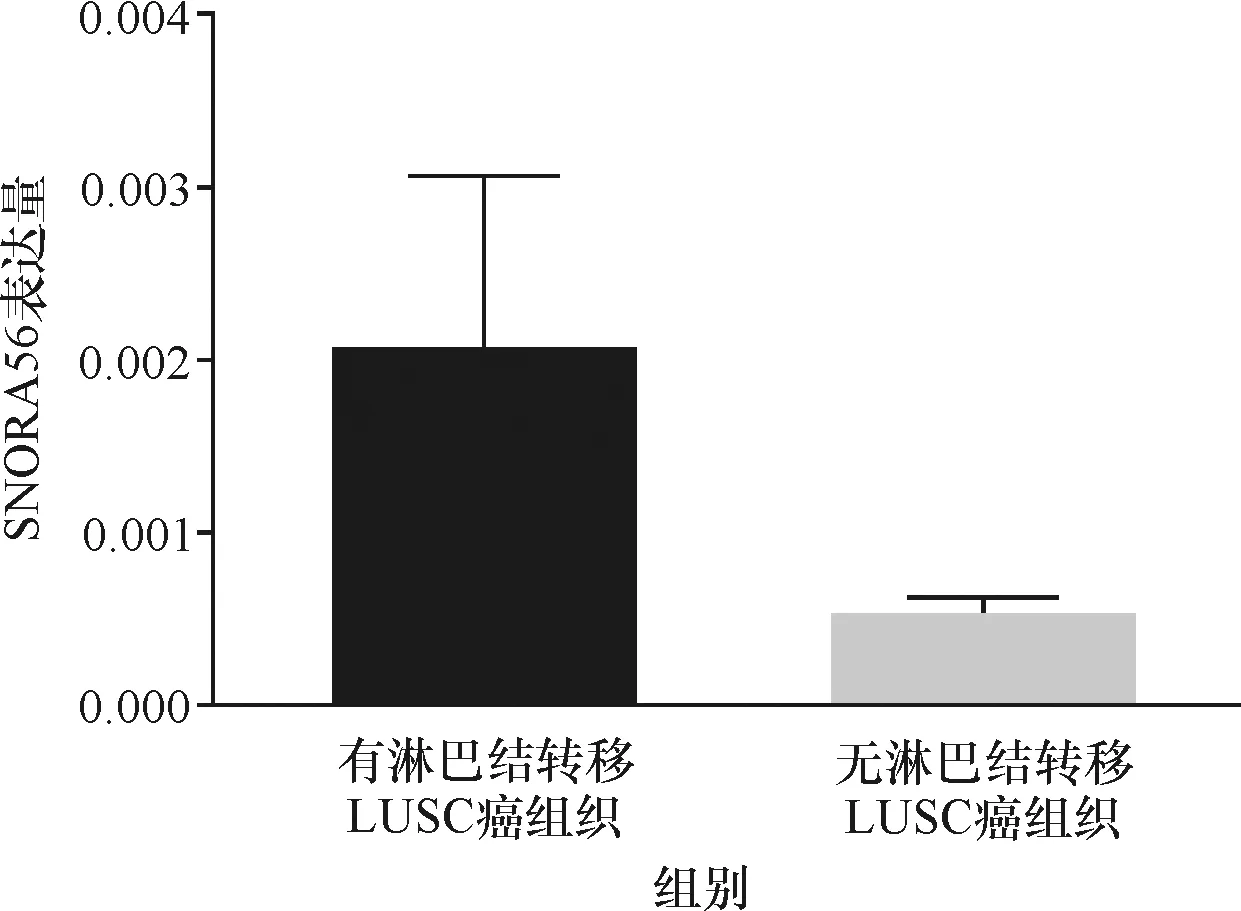
图8 SNORA56在有淋巴结转移和无淋巴结转移LUSC患者癌组织中的表达(临床样本数据)Fig.8 Expression of SNORA56 in carcinoma tissues of LUSC patients with and without lymph node metastasis(data from clinical samples)
3 讨论
肺癌是威胁人类生命健康的重要疾病,发生率及死亡率均排在所有恶性肿瘤第一位[9].肺癌总体预后差,70%左右肺癌病例确诊时已为晚期,而晚期肺癌5年生存率低于15%.肺癌筛查是发现早期肺癌的关键所在,早期肺癌通过手术治疗后的5年生存率可高达83%,而转移后的Ⅲ期肺癌患者5年生存率低至15%以下,Ⅳ期肺癌患者5年生存率仅2%[10].目前虽发现有多个基因在肺癌诊断、治疗、判断预后方面有一定作用[11-12],但临床使用的效果仍需进一步验证.早诊断,早治疗,对提高患者生存率至关重要,因此寻找一种灵敏度、特异度高、副作用小的辅助检查手段成为迫切需要,同时寻找对肺癌预后判断及有效治疗靶点更刻不容缓.据报道,核仁小RNA(small nucleolar RNA,snoRNA)是一类定位于细胞核的非编码RNA,含有60~300个核苷酸,许多生物体内存在数百种snoRNA,是数量最多的非编码RNA组[13].根据结构和功能的不同,目前snoRNA基本可分为4类,数量多且研究较多的两类为 box C/D snoRNA和box H/ACA snoRNA,小卡扎尔体RNA (small Cajal body-specific RNA, scaRNA) 及孤儿型snoRNA (orphan snoRNA)这两类数量少且研究较少[14].snoRNAs的功能很多,目前已知最主要的功能是参与rRNAs的生成与成熟.近年来,众多snoRNA的研究证实,snoRNA与肿瘤的发生发展关系密切,这为进一步了解肿瘤发生发展机制、肿瘤的诊断、治疗方法及预后判断提供了新的研究方向[15].
本研究从TCGA数据库下载SNORA56在NSCLC患者癌组织及癌旁组织中的表达数据及相关临床数据,分析了SNORA56在989例NSCLC患者癌组织及91例NSCLC患者癌旁组织中的表达量,结果显示SNORA56在NSCLC患者癌组织的表达水平显著高于癌旁组织,同时发现SNORA56在LUSC患者癌组织中高表达与淋巴结有转移存在密切关系.术后肿瘤组织病理确诊为LUSC的患者若术前影像学检查未发现淋巴结肿大,术中因条件限制未能完全切除纵隔淋巴结,而术后检测SNORA56明显升高,则患者可能已经发生相应淋巴结转移,这对LUSC患者术后辅助治疗的选择有重要参考意义.本研究数据是基于TCGA数据库以及Gong等学者建立的SNORic数据库,数据结果可靠性均得到国际学者认可[5].实时荧光定量PCR分析了30对NSCLC癌组织及对应癌旁组织中SNORA56的表达水平,发现SNORA56的表达水平在NSCLC患者癌组织中明显升高,有淋巴结转移较无淋巴结转移的LUSC患者癌组织SNORA56表达水平明显偏高,SNORA56在有淋巴结转移与无淋巴结转移的LUAD患者癌组织中的表达无统计学差异,与数据库中所得结果相同.此外,基于 TCGA数据库的肺癌基因组数据发现,SNORA56 mRNA的表达水平与其基因组水平的拷贝数变异存在正相关关系.由此可以推断,SNORA56基因的拷贝数出现了变异,导致其转录水平发生改变,进而影响肺癌的发生发展.为了进一步探索SNORA56在肺癌诊断中的潜在功能,本研究进行了GSEA分析,结果显示SNORA56可能通过影响细胞周期凋亡相关通路在肺癌发生发展中发挥重要作用.研究表明,无论是在果蝇还是在脊椎动物中,许多snoRNAs都受到Myc的影响而转录激活[16].在正常发育过程中,丢失snoRNAs不利于生长,但在神经元肿瘤模型中,snoRNAs的过度表达则会增加肿瘤的质量.此外SNORA56还可能作用于氧化磷酸化及脂质代谢等相关信号通路,导致其代谢通路紊乱,进一步影响肺癌的发生发展.本研究只对SNORA56进行了初步分析,其与NSCLC相关性的具体作用机制尚不明晰,还需更深层次的实验进行探索.

