黄连素通过miR-29b保护缺氧复氧诱导H9c2细胞损伤中的作用及其机制
卢玉润,唐宇帆
(1.四川省医学科学院,四川省人民医院老年内科,四川 成都 610072;2.四川大学华西公共卫生学院/四川大学华西第四医院检验科,四川 成都 610041)
心肌缺血再灌注(ischemia/reperfusion,I/R)损伤可引起缺血区域心肌细胞结构发生改变、细胞发生凋亡,导致心肌收缩能力下降,诱发心功能障碍,使患者疾病加重,成为限制急性心肌梗死和冠心病等心血疾病临床治疗的重要因素[1]。因此,深入探讨I/R损伤进展机制对心血管疾病的防治具有重要意义。近年大量研究报道,I/R损伤可引起某些微小RNAs(microRNAs,miRNAs)表达的改变,而这些miRNAs可通过调控心肌细胞应激、炎症反应和心肌细胞凋亡等过程参与I/R损伤[2-4]。miR-29b是一种与心血管疾病密切相关的miRNA,被证实在心肌I/R损伤中表达下调,且发挥抗心肌细胞凋亡的重要作用[5]。黄连素又名小檗碱,是从中药黄连根茎中提取的一种生物碱,具有抗炎、抗氧化和抗癌等多种药理作用[6]。大量研究显示,黄连素对心肌I/R损伤具有一定的保护作用,但其具体的保护机制并未阐明[7-9]。有研究显示,黄连素可通过上调miR-29b促进缺血诱导的血管生成并改善心脏功能,但其是否通过调控miR-29b表达参与保护I/R损伤未见报道[10]。缺氧/复氧(hypoxia reoxygenation,H/R)模型是体外模拟I/R损伤的常用细胞模型,本研究采用H9c2心肌细胞构建H/R细胞模型,观察miR-29b在黄连素保护H/R诱导的H9c2细胞损伤中的作用,旨在为黄连素用于抗心肌I/R损伤提供新的参考依据。
1 材 料 与 方 法
1.1细胞、药品与试剂 大鼠胚胎心肌细胞株H9c2购于中科院上海细胞库。黄连素(纯度98%)购于中国药品检验所,DMEM/F12中糖培养基购于美国Hyclone公司,胎牛血清购于杭州四季青公司,0.25%胰蛋白酶购于美国Gibco公司,TRIzol RNA 裂解液和脂质体2000购于美国Invitrogen公司,辣根过氧化酶标记的二抗购于北京中杉生物技术公司,第10染色体同源丢失性磷酸酶张力蛋白基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)抗体和磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)抗体购于美国Abcam公司。miR-29b mimics、miR-29b inhibitor及相应的阴性对照购于上海吉玛制药技术公司,放射免疫沉淀测定(radioimmunoprecipitation assay,RIPA)蛋白裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液和二喹啉甲酸(Bicinchoninic acid disodium,BCA)蛋白检测试剂盒购于碧云天生物技术研究所,psiCHECK-2荧光素酶载体购于西安赛拓博泰生物科技有限公司。膜联蛋白/碘化丙啶凋亡试剂盒购于美国Biouniquer 公司,逆转录试剂盒、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)活性检测试剂盒购于上海碧云天生物技术公司,乳酸盐脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自南京建成生物工程研究所,荧光素酶活性检测试剂盒购于美国Promega公司,Takara点突变试剂盒购于上海联迈生物公司。
1.2方法
1.2.1细胞培养、分组和H/R模型构建 H9c2细胞采用含100 U/mL青霉素-链霉素和10%胎牛血清的DMEM/F12中糖培养基在条件为CO2体积分数为5%、37 ℃ 、湿度饱和的细胞培养箱中培养和传代。将第3代对数期细胞分为:对照组(正常培养)、H/R组(行H/R处理)和Ber组(行H/R处理前给予终浓度为150 μmol/L Ber处理24 h)。H/R处理:采用5%CO2-95%N2混合气体平衡的无血清无糖的DMEM/F12培养基替换H9c2细胞原培养液后,放入以4 L/min流速通有95%N2-5%CO2混合气体的缺氧装置中缺氧处理4 h,再用含血清的DMEM/F12中糖培养基替换细胞培养液,并在5%CO2-95%O2的细胞培养箱中复氧处理4 h,即为H/R细胞模型。
1.2.2MTT检测细胞存活率 以每孔6×103个/孔密度将H9c2细胞接种至96孔板上,常规培养过夜。将细胞按照1.2.1中的分组,每组设置5个复孔,并以不含细胞的组作为空白组。处理结束后,每孔加入四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)溶液20 μL,再孵育4 h后,弃培养液,加入150 μL的二甲基亚砜孵育10 min,上酶标仪检测各组细胞的光密度(optical density,OD)值,并根据公式:细胞存活率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)。实验重复3次。
1.2.3流式细胞仪检测细胞凋亡率 收集对照组、H/R组和Ber组细胞,磷酸缓冲液洗涤细胞2次,加入Binding Buffer 制备浓度单细胞悬液(为2×104个/mL的)。取5 μL Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和 5 μL PI依次加入100 L细胞悬液中,避光染色10 min。1 h内上流式细胞仪检测细胞凋亡率。实验重复3次。
1.2.4试剂盒检测细胞上清液中LDH释放量 收集按照1.2.1中的分组处理结束后的对照组、H/R组和Ber组细胞上清液,参照LDH试剂盒说明书步骤检测各组细胞上清液中LDH的释放量。实验重复3次。
1.2.5Caspase-3活性检测 收集按照1.2.1中的分组处理结束后的各组细胞,参照Caspase-3活性检测试剂盒说明书步骤测定各组细胞Caspase-3活性。实验重复3次。
1.2.6RT-PCR检测细胞中miR-29b的表达 TRIzol裂解液提取对照组、H/R组和Ber组细胞总RNA,测啶RNA的浓度与纯度后进行反转录合成成cDNA。以单链cDNA为模板,按照95 ℃ 6 min,95 ℃ 60 s、58 ℃ 30 s、72 ℃ 60 s(40个循环),72 ℃ 10 min的反应程序上PCR仪进行扩增,采用2-△△CT法分析miR-29b表达水平。其中,miR-29b上游引物序列为5'-CGTAGCACCATTTGAAAT-CAGTGTT-3',下游引物序列为5'-GTGCAG-GGTCCGAGGT-3';内参U6上游引物序列为5'-CTCGCTTCGGCAGCACA-3',下游引物序列为5'-AACGCTTCACGAATTTGCGT-3'。
1.2.7细胞转染 将对数期H9c2细胞以1×104个/孔接种至6孔板,待细胞融合度达75%时,将细胞分为H/R+Ber+anti-miR-29b组(转染miR-29b inhibitor后行H/R和Ber处理)和H/R+Ber+anti-miR-NC组(转染miR-29b inhibitor 阴性对照后行H/R和Ber处理),参照脂质体2000说明书步骤根据实验分组将miR-29b inhibitor及其阴性对照转染至H9c2细胞中,转染48 h后,参照1.2.1中的步骤进行H/R和Ber处理。处理结束后,收集H/R+Ber+anti-miR-29b组、H/R+Ber+anti-miR-NC组以及1.2.1中的对照组、H/R组和H/R+Ber组细胞,分别采用RT-PCR、MTT法、LDH试剂盒、流式细胞仪、Caspase-3活性检测试剂盒分别检测各组细胞中miR-29b的表达水平、细胞存活率、细胞上清液中LDH释放量、细胞凋亡率和Caspase-3活性。后期miR-29b对PTEN蛋白表达的影响实验中,将另接种一板细胞,将其分为miR-29b组(转染miR-29b mimics)、anti-miR-29b组(转染miR-29b inhibitor)、miR-NC组(转染miR-29b mimics阴性对照)、anti-miR-NC组(转染miR-29b inhibitor阴性对照),参照脂质体2000说明书步骤根据上述分组进行转染。转染48 h后,收集各组细胞,采用Western blot检测PTEN蛋白表达水平。
1.2.8双荧光素酶报告基因的实验验证miR-29b和PTEN的靶向关系 运用miRanda、miRBase和TargetScan三大生物信息学工具预测miR-29b的潜在靶基因,最终确定PTEN为研究对象,将含有能够与miR-29b结合的PTEN3′非翻译区(untranslated Regions,UTR)序列结构或利用Takara点突变试剂盒定位突变的序列结构进行克隆并转入psiCHECK-2荧光素酶载体中,分别构建PTEN野生型(PTEN-WT)和PTEN突变型(PTEN-MUT)载体,并将其分别与miR-29b mimics、miR-29b inhibitor及其相应对照共转染48 h后,参照荧光素酶检测试剂盒说明书步骤测定各组细胞荧光素酶活性。实验重复3次。
1.2.9Western blot检测PTEN蛋白表达 RIPA蛋白裂解液提取对照组、H/R组和Ber组细胞总蛋白。按照60 μg/孔将蛋白样品上样至SDS-PAGE凝胶中进行电泳,并电转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。膜封闭后,转至一抗工作液(PTEN 1∶1 000和GAPDH 1∶1 000)中4 ℃下孵育24 h。再用二抗工作液室温孵育1 h。化学发光试剂盒显影、曝光,采用凝胶成像系统分析目的条带相对灰度值表示目的蛋白表达水平。实验重复3次。
1.3统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用单因素方差分析、SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1黄连素对H/R诱导的H9c2细胞损伤的保护作用与对照组比较 H/R处理后细胞存活率明显降低,而细胞上清液中LDH释放量和细胞凋亡率、Caspase-3活性均明显升高(P<0.05);但给予黄连素处理后H/R引起的上述变化明显受到抑制(P<0.05)。见图1和表1。

图1 流式细胞仪检测各组细胞凋亡情况
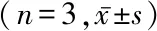
表1 各组细胞存活率、凋亡率和Caspase-3活性比较Table 1 Comparison of cell survival rate,apoptosis rate and Caspase-3 activity in each group
2.2黄连素上调H/R诱导的H9c2细胞中miR-29b表达 与对照组比较,H/R处理后H9c2细胞中miR-29b的表达水平明显降低(P<0.05);但是,给予黄连素处理后的H/R引起的miR-92b表达下降明显受到抑制(P<0.05)。见表2。
2.3下调miR-29b逆转黄连素对H/R诱导的H9c2细胞损伤的保护作用 与对照组比较,H/R处理后H9c2细胞中miR-29b表达水平明显降低,而细胞上清液中LDH释放量以及细胞凋亡率、Caspase-3活性明显升高(P<0.05);与H/R组比较,给予黄连素处理后H/R引起的上述变化明显受到抑制(P<0.05);但是,转染miR-29b inhibitor成功下调miR-29b表达可阻断黄连素对H9c2细胞损伤的保护作用(P<0.05);而转染miR-29b inhibitor阴性对照对黄连素的保护作用无明显影响(P>0.05)。见图2,表3。
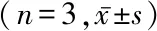
表2 各组细胞中miR-29b和PTEN蛋白表达比较Table 2 Expression of miR-29b and PTEN protein in cells of each group

图2 流式细胞仪检测各组细胞凋亡情况A.对照组;B.H/R组;C.H/R+Ber组;D.H/R+Ber+anti-miR-NC组;E.H/R+Ber+anti-miR-29b组Figure 2 Cell apoptosis detected by flow cytometry-in each group
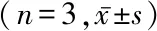
表3 各组中miR-29b表达水平、细胞凋亡率和Casapse-3活性比较Table 3 Comparison of miR-29b expression level, apoptosis rate and Caspase-3 activity in each group
2.4PTEN是miR-29b靶基因 生物信息学软件预测发现,PTEN 3′ UTR区域存在能够与miR-29b互补的结合位点,见表3。与PTEN-WT质粒共转染的miR-29b 组细胞的荧光素酶活性较miR-NC组明显降低(P<0.05);而与PTEN-WT质粒共转染的anti-miR-29b 组细胞的荧光素酶活性较anti-miR-NC组明显升高(P<0.05);但是,同PTEN-MUT质粒共转染的miR-29b 组或者anti-miR-29b 组细胞的荧光素酶活性与相应对照比较差异均无统计学意义(P>0.05)。Western blot检测结果显示,miR-29b组细胞中PTEN蛋白的表达水平较miR-NC组明显降低(P<0.05);而anti-miR-29b组细胞中PTEN 蛋白的表达水平较anti-miR-NC组明显升高(P<0.05)。见图3和表4。

表3 PTEN 3′ UTR与miR-29b的结合位点Table 3 Binding sites of PTEN 3 ′UTR and miR-29b
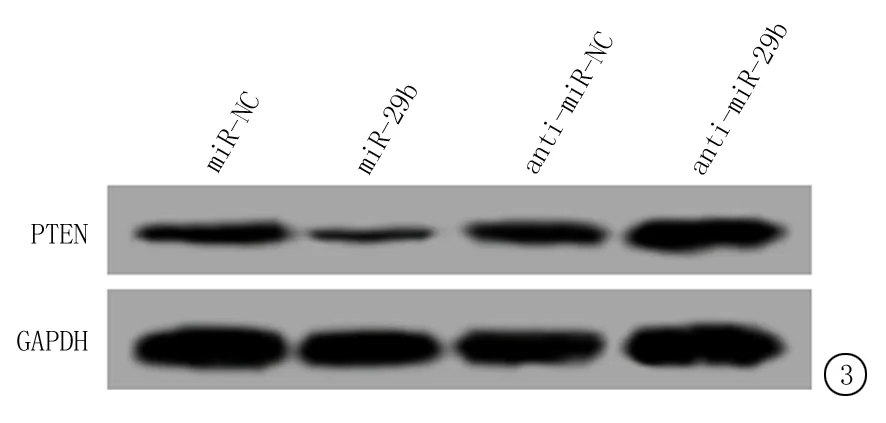
图3 Western blot检测PTEN蛋白的表达
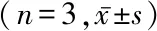
表4 各组细胞荧光素酶活性和PTEN蛋白表达水平的比较Table 4 Comparison of luciferase activity and PTEN protein expression in cells of each group
3 讨 论
心肌细胞坏死是导致心肌细胞死亡的重要方式,而LDH是目前检测细胞坏死的重要手段,LDH是机体代谢过程中一种重要的蛋白酶,细胞膜受损后,胞内的LDH大量外漏,而其外漏程度可间接反映出细胞的受损程度[11-12]。另外,除心肌细胞坏死外,心肌细胞凋亡也是造成心肌细胞死亡的重要方式,其可造成的组织损伤和心功能障碍,被认为是I/R损伤发生的重要机制[13-14]。Caspase-3是细胞凋亡的重要执行因子,其活性的高低可反映细胞凋亡程度[15]。本研究对心肌H9c2细胞H/R处理后显示,H9c2细胞活性降低,细胞上清液中LDH释放量、细胞凋亡率以及Caspase-3活性均显著升高。这表明H/R可诱导心肌H9c2细胞损伤。同时,给予黄连素作用后,H/R引起的H9c2细胞损伤明显得到改善。这与Zhao等[9]得到的黄连素具有保护H/R诱导的H9c2细胞损伤的结果相吻合。
miR-29b是miR-29家族成员,定位于人7q32和1q32染色体上,可通过调控细胞凋亡参与肿瘤等多种疾病的发生发展[16-17]。有研究指出,miR-29b可通过抑制p53依赖的凋亡途径、增强细胞活力、降低LDH渗漏,减轻氧和葡萄糖剥夺/再灌注诱导的损伤[18]。已有文献指出miR-29b具有保护I/R损伤的作用[5]。本研究结果显示,H/R处理后H9c2细胞中miR-29b的表达水平显著下调,而黄连素可上调miR-29b表达。这提示miR-29b可能在黄连素保护H/R诱导的H9c2细胞损伤过程中发挥着重要作用。通过转染miR-29b inhibitor成功下调miR-29b表达后发现,黄连素对H/R诱导的H9c2细胞损伤的保护作用明显减弱。文献报道,miR-29b表达上调是黄连素促进缺血诱导的血管生成并改善心脏功能的重要机制[10]。结果提示,miR-29b在黄连素保护H/R诱导的H9c2细胞损伤过程中发挥着积极作用。
PTEN是一种与I/R密切相关的调控基因,被证实在I/R大鼠心肌组织中异常高表达,而下调其表达可减少H/R诱导的心肌细胞凋亡和氧化损伤[19-21]。已有研究在小鼠神经元GT1-7细胞、人子宫内膜癌细胞中证实PTEN是miR-29b的靶基因[22-23]。本研究通过双荧光素酶报告基因实验证实在H9c2细胞中miR-29b与PTEN 3’UTR的靶向结合,且miR-29b对PTEN表达具有负向调控作用。结果表明,miR-29b/PTEN途径可能在黄连素保护H/R诱导的H9c2细胞损伤中发挥作用。
综上所述,miR-29b在黄连素保护H/R诱导的H9c2细胞损伤中发挥着重要作用,其作用机制可能与靶向调控PTEN有关。该结果为黄连素临床抗I/R损伤提供了新的参考依据。

