循环血浆中miR-150-5p表达与原发性高血压的关系
霍江华,倪倩,田冲冲,杨烨,卢小敏,俞黎黎,李长峰,钱炳俊
(1.江苏医药职业学院医学技术学院,江苏 盐城 224005; 2.盐城市第一人民医院检验科,江苏 盐城 224005)
原发性高血压是一种严重影响我国居民健康的多因素慢性疾病,也是导致我国居民心血管病死亡的主要原因,调查显示我国年龄≥18岁居民的高血压患病率为25.2%,患病人数多达2.7亿,但目前其分子机制尚未完全清楚[1]。研究表明,微RNAs(microRNAs,miRNAs)可通过参与活化肾素-血管紧张素-醛固酮系统、促进血管平滑肌收缩、影响血管内皮细胞功能等途径参与高血压的发生发展[2]。研究发现,自发高血压大鼠主动脉弓内miR-150-5p的表达水平降低,而miR-150-5p表达水平的降低使转录因子特异性蛋白1(specific protein 1,SP1)及其下游基因血管紧张素Ⅱ1型受体的表达增加,从而导致自发高血压大鼠的血压升高;同时该研究还发现,应用抗氧化表没食子儿茶素没食子酸酯能通过增加miR-150-5p的表达,降低自发性高血压大鼠血压[3]。可见,miR-150-5p参与了血压调节。有研究发现,高血压患者循环血液中出现了多种miRNAs的表达改变,但有关高血压患者循环miR-150-5p表达变化的人群研究较少,且结果并不一致[4-5]。本研究通过测定受试者循环miR-150-5p的表达水平,分析miR-150-5p表达与高血压之间的关系。
1 资料与方法
1.1一般资料 选取2019年5—11月在盐城市第一人民医院住院的80例原发性高血压患者作为高血压组,符合《中国高血压防治指南(2018年修订版)》[6]中的原发性高血压诊断标准[收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg],选择同期31例非高血压(收缩压<140 mmHg和舒张压<90 mmHg)患者作为非高血压组。排除继发性高血压、有原发性肾脏疾病患者,所有研究对象均签署知情同意书。
1.2方法
1.2.1信息收集及血样采集 使用统一编制的调查问卷对两组研究对象的一般状况(性别、年龄等)和高血压相关危险因素(吸烟、饮酒等)进行问卷调查,并测量受试者身高和体重,计算体质指数(body mass index,BMI)。两组研究对象均采集空腹静脉血2份。一份测定空腹血糖、血红蛋白、总蛋白、白蛋白、总胆固醇、三酰甘油、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、血尿酸等生化指标,并由临床医师按照糖尿病、高脂血症、高尿酸血症的诊断标准依据实验室检查结果做出相应疾病的诊断;另一份用乙二胺四乙酸抗凝,3 000×g离心10 min,分离血浆并于-80 ℃储存,留待进行miRNAs相对表达水平分析。
吸烟是指现在每日吸烟量超过1支,持续时间不少于1个月或过去曾经吸烟;饮酒是指过去半年内男性饮酒者日均酒精摄入量≥41 g,女性饮酒者日均酒精摄入量≥21 g[7-8]。糖尿病、高脂血症、高尿酸血症等疾病的诊断分别由临床医师按照《内科学》第9版[9]相应诊断标准进行判断。①糖尿病:具有典型的临床症状加上任意血糖≥11.1 mmol/L或空腹血糖≥7.0 mmol/L或葡萄糖负荷试验2 h血糖≥11.1 mmol/L,没有糖尿病典型临床症状时必须重复检测以确认诊断[10];②高脂血症:血清中总胆固醇≥6.2 mmol/L或三酰甘油≥2.3 mmol/L或LDL-C≥4.1 mmol/L[9];③高尿酸血症:男性和绝经后女性血尿酸>420 μmol/L、绝经前女性>350 μmol/L[11]。
1.2.2血浆miRNAs提取 取200 μL血浆样本置冰上融化后加入600 μL的Trizol LS(美国Invitrogen公司生产,批号:10296010),室温变性处理10 min,然后加入200 μL氯仿冰浴10 min后12 000×g离心15 min,取上层水相,加入两倍体积无水乙醇,最后使用E.Z.N.A.®Micro RNA Kit(美国Omaga Biotek公司生产,批号:R6842-01)进行miRNAs的过柱纯化[12]。
1.2.3miR-150-5p的实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,qPCR)及靶基因预测 先用E.coli Poly(A) Polymerase[美国New England Biolabs(NEB)公司生产,批号:M0276]对纯化的miRNAs进行加尾,以加尾后产物为模板按照the RevertAid First Strand cDNA Synthesis Kits(美国Thermo Scientific公司生产,批号:K1622)说明书进行反转录。以通用引物和特异引物分别作为上下游引物,按照AceQ® qPCR SYBR Green Master Mix(南京Vazyme有限公司生产,批号:R223-01)试剂盒说明书测定miRNAs表达量。以U6为内参,按公式Δct=Ct(miR) Ct(U6)计算Δct值,并用2-Δct计算miR-150-5p的相对表达水平(arbitrary units,AU)[4,12]。U6引物、通用引物和miR-150-5p的特异引物均为上海生工科技有限公司合成,其序列如下,U6正向引物:5′-CTCGC TTCGG CAGCA CAT-3′;U6反向引物:5′-AACGC TTCAC GAATT TGCGT-3′;通用引物5′-CAGTG CAGGG TCCGA GGT-3′;miR150-5p的特异引物(miR150-5p-F):5′-CTCCC AACCCC TTGTA CCAGT-3′。利用starBase对miR-150-5p的靶基因进行在线预测,并用venny2.1在线绘图软件将miRDB、targetScan和miRTarBase三个数据库预测得到的靶基因求交集,最后利用starbase的通路分析功能对共同靶基因进行信号通路富集分析[13-14]。
2 结 果
2.1两组患者的一般情况比较 两组患者的性别、年龄、血糖、血红蛋白、总蛋白、白蛋白等生化指标,以及吸烟、饮酒、合并症等比较差异均无统计学意义(P>0.05),高血压组的体重、BMI、收缩压、舒张压均高于非高血压组(P<0.01)。见表1。

表1 高血压组和非高血压组患者一般情况比较
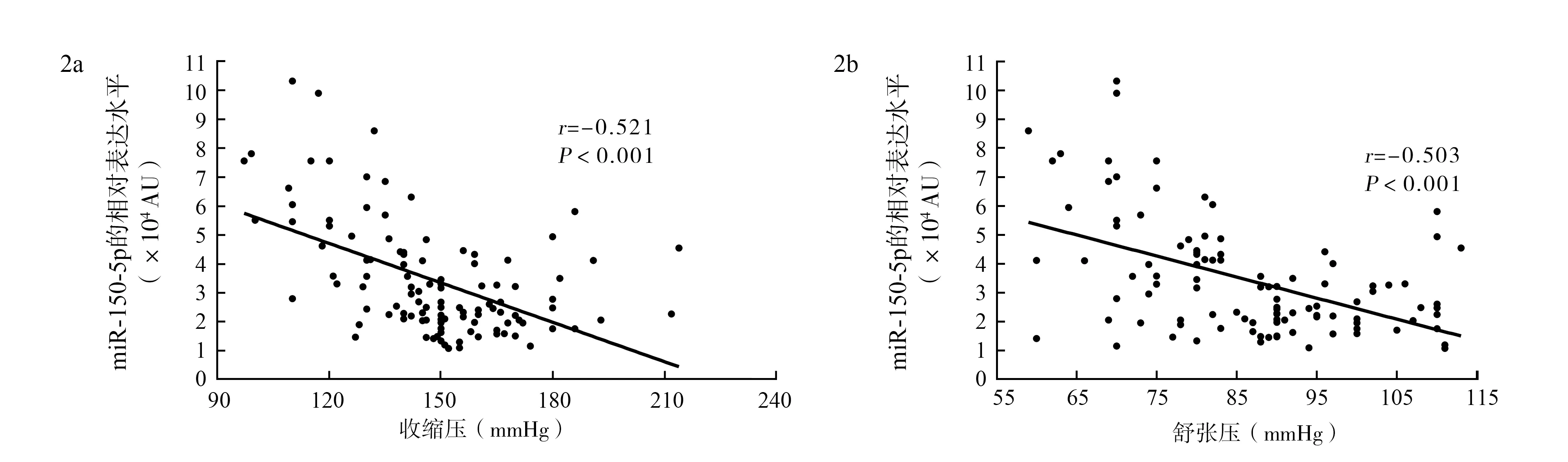
2.2miR-150-5p的表达 高血压组血浆miR-150-5p的相对表达水平为2.33(1.96,3.29)×104AU,非高血压组为5.46(3.98,7.01)×104AU,高血压组血浆miR-150-5p的相对表达水平较非高血压组降低57.33%(Z=-6.080,P<0.001,图1a)。糖尿病组与非糖尿病组血浆miR-150-5p的相对表达水平分别为3.24(2.06,4.15)×104AU和2.74(2.07,4.60)×104AU,高脂血症组与非高脂血症组分别为2.32(1.91,3.38)×104AU和3.22(2.11,4.66)×104AU,高尿酸血症与非高尿酸血症组分别为2.48(1.87,3.84)×104AU和2.80(2.09,4.56)×104AU,比较差异均无统计学意义(Z=-0.099,P=0.921;Z=-1.821,P=0.069;Z=-1.168,P=0.243)。见图1b~d。按照BMI将所有受试者分为消瘦组(BMI<18.5 kg/m2)、正常组(kg/m218.5 图1 不同疾病状态下循环血浆miR-150-5p的相对表达水平比较 2.3miR-150-5p表达与血压的相关性分析 采用Pearson积矩相关分析miR-150-5p相对表达水平与血压的关系显示,受试者血浆miR-150-5p的相对表达水平与其收缩压、舒张压均呈负相关(r=-0.521、r=-0.503,均P<0.001),见图2。 miR:微RNA;1 mmHg=0.133 kPa 2.4miR-150-5p的靶基因预测结果 生物信息学分析结果显示,miR-150-5p可能结合的靶基因有17个,分别为SP1、锌指E盒同源结合蛋白1、基质金属蛋白酶14、蛋白激酶Cα、VPS53、程序性细胞死亡因子4、EPH受体B2、核受体亚家族2 F组成员2、高尔基体SNAP受体复合物成员1、缺氧诱导的脂滴相关蛋白、锌指和含BTB结构域的蛋白7A、脂联素受体2、Cbl原癌基因、肿瘤蛋白p53、E1A结合蛋白EP300、早期生长反应蛋白2和转录因子原癌基因MYB(图3)。除参与肿瘤的发生发展外,这些靶基因也可以调控黏着斑信号通路、胰岛素信号通路、促分裂原活化的蛋白激酶信号通路、Wnt信号通路、p53信号通路、凋亡信号通路和Notch信号通路等通路,参与调节细胞分化、凋亡和血管生成等过程(图4)。 miR:微RNA SNARE:可溶性NSF附着蛋白受体;mTOR:哺乳动物雷帕霉素靶蛋白;MAPK:促分裂原活化的蛋白激酶;ERBB:酪氨酸激酶受体;miR:微RNA miRNAs是由18~22个核苷酸构成的非编码单链RNA,成熟的miRNAs主要通过与目标靶基因3′非翻译区结合,诱导其降解或抑制其翻译,参与心血管病发生发展的各个过程[15]。自2008年在肿瘤患者血浆和血清中被发现以来,循环miRNAs因其诸多优点迅速成为疾病标志物研究的热点[16]。现有研究表明,在高血压患者血浆或血清中可检测出多种miRNAs的表达改变,这些miRNAs的表达改变早于症状出现,不仅可作为潜在的高血压疾病的分子标志物,而且部分miRNAs的改变与靶器官损伤有关,可成为潜在的靶器官损伤分子标志[17]。 miR-150-5p是一种在重度心力衰竭、缺血性脑卒中等疾病的发生发展中发挥重要作用的miRNAs,循环miR-150-5p的表达水平可以作为重度心力衰竭、缺血性脑卒中的生物标志物[18-19]。Qian等[3]通过转录组学分析发现,高血压大鼠主动脉内皮细胞中的miR-150-5p表达下调,并证实miR-150-5p通过靶向调控转录因子SP1,进一步上调高血压大鼠胸主动脉中血管紧张素Ⅱ1型受体表达,介导肾素-血管紧张素系统参与高血压的发展。虽然动物实验已发现miR-150-5p基因敲除小鼠的收缩压明显增高,而升高miR-150-5p的表达水平又能够降低自发性高血压大鼠的血压[3,20],但是目前有关循环miR-150-5p表达与高血压关系的研究仍较少,且结果不一致。Karolina等[5]研究发现,高血压患者循环血液中的miR-150-5p水平较血压正常者降低;而Hijmans等[4]的研究却得出了不同的结果,虽然高血压患者循环血液中出现了多种miRNAs表达的显著改变,如miR-21、miR-126、miR-146a和miR-34a等,但是miR-150-5p的表达水平却仅稍有降低。本研究结果显示,高血压组血浆miR-150-5p的相对表达水平低于非高血压组,且其相对表达水平与血压呈负相关,提示循环miR-150-5p可能在高血压发生发展中发挥作用。对高血压引起miR-150-5p表达水平降低的机制进行研究发现,血管紧张素 Ⅱ 诱导的miR-150-5p宿主基因MIR150DNA甲基化可能是导致miR-150-5p水平下降的重要原因,应用表没食子儿茶素没食子酸酯能够减少MIR150基因的甲基化,增加miR-150-5p表达水平[21]。 miR-150-5p的目标靶基因较多,这些基因不仅可通过调节下游基因表达经多种途径参与血压调节,而且相互之间也存在复杂的调控机制。本研究结果显示,miR-150-5p可能参与SP1、锌指E盒同源结合蛋白(zinc finger E-box binding homeobox,ZEB)1、基质金属蛋白酶14、蛋白激酶Cα、VPS53、程序性细胞死亡因子4、EPH受体B2、核受体亚家族2 F组成员2、高尔基体SNAP受体复合物成员1、缺氧诱导的脂滴相关蛋白、锌指和含BTB结构域的蛋白7A、脂联素受体2、Cbl原癌基因、肿瘤蛋白p53、E1A结合蛋白EP300、早期生长反应蛋白2和转录因子原癌基因MYB基因的表达调控。其中,转录因子SP1在高血压的发生发展中发挥重要作用,研究表明转录因子SP1不仅可以通过上调神经纤毛蛋白1、神经纤毛蛋白2和血管内皮生长因子等基因的表达参与血管内皮的生成分化,还能够促进上皮细胞钠通道α亚基、血管紧张素Ⅱ1型受体等基因表达,引起肾素-血管紧张素-醛固酮系统的激活,并能参与各种刺激作用下血管平滑肌细胞的增殖、生长和分化[22-23]。同时研究还发现,ZEB2和SP1之间存在正反馈调节,SP1能够增加ZEB2的稳定性,而ZEB2又能够通过调节SP1的表达参与内皮细胞的活化、血管生成等过程[24]。研究表明,miR-150-5p可以通过靶向负调控p53信使RNA的表达,进而影响血管内皮生长因子和红细胞生成素等血管生成相关蛋白的基因表达,从而参与血管生成过程的调节[25-26]。Liu等[27]的研究发现,miR-150过表达的转基因小鼠,下游靶向基因血清应答因子表达下调,而血清应答因子可通过调节miR-1、miR-133a和miR-21的表达水平发挥心肌保护作用;此外,miR-150可通过靶向作用于信号转导及转录激活因子1保护低氧诱导的心肌细胞[28]。 综上可知,miR-150-5p可能通过多种机制参与原发性高血压的发生发展,循环血浆中miR-150-5p的表达水平与血压呈负相关,可能成为高血压疾病诊断的新型标志物。但是miR-150-5p参与血压调节的机制较复杂,尚需进一步的试验研究。


3 讨 论

