1例卡梅综合征患儿治疗的药学监护
张莎莎,余晶,葛宁,王慧
(湖北省妇幼保健院,湖北武汉 430070)
卡梅综合征(Kasabach-Merritt syndrome,KMS)是以巨大血管瘤伴血小板减少和全身出血倾向为特征的综合征,好发于新生儿及婴儿,60%发生于1个月以内,93%发生于2岁以内,是一种凝血功能障碍引起的威胁生命的消耗性疾病,预后差,病死率高达30%[1-2]。KMS发病率低,临床表现多样,不易诊断,治疗方案尚无统一定论[3-4]。笔者总结临床药师参与1例KMS患儿的药物治疗与药学监护实践,为相关疾病的治疗提供参考。
1 病例资料
患儿,女,4 d,因“发现皮肤出血点,血小板减少2 d”于2018年11月12日入院。患儿曾因“黄疸”于外院就诊时发现皮肤较多出血点,呈针尖样大小,急查血常规示血小板15.8×109/L,给予输注血小板、维生素K1预防出血、抗感染等对症支持治疗,全身皮肤未见新增出血点,但胃肠减压持续为黄绿色液体,大便潜血阳性,动态监测血常规提示血小板下降。患儿系第1胎第1产,胎龄38+6周,剖宫产娩出,出生体质量3.5 kg,出生史及家族史无特殊。
入院诊断:新生儿血小板减少性紫癜、新生儿贫血、弥散性血管内凝血(?)、腹胀原因待查、新生儿败血症(?)、新生儿高胆红素血症、新生儿脑白质软化。
入院查体:体温37.7 ℃,呼吸50次/分,脉搏146次/分,血压80/44 mm Hg,全身皮肤散在针尖样大小出血点,皮肤黄染Ⅲ°,神清,呼吸不规则,双肺呼吸音粗,未闻及啰音,心律齐。腹稍膨隆,拒按,移动性浊音可疑,肠鸣音减弱,肛门指检可见少量暗红色大便。
11月13日查体患儿左中腹似可及一包块,边界欠清。11月15日完善腹部增强CT提示十二指肠水平至中下腹近中线区肠管及周围富含血供病灶,多考虑肠系膜来源,性质待定(血管瘤?);肝门静脉增粗,血管鞘广泛积液;腹盆腔积液;脐部征象,提示脐静脉导管开放(腹腔压力增高)。患儿合并有血小板显著降低以及凝血功能异常,补充诊断:血管瘤(肠系膜来源)、卡梅综合征。
2 治疗经过
患儿入院后给予禁食、静脉营养支持、抗感染、肝素抗凝、输注血液制品、光疗综合退黄等对症支持治疗。11月15日起给予甲泼尼龙5 mg/(kg·d)冲击治疗(升高血小板)。11月16日加用普萘洛尔治疗血管瘤,起始剂量1 mg/(kg·d),后增至2 mg/(kg·d),每日分2次给药。11月17日辅助检查结果提示血小板7×109/L,血红蛋白72 g/L,红细胞2.1×1012/L,白细胞12.41×109/L,D-二聚体102.94 μg/mL,纤维蛋白原0.84 g/L,加用长春新碱0.05 mg/(kg·d),每周1次,连用4周。11月19日加用西罗莫司片0.06~0.10 mg/(kg·d)口服,动态监测西罗莫司血药浓度并调整剂量;下调甲泼尼龙剂量至1.5 mg/(kg·d),后改为醋酸泼尼松片2 mg/(kg·d)口服。11月22日加用还原型谷胱甘肽护肝。11月27日辅助检查提示肝功能受损,加用熊去氧胆酸片、丁二磺酸腺苷蛋氨酸。12月4日监测患儿血小板26×109/L,血红蛋白98 g/L,红细胞3.69×1012/L,白细胞2.87×109/L,中性粒细胞0.51×109/L,提示白细胞减低,粒细胞缺乏,给予重组人粒细胞刺激因子,暂停长春新碱化疗。12月11日复查,白细胞明显上升,肝功能较前好转,给予第 4剂长春新碱。后患儿转入母婴同室,生命体征平稳,黄疸消退,凝血功能未见明显异常,血小板无进行性下降,腹腔瘤体逐渐缩小,于12月20日带药出院。出院带药:醋酸泼尼松龙片,口服,2 mg/(kg·d),1次/日;普萘洛尔片,口服,2 mg/(kg·d),分2次;西罗莫司片,口服,0.06 mg/(kg·d),1次/日。治疗期间,该患儿血常规、凝血功能、肝肾功能等指标见表1。
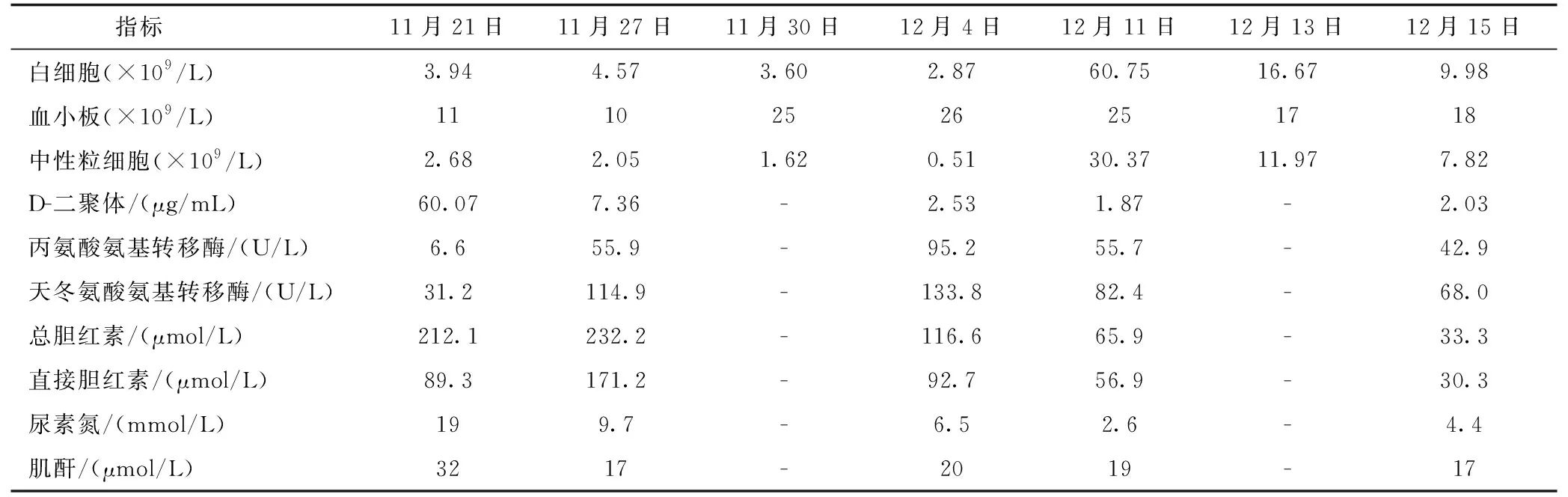
表1 患儿住院期间主要监测指标
3 讨论
3.1 药物治疗方案选择
KMS作为脉管畸形疾病的严重并发症,其瘤体具有高度的细胞增殖活性和浸润生长的肿瘤行为,有别于一般血管瘤[5]。其治疗方案包括手术治疗、介入栓塞及全身用药。该患儿血管瘤密布肠系膜,累及内脏器官,生命体征不稳定,无法手术治疗或介入栓塞,治疗方案首选全身用药控制瘤体体积。
KMS推荐的治疗药物有糖皮质激素、长春新碱、普萘洛尔、环磷酰胺、西罗莫司,其中糖皮质激素联合长春新碱为一线方案。糖皮质激素可抑制血管内皮细胞异常增殖,降低炎性反应,用于血管肿瘤的治疗,但治疗效果差异较大,近1/3患者对单独用药不敏感。长春新碱有显著促血管内皮细胞及肿瘤细胞凋亡的作用,针对激素不敏感的患儿,每周静脉应用长春新碱0.05 mg/kg,可在1~3周内产生显著疗效[2]。普萘洛尔疗效有限,常需联合其他药物。一线治疗效果不佳时,可联合使用环磷酰胺。西罗莫司可通过阻断哺乳动物雷帕霉素靶蛋白信号通路抑制包括血管内皮生长因子在内的多种细胞因子,具有抗血管增殖及促细胞凋亡自噬作用。2010年,Blatt J等[6]报道了西罗莫司成功治疗1例卡波西形血管内皮瘤伴卡梅现象的患儿,近年来其治疗复杂脉管肿瘤的效果引起广泛重视,并有很好前景[2,7]。
新生儿是处于迅速生长发育和所有脏器组织逐渐成熟的时期,肝、肾、骨髓对化疗异常敏感,使用时必须谨慎[8]。该患儿病情危重,全身多处瘀斑,多次给予血液制品输注等支持治疗,血小板仍反复降低,出血风险极高,因此在糖皮质激素联合长春新碱的一线治疗方案基础上,加用了对顽固反复的凝血功能障碍应答率高、肾毒性小的西罗莫司,住院期间动态监测患儿腹部超声,示腹腔脏器混合性肿块大小从81.7 mm × 61.7 mm × 40.5 mm缩小至62.0 mm × 44.7 mm × 30.3 mm,出院时复查腹部CT示腹部肿块较前有所缩小,肝静脉血管鞘积液较前明显减少,治疗有效。此外,西罗莫司口服给药,便于替代长春新碱序贯治疗。
3.2 药物不良反应及药学监护
该患儿发病年龄小,治疗周期长,需使用化疗药物和免疫抑制剂,临床药师重点关注了该患儿可能出现的药物不良反应,并给予药学监护。
治疗期间,常规监测该患儿血常规、凝血功能、肝肾功能等,评估药物治疗的效果,避免严重药物不良反应。该患儿治疗过程总体顺利,因疾病本身所致的肝胆门脉系统压迫和药物毒副作用,肝功能受损,给予了多种护肝药物积极治疗[9],效果显著。11月21日肾功能示尿素氮19 mmol/L,但肌酐未升高,考虑与反复使用血液制品及蛋白质大量消耗有关,完善尿常规排除肾脏因素,动态监测肾功能基本正常范围,未出现肾功能损害。12月4日血常规示白细胞减少、中性粒细胞降低,给予了重组人粒细胞刺激因子,白细胞一过性升至60.75×109/L,在评估患儿生命体征排除感染因素后,及时停用重组人粒细胞刺激因子,恢复长春新碱化疗,白细胞逐渐降至正常。该患儿凝血功能的异常以D-二聚体升高为主,该指标也呈好转趋势。
糖皮质激素的不良反应包括感染、代谢紊乱、出血倾向、血压异常、骨质疏松等,应监测身长、头围、体质量,评估患儿生长发育情况,补充钙剂和维生素D。
长春新碱不良反应包括多发性周围神经病变、腱反射消失以及腹部自主神经功能障碍等,与剂量相关,儿童耐受性较成人好。用药期间监测患儿心率、肠鸣音及腱反射。长春新碱是一种发疱剂,静脉反复注药可致血栓性静脉炎,注射时漏至血管外可造成局部组织坏死,推荐通过中央静脉导管给药,滴注过程中应避光。该患儿在治疗过程中出现脱发,临床药师梳理用药后考虑为长春新碱引起,一般是可逆性的,家属无需过分焦虑。
西罗莫司常见的不良反应包括白细胞减少、血小板减少、贫血、高脂血症、口腔黏膜溃疡、心动过速、腹痛、腹泻、肺炎等,临床试验发现其副作用有剂量/浓度依赖性,并且是可逆的[10]。治疗期间应监测是否出现高脂血症,及时进行血药浓度监测和剂量调整。
普萘洛尔常见的不良反应包括胃肠道反应、睡眠紊乱、手足发凉、低血压、心率减慢、低血糖等。首次服药后观察患儿有无肢端湿冷、精神萎靡、呼吸困难和烦躁等现象,服药期间监测血压、心率、呼吸、血糖等基本生命体征变化,如果出现心动过缓(新生儿<120次/分)或低血压(新生儿收缩压<57 mm Hg)应及时减量,直至心率压恢复到安全范围[11]。普萘洛尔应在餐间服用,以避免低血糖发生。
长期使用糖皮质激素和西罗莫司会将患者暴露于免疫抑制的风险中,住院期间对患儿实施保护性隔离,预防感染发生。此外,糖皮质激素及西罗莫司均可能影响疫苗接种的反应,患儿在服药期间停止疫苗接种。
3.3 西罗莫司血药浓度监测
西罗莫司治疗窗窄,个体差异大,需要进行血药浓度监测,指导临床合理用药,减少不良反应[12]。西罗莫司的全血谷浓度与AUC之间存在较好的相关性,推荐监测全血谷浓度,在初始治疗5~7 d后,西罗莫司的血药浓度达稳态后,于下次服药前抽血监测,目标范围为8~15 ng/mL[2]。
临床药师建议对该患儿进行西罗莫司血药浓度监测,并与临床医师一起调整给药剂量。该患儿住院期间西罗莫司初始给药剂量为0.06 mg/(kg·d),11月28日监测西罗莫司血药浓度5.73 ng/mL,低于目标范围,上调给药剂量至指南推荐量0.1 mg/(kg·d),12月5日测定结果为10.82 ng/mL,达目标治疗窗,12月12日监测血药浓度为20.21 ng/mL,下调给药剂量至0.06 mg/(kg·d),12月19日复测血药浓度稳定,未再进行剂量调整。该患儿的剂量调整依据以下公式计算:新的西罗莫司剂量=当前剂量×(目标血药浓度/当前血药浓度)。
临床药师通过查阅资料和文献,发现影响西罗莫司血药浓度的因素有:(1)肝功能状态。西罗莫司大部分在肝脏代谢,肝功能损伤可导致西罗莫司的AUC值升高,平均半衰期延长,平均清除率降低。肝功能损害患者西罗莫司的维持剂量可减少1/3~1/2。(2)药物相互作用。西罗莫司是细胞色素P-450(CYP3A4)和P-糖蛋白(P-gp)的作用底物,与其他已知能抑制或诱导CYP3A4和P-gp的药物合用可能会影响西罗莫司的代谢,从而增加或降低西罗莫司的血药浓度。(3)饮食影响。西罗莫司的吸收受食物影响,特别是高脂饮食,为减小吸收差异,西罗莫司应恒定地与或不与食物同服。结合该患儿情况,合用药物与西罗莫司不存在药物相互作用,导致血药浓度波动的原因可能与患儿肝功能状态和饮食相关。临床药师建议,固定西罗莫司给药时间,以减少喂养对西罗莫司血药浓度变异的影响,更有效地指导剂量调整。
KMS为临床罕见病,本例患儿发病年龄小,治疗过程中使用了化疗药物和免疫抑制剂,需重点关注用药安全。临床药师通过参与此例KMS患儿的药物治疗,从自身专业角度,为患儿进行个体化药学监护,为临床医护人员提供药学信息,在实践中解决临床用药问题,发挥了临床药师作用。

