经导管主动脉瓣置换术后左心室逆向重塑1例
申泽雪,李树仁,郝潇
主动脉瓣狭窄(AS)是最常见的可致左室后负荷增加、左室重构和心肌纤维化的瓣膜病[1],且随着人口老龄化进展,出现AS症状的患者越来越多[2]。过去十年中,经导管主动脉瓣置换术(TAVI)已成为老年症状性AS患者可靠和有效的替代治疗方法[3]。本文对1例重度AS患者TAVI后左室逆向重构病例进行汇报。

图1 A经胸超声心动图测量主动脉瓣跨瓣压;B术后经食道超声心动图可见瓣周漏、少量反流

图2 CT血管造影示主动脉瓣环形状并测量内径(A:主动脉瓣椭圆形瓣环;B:左室流出道平均内径25.4 mm;C:主动脉瓣呈三叶瓣,重度钙化;D:窦管交界平均内径28.6 mm;E:右冠脉开口高度17.0 mm;F:左冠脉开口高度19.5 mm)
1 病例
患者男性,74岁,主因“间断胸闷气短9年,再发并加重17 d”入院。患者近2年来反复出现胸闷气短等症状,间断发作晕厥、黑曚。既往9年前行心脏支架置入术,退行性心脏瓣膜病、主动脉瓣狭窄病史2年余;高血压病3级病史7年;慢性肾脏病3期病史2年余;类风湿关节炎病史2年余;低T3综合征病史2年余。入院查体:T 37.7℃,P 78 次/min,R 19 次/min,BP 134/65 mmHg(1 mmHg=0.133kPa)。双肺呼吸音粗,未闻及干湿性啰音,心率78 次/min,律齐,A2>P2,主动脉瓣区可闻及4/6级收缩期杂音,腹部(-)。双下肢轻度水肿。超声心动图示:冠状动脉(冠脉)支架术后,左室下后壁运动减低,主动脉内径25 mm,主动脉瓣钙化、重度狭窄伴少量反流(瓣叶数目显示不清),主动脉瓣最大压差约80 mmHg,平均压差约44 mmHg(图1A)。瓣口面积约0.6 cm2,最大流速约4.4 m/s,二尖瓣后叶瓣环钙化伴中-大量反流,三尖瓣中量反流,左房内径45 mm,左室舒张末期内径51 mm,室间隔15 mm,肺动脉压59 mmHg。左室射血分数53%。主动脉瓣及血管入路CTA联合扫描示(图2):主动脉瓣呈三叶瓣,重度钙化,瓣环平均内径26.9 mm,周长83.3 mm,面积535.6 mm2,左室流出道平均内径25.4 mm,窦部34.0×32.5×33.6 mm,窦管交界平均内径28.6 mm,升主动脉平均内径31.6 mm,左冠开口高度19.5 mm,右冠开口高度17.0 mm。左侧颈总动脉管腔轻中度狭窄;右侧颈动脉远段管腔逐渐变细,断续显影;主动脉弓、升主动脉及胸主动脉走形区管腔轻度狭窄。双侧髂总动脉、双侧髂内、外动脉走形区可见钙化斑块及混合斑块影,最窄处位于左侧髂总动脉,管腔重度狭窄。双侧股动脉及腘动脉管腔轻、中度狭窄。“冠脉支架植入术后”改变;支架内多发钙化斑块,管腔对比剂充盈尚可。前降支(LAD)中段心肌桥成。右冠脉(RCA)远段钙化斑块,管腔狭窄程度难以准确评估。左主干(LM)、LAD中段及旋支(CX)近段钙化斑块,估测管腔轻度狭窄。双侧颈动脉超声示:右侧颈内动脉中远端内径细,宽2.9 mm;右侧椎动脉管径细,宽1.4 mm,颅内段狭窄或闭塞;双侧颈总动脉、颈动脉球部狭窄率<50%;左侧颈内动脉、双侧颈外动脉狭窄率<50%。肺功能:混合型肺通气功能重度障碍,小气道功能重度减低,肺总量减低,残总比稍高,肺换气功能重度障碍。初步诊断:①冠脉粥样硬化性心脏病(冠心病) 不稳定型心绞痛;冠脉支架置入术后;心力衰竭;心功能Ⅱ级(NYHA分级);②退行性心脏瓣膜病 主动脉瓣狭窄;③高血压病3级(很高危);④慢性肾脏病3期;⑤低T3综合征;⑥类风湿关节炎;⑦慢性阻塞性肺疾病急性加重期。
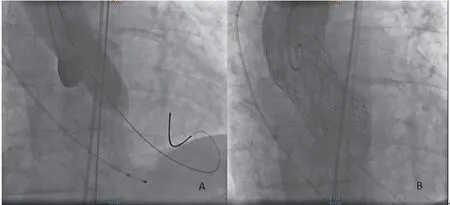
图3 术中数字减影血管造影血管造影图像(A:180 次/min快速起搏下快速充盈球囊;B:TAVR术中瓣膜完全释放,造影未见明显瓣周漏)
该老年患者为重度AS,术前心脏超声示跨主动脉瓣平均压差约44 mmHg,瓣口面积约0.6 cm2,最大流速约4.4 m/s,考虑间断胸闷气短,偶出现晕厥等症状与患者重度AS相关,预计手术后患者预期寿命超过1年,且患者存在冠心病、慢性肾脏病、慢阻肺等基础疾病,美国胸外科医师协会外科手术风险评分11%,为高危,符合TAVI绝对适应证,综合评估后行TAVI治疗。于杂交手术室进行手术,采用全身麻醉,气管插管并机械通气。据患者CTA结果,试行右侧股动脉入路,备选右颈动脉入路。行左侧颈内静脉中心静脉置管。再次行左侧颈内静脉穿刺,留置6F鞘管,送入临时起搏电极至右心尖部,连接起搏器,固定电极。于左侧股动脉置入7F鞘管,导丝引导下送入5F猪尾导管至无冠窦行升主动脉造影评估主动脉窦。外科切开游离出右侧股动脉,置入10F鞘管,导丝引导下送入5FAL2.0导管至升主动脉根部,交换为直头超滑导丝送入左心室,沿超滑导丝送入5FAL2.0导管至左心室,交换为加硬支撑导丝,退出5FAL2.0导管。装载瓣膜,体位测试球囊,稀释造影剂。沿着加硬支撑导丝送入球囊(22×40 mm)至主动脉瓣瓣环处,180 次/min快速起搏下快速充盈球囊(图3A),并同时左股动脉PIG进行造影后抽瘪球囊,停快速起搏,退出球囊。经加硬支撑导丝送入Venus-A瓣膜输送系统至主动脉瓣环处,行主动脉根部造影,调整输送鞘位置,然后固定输送鞘,120 次/min快速起搏下开始释放瓣膜。当确认瓣膜处于理想位置后,完全释放瓣膜。复查主动脉根部造影未见明显瓣周瘘(图3B),经食道超声心动图示瓣膜工作状态良好,轻微瓣周漏(图1B)。回撤左股动脉猪尾导管,经左股动脉猪尾导管行髂动脉造影术未见血管并发症,拔除右股动脉鞘管,缝合血管。拔除左股动脉鞘管,缝合器封堵左股动脉,弹力绷带加压包扎。术后转入重症监护科,苏醒后拔除气管插管,查心电图:偶发室性早搏,I度房室传导阻滞,完全性左束支传导阻滞(图4)。24 h后转入普通病房。
患者术后心衰症状及晕厥、黑曚等脑供血不足症状明显好转,术后1周出院。出院后规律复查心脏超声,超声显示患者术后出现左室逆向重构,与术前相比,室间隔厚度、左室后壁厚度均恢复至正常水平,三尖瓣反流较术前明显减轻,肺动脉压降至正常(表1)。

图4 术后心电图(偶发室性早搏,Ⅰ度房室传导阻滞,完全性左束支传导阻滞图)
2 讨论
AS通常有长时间的无症状期,而后进展为症状期。症状性AS可危及生命,而继发于AS的左室重构和心肌纤维化可在无症状期开始[1]。AS增加左室后负荷压力,导致心肌细胞代偿性肥大和胶原网络异常,进而心肌纤维化,最终导致左室肥厚[4]。左室重构导致的心肌纤维化是AS患者从代偿性肥厚向心力衰竭转变的主要组成部分[4]。据报道,AS患者的预后与后负荷消除的时间显著相关[5]。
目前TAVI被认为是不能手术、中高风险的老年AS患者的首选治疗方式[3]。TAVI可减轻AS所致的后负荷,改善急性期心功能,也可以逆转较慢过程的左室重构[1]。本例患者TAVI术后室间隔厚度、左室后壁厚度均恢复至正常水平。一致的是,近期研究均观察到在TAVI后左室逆转重构[6],且TAVI术后1年左室质量下降的患者再入院率降低50%[7]。此外,即使在TAVI术后,心肌纤维化也会增加心律失常和心源性猝死的风险[1],这表明了在高危AS患者中,TAVI消除后负荷时机的重要性。同时,AS患者发生心衰后,常伴有肺动脉压力升高,二尖瓣或三尖瓣返流增多[6]。本例患者术后三尖瓣反流程度较术前明显减轻,肺动脉压降至正常。进一步表明重度AS患者行TAVI治疗短期预后良好。
此外,本例患者新发完全性左束支传导阻滞(LBBB)、Ⅰ度房室传导阻滞,传导阻滞在转入普通病房后仍持续存在,考虑与TAVI手术相关。大量临床研究表明,主动脉瓣钙化、左室流出道以及假体植入深度与TAVI后的新发LBBB相关。若新发现LBBB,要注意延长住院时间,以确定TAVI后的节律紊乱是暂时的还是永久性的[8]。
AS患者进展到晚期增加了左室纤维化组织,降低了TAVI后左室恢复的机会。因此,评估AS严重程度,并在AS显著发展之前,经严格的血管入路等评估及多科室协作,使用适当的瓣膜和展开技术考虑TAVI,可能改善心室重构,改善患者预后。

表1 患者随访1周及1个月超声心动图指标变化

