2020年脑小血管病研究新进展
谢鸿阳,黄勇华,赵弘轶,魏微,马铁
尽管COVID-19病毒在全球大流行为世界按下了暂停键,但并未阻挡神经医学领域前进的步伐。随着老龄化社会的到来和公众生活水平的提高,脑小血管病(CSVD)逐渐成为影响人类健康的重要疾病。2020年,无论是从基础到临床,还是从机制到治疗,CSVD的研究均取得了令人鼓舞的成果。本文对过去的一年中关于CSVD的主要研究成果进行了简要总结,以期进一步加深对于CSVD的理解。
1 CSVD的血压控制:降低血压还是减少血压波动?
近年来部分研究表明,在老年人中,随着年龄增长,血压水平对中风、痴呆以及CSVD的关联逐渐减弱。但数小时、数天或者数年内的血压变化却可能明显增加相关疾病的发病风险。不少研究探索了血压变异程度与CSVD之间的关系,但很大程度受到样本量及横断面研究的影响,并未得出一致的结论。
2020年在THE American College Of Cardiology发表的了一项研究[1],采用大型前瞻性队列研究讨论了血压变异度与CSVD之间的关系。该研究作为CSVD相关的大型社区研究“鹿特丹研究”中的一部分,共纳入2348名社区老年人,进行了长达15~25年的随访。
研究按照平均每年血压变异程度进行分组,发现越大的血压变异度往往伴随着越高负荷的白质高信号、腔梗及微出血。纵向随访中,血压变异度与白质高信号进展速度呈显著正相关,但对于腔梗及微出血进展并未发现相关性(图1)。研究还进一步应用弥散张量成像(DTI)技术,探究颅内脑白质网络微结构的变化,发现血压变异越大,脑白质微结构损害越严重(图2)。
随后在2020年stroke发表的一篇荟萃分析中[2],对之前发表的研究进行了整合,也得出了相似的结论,在4年的平均随访期,发现收缩期血压变异度与颅内白质高信号的严重程度及进展速度呈显著正相关。
这些研究明确了血压变异度与老年人CSVD之间的相关性,维持血压平稳将延缓认知与运动功能障碍进展速度。

图2 SBP与白质显微结构完整性的关系
2 CSVD的精神障碍:淡漠在早期诊疗的重要性
淡漠作为CSVD重要的精神症状近年来逐渐得到越来越多关注。2020年Tay等在J Neurol Neurosurg Psychiatry发表了一项关于CSVD患者淡漠与痴呆的相关性研究[3]。
该研究共纳入了2个队列研究进行分析:①SCANS(St. George’s Cognition and Neuroimaging in Stroke)共纳入104例CSVD患者,19.8%的参与者在随访中出现了痴呆,中位时间为4.99年;②RUN DMC(Radboud University Nijmegen Diffusion Tensor and Magnetic Resonance Cohort)共纳入352例CSVD患者,10.8%的参与者在随访中出现了痴呆,中位时间为3.33年。2个队列中基线水平的淡漠程度与痴呆风险呈明显正相关,而抑郁则未见明显相关性(图3)。SCANS队列还进一步分析了淡漠评分的增加与痴呆的关联,发现在单因素对比中,两者未见明显相关性,但多因素分析中却发现了显著关联。提示淡漠评分的改变可能只对特定亚组的痴呆患者起着预测作用。
鉴于淡漠对于CSVD的重要意义,随着影像学技术不断发展,应用DTI分析淡漠的机制已成为研究热点。2020年在Progress In Neurobiology发表了一项研究[4],对血管性疾病中淡漠的脑网络机制进行了综述。其中特别对CSVD的淡漠现象进行了分析,指出无论遗传性和散发性CSVD,均可见广泛的脑白质损害,如前扣带回、胼胝体、前额叶等重要部位。这些部位的白质损害使全脑网络连接受损,尤其是关键节点的减少、局部及全局传导效率的减低,进而引起动机相关的认知障碍,导致淡漠的形成(图4)。

图3 基线水平淡漠、抑郁评分和全因痴呆的关系

图4 CSVD中淡漠相关的白质网络损害
上述研究通过2个较大的队列研究,进一步证实了淡漠与CSVD的相关性,并指出淡漠可能并非CSVD的并发症,而是其早期症状。因此淡漠的评估作为一种无创和廉价的方法,对早期识别CSVD,预测痴呆风险起着重要作用。而近年来对淡漠患者的脑白质网络研究,也为明确疾病的病理生理机制、研发有效的干预措施提供了重要依据。
3 CSVD的基因研究:大型队列研究
作为CSVD重要的研究方向,基因研究一直是近年来的热点。2020年在Nature Communications上报道了一项大型的研究[5],共纳入了CHARGE、WMH-Stroke以及UK Biobank 3项CSVD基因分析的数据,总人数42 310例,通过GWAS的方法,确定了19个独立的位点与WMH(脑白质高信号)相关,其中10个是以前未报告基因区域。同时考虑到FA及MD值可能较白质高信号更好地反映颅内白质变化情况,因此该研究对UK Biobank数据进行了进一步的分析,并确定了与FA值相关的8个独立位点(7个以前未报告的位点)和MD值相关的6个独立位点(5个以前未报告的位点)(图5)。
这项研究将CSVD相关联的基因数量增至31个,部分基因与其他血管性疾病及相关危险因素的基因相互重叠,证实了CSVD与其他血管性疾病可能有着共同的遗传学特征。同时某些基因往往与新陈代谢、免疫等因素相关,可能提示CSVD进展过程中,这些方面的遗传因素可能起着重要作用。值得注意的是,部分与DTI相关的基因位点,在既往报道中与智力、精神分裂症、自闭症、抑郁症等基因位点重叠,这代表了白质网络结构的损害在精神疾病中可能起着重要作用(图6~7)。这项遗传学研究为我们进一步理解小血管疾病的生物学机制提供了方向。

图5 CSVD患者中与WMH、FA、MD相关联基因
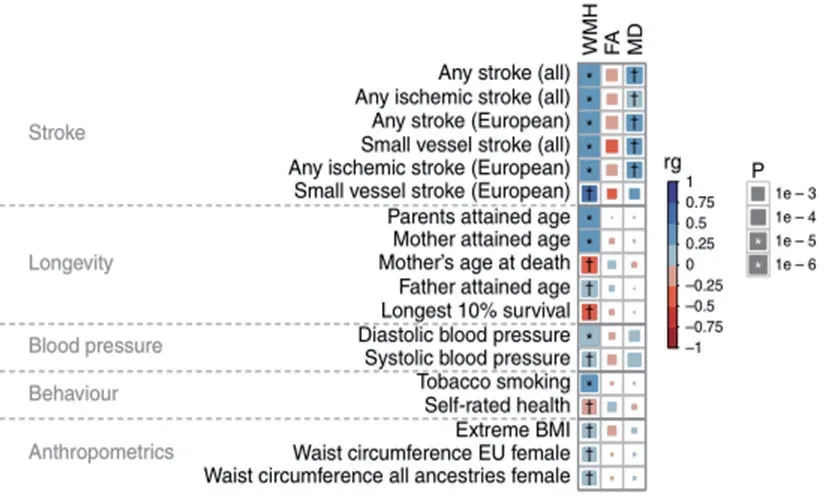
图6 WMH、FA和MD与其他疾病或特征的基因相关性(*及†表示具有显著关联)
4 单基因CSVD:欧洲诊断及治疗的专家共识
早在20多年前就有研究报道了常染色体显性遗传性脑动脉病合并皮质下梗死和白质脑病(CADASIL),随着对遗传性小血管疾病的认识不断加深,近年来又发现了更多的单基因遗传病,但关于单基因CSVD的诊断和治疗缺乏指南。
2020年欧洲神经病学年会上,为了进一步规范单基因CSVD的诊断及治疗,由欧洲神经病学学会的神经遗传学和卒中小组认可,采用Delphi法,邀请了来自欧洲CSVD领域的专家,制定了单基因CSVD诊疗的专家共识[6]。该共识主要针对CADASIL、CARASIL、HTRA1、PADMAL、FD、MELAS、(COL4)A1/2及RVCL-S等单基因遗传病进行了讨论,提出了单基因CSVD的“预警信号”,专家们在有家族史、发病年龄小、具有特定颅外或全身表现、特定的影像学特征现等方面形成了共识。其中值得注意的是,专家们认为即使在有常规血管危险因素的患者中,也不应排除单基因CSVD的诊断。讨论通过了适用所有单基因CSVD管理的一般原则,尤其强调在诊断单基因遗传病后应全面评估血管危险因素,并建议改变生活方式。除非出现了新的症状或体征,否则不必进行MRI的随访。同时针对具体单基因遗传病,专家们总结出了其特定临床表现及影像学特征,也对每种单基因遗传病从基因检测到治疗给出了个体化的建议。
欧洲专家共识的达成,为我们针对单基因遗传CSVD的诊断及治疗提供了规范化的指导意见,为临床医生提供了一个基本框架,也为今后制定指南提供了依据,但仍需进一步的多中心、大样本的研究提升证据水平。
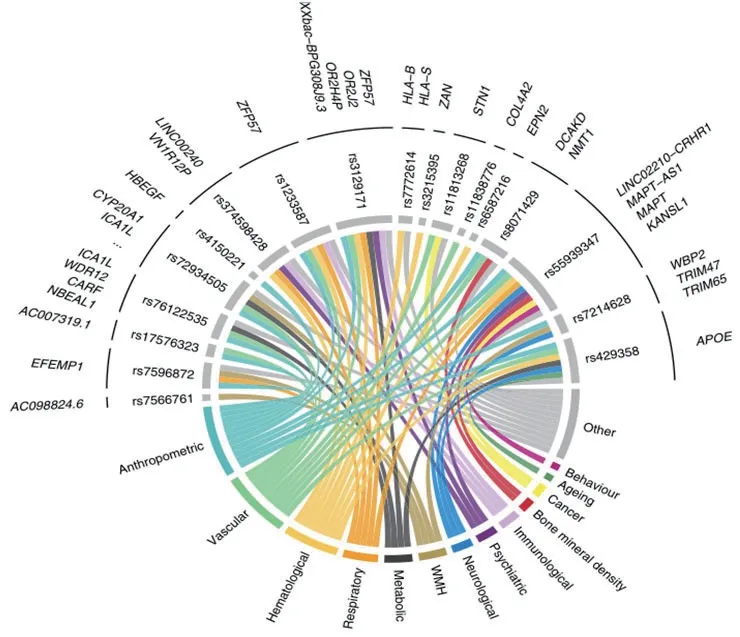
图7 WMH、FA和MD与其他疾病或特征基因位点的交叉
5 CSVD背景下:房颤患者再发卒中
近年来随着对CSVD的认识不断加深,研究者们对于CSVD患者其他疾病的发病率及严重程度愈发感兴趣,这关系到疾病的预后及临床干预时机的选择,可进一步推动相关疾病的诊疗水平。
2020年在Stroke上的一项研究报道了在CSVD背景下,房颤患者抗凝治疗后再发卒中的情况[7],该研究属于ROMIS-2队列研究的一部分,是一项多中心前瞻性研究。
研究共纳入了1419例患者,中位随访时间为2.3年,研究发现与不存在CSVD的患者比较,存在CSVD的患者更容易再发缺血性卒中事件,是对照组的2.2倍,且CSVD影像学评分越高,再发缺血性卒中的风险越高,这些结果即使调整CHA2DS2-VASC评分、性别、年龄及其他相关血管危险因素后仍然存在(图8)。
该研究证实了CSVD是房颤患者再发缺血性卒中的重要危险因素,因此对于合并CSVD患者而言,抗凝治疗的方案可能需要个体化调整,以期降低卒中再发的风险。
CSVD并非局限在颅内的疾病,更是全身性疾病,因此该研究也为CSVD患者,其他疾病的发病及进展情况的研究提供了重要思路。
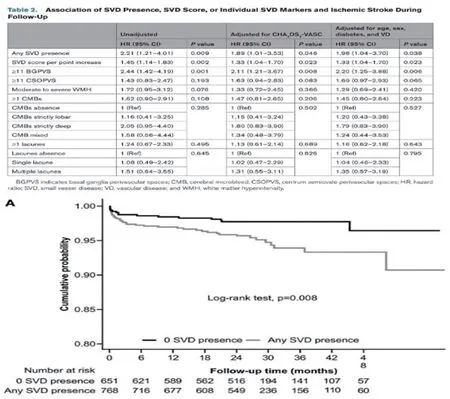
图8 随访期间是否存在CSVD、CSVD总评分或单独CSVD标志物与缺血性卒中的关系
6 CSVD的重要机制:血管内皮细胞功能异常
CSVD的发生发展机制一直是研究者们关注的热点。从维持血脑屏障的完整性到神经血管偶联的重要媒介,甚至影响细胞间相互作用,进一步影响周围的脑组织,越来越多的研究证实内皮细胞在CSVD中的重要作用。2020年在Trends In Neurosciences发表了一篇综述,就内皮细胞如何参与CSVD形成进行了阐述[8]。
文章多维度、系统地介绍了内皮细胞以及其所参与的神经胶质血管单元的结构及功能。指出血流(血管功能障碍)、血脑屏障(屏障功能障碍)以及血管壁细胞-脑细胞相互作用(细胞生物功能障碍)可能是内皮细胞功能障碍的重要原因。但在不同的组织,甚至颅内不同血管中(如小动脉和小静脉),内皮细胞功能障碍的机制可能有所不同。
随后对内皮细胞所介导的脑小血管损伤的重要分子生物学机制进行了详细介绍,包括NO水平下降、血脑屏障功能异常、异常的增殖、基质金属蛋白酶、内皮素及血管性血友病因子分泌异常等,为我们全面了解CSVD患者血管损伤提供了重要指引。
文章还指出CSVD的动物模型为我们提供了重要平台,帮助我们寻找减缓、阻止或逆转CSVD的治疗靶点,并将这些转化为有效的治疗方法。目前研究CSVD内皮细胞功能障碍常用3大类动物模型有:选择性喂养模型(高血压)、遗传模型及手术模型。并就高血压大鼠ATP11B异常;遗传模型中NOTCH3、COL4A1/A2、HTRA1基因改变等;手术模型中腹腔及脑内注射药物、双侧颈动脉狭窄等如何介导内皮细胞损害进行了简要介绍。
文章最后指出,在个别研究中,已经发现部分CSVD的特征是可逆的,且已经有药物可能减轻内皮细胞功能障碍。这将为CSVD的治疗提供重要的切入点,促使更多的药物研发及临床试验,通过内皮细胞正常化来改善脑实质异常。
7 脑微出血患者急性卒中溶栓治疗:溶栓前评估与收益
最新卒中指南提出,大于10个微出血(CMBs)是急性缺血性卒中静脉溶栓的相对禁忌症。但对于伴有CMBs的患者而言,何种情况下进行微出血的评估及溶栓后收益情况,目前尚不清楚。因伦理原因,无法对CMBs患者卒中后收益情况进行随机对照的前瞻性研究。
2020年Stroke发表了一项关于CMBs患者溶栓收益情况的研究[9]。该文章通过对已发表的相关研究中的配对数据进行分析,评估治疗前筛查CMBs的合理性,并观察高CMBs负荷的患者静脉溶栓的疗效。
研究发现高负荷患者静脉溶栓的净收益率始终低于低负荷的患者,尤其在发生严重卒中的老年患者中(年龄>80岁、NIHSS评分>15分),这一差异达到统计学意义。在低负荷患者中,溶栓净收益得分始终是正值,但随着治疗延迟时间增加而减低。对于高负荷患者而言,净收益得分可以为正也可为负,这与年龄、中风严重程度、治疗延迟时间均有关(图9)。同时该研究指出,总体而言,除非核磁共振成像(MRI)可以像电子计算机断层扫描(CT)一样快速进行,或者其他临床信息提示CMBs的数量>10,否则不建议溶栓前常规MRI评估患者微出血。

图9 静脉溶栓治疗急性缺血性卒中的疗效(蓝色为≤10CMBs;红色为>10CMBs)
8 腔隙性脑梗死的治疗:西洛他唑的临床试验
针对CSVD的治疗,目前尚无特效药物可以有效干预脑小血管的进行性损害。从常规降压、调脂、抗血小板聚集角度均无法有效的改善患者认知及运动功能损害。
近年来为了探究小血管的治疗,国内外开展了许多临床试验,尤其是西洛他唑的研究,取得了一定进展。西洛他唑是磷酸二酯酶3’抑制剂,除温和的抗血小板作用外,还具有稳定内皮,修复损伤髓鞘和协助星形胶质细胞传递能量等作用。
2020年Stroke上发表了一篇针对西洛他唑治疗卒中的荟萃分析,共纳入了19项研究[10]。检索中发现进行西洛他唑治疗卒中的临床研究主要集中在亚太地区,欧美地区较少。西洛他唑可减少卒中复发率(无论是缺血性卒中还是出血性卒中)、死亡率和心血管不良事件发生率。在中风后2周或更长时间予以西洛他唑治疗的患者,并至少维持治疗6个月或更长时间的患者中获益最大。其中3项研究探讨了CSVD的影像学标志物的改变情况,包括腔隙性脑梗死及微出血,发现服用西洛他唑可降低CSVD影像学标志物的出现率。
该研究证明西洛他唑在卒中的治疗中有积极的作用,但其中仅有2项是单纯针对腔隙性脑梗死的研究,其他研究均混杂了大血管卒中。因此为了进一步探究西洛他唑针对CSVD治疗的意义,2020年在European Stroke Journal上发表了LACI-2的临床研究方案[11]。该研究预计将纳入400例腔隙性脑梗死的患者,运用前瞻性队列探讨西洛他唑和/或单硝酸异山梨酯(ISMN)疗效,研究预计2021年底完成,期待该研究在药物有效性、安全性等方面提供有价值的数据。
9 血管周围间隙:从解剖到临床
2020年在Nature Reviews Neurology上发表了Wardlaw的一篇综述[12],通过对啮齿动物模型的基础研究,卒中、阿尔兹海默病患者的临床影像研究以及从血管周围间隙的解剖、生理、液体引流方向及驱动力的病理生理研究的叙述,揭示了血管周围间隙在CSVD患者中的重要作用。该综述为今后进一步研究血管周围间隙提供了理论基础,也为下一步治疗及干预提供了方向。
文中指出目前研究中,我们主要通过MRI标准脑区的视觉评分来半定量的评估血管周围间隙。计算基底节区或半卵圆中心可见的血管周围间隙的数量,分别记为0分(无血管周围间隙)、1分(1~10个血管周围间隙)、2分(11~20个血管周围间隙)、3分(21~40个血管周围间隙)、4分(40个以上血管周围间隙)(图10)。
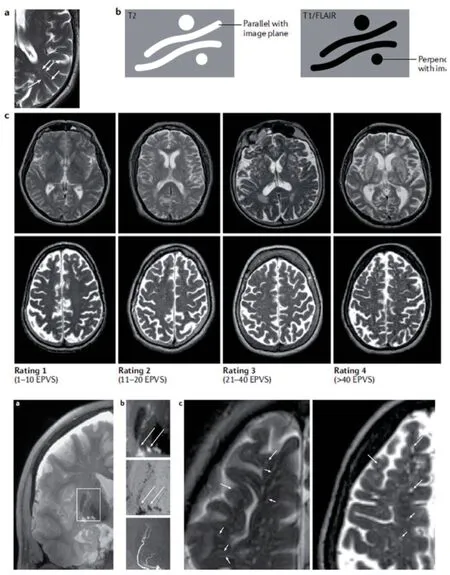
图10 血管周围间隙可视化评分
该文章指出,目前血管周围间隙主要研究进展包括:①MRI上可见的血管周围间隙随着年龄、血管危险因素(尤其是高血压)和其他小血管病的特征增加而增加。②扩张的血管周围间隙是血管周围间隙功能障碍的标志,可能是由于脑脊液代谢废物清除异常及微血管功能障碍所致。③血管周围间隙可通过标准脑区的视觉评分来半定量,近年来随着计算机技术的发展,还可通过定量的方法计算血管周围间隙的数量、体积、长度、宽度、曲度和方向等。④动物实验模型显示,血管周围间隙是摄取脑脊液、冲洗间质和清除代谢废物的重要通道,这一过程在睡眠中似乎会增加。
目前关于血管周围间隙亟需解决的问题:①间质液体(ISF)是否通过静脉周围间隙排出?如果是,排到哪里?②脑脊液和ISF一旦离开大脑,有多大比例到达硬脑膜下腔和蛛网膜下腔,有多大比例通过硬膜淋巴管或蛛网膜颗粒和绒毛引流?③如果ISF通过静脉周围间隙引流,为什么β淀粉样蛋白和其他代谢废物会聚集在动脉周围间隙?④MRI上可见的血管周围间隙是在动脉周围、静脉周围还是两者兼而有之;如果两者都有,是否有可能区分这些间隙?⑤血管搏动、呼吸运动在多大程度上促进了液体在血管周围间隙的流动?⑥水通道蛋白4是否促进脑脊液进入血管周围间隙和清除ISF?⑦血管周围间隙功能在睡眠和清醒时是否有所不同?
10 CSVD与颅内出血:CSVD的CT影像学评分及其对脑出血预后的影响
2020年Annals Of Neurology上发表了一项研究[13],该研究属于LATCH研究的一部分。LATCH是一项基于社区人群自发性脑出血的大型前瞻性队列研究。文章介绍了CSVD患者CT的评分方法:重度的脑室周围白质病变、重度的脑萎缩、2个以上的腔隙性脑梗死灶,每项各记1分,总评分为0~3分。研究共纳入了402例患者,通过1年的随访,评估患者死亡率、改良Rankin评分等,探究CSVD标志物与预后之间的关联。
该研究中脑出血患者1年的死亡率约56%,CT总评分≥1分与患者的死亡率呈显著正相关;同时还发现重度脑萎缩与死亡率明显相关,重度脑白质病变则呈边缘相关。应用CSVD的影像学标志物评估患者1年的死亡率要优于ICH评分。
脑出血患者1年后改良Rankin评分的结果发现,约73.3%的患者评分4~6分(死亡或依赖),CT总评分≥1分的患者与1年后出现死亡或依赖的情况呈显著正相关,重度的脑萎缩、重度脑白质病变也得出了相似结论。同样应用CSVD的影像学标志物评估患者1年后死亡或依赖的可能性,要优于应用ICH评分。研究还对首次出血后存活至少30 d的患者进行了单独分析,发现CT总评分≥1分及重度的脑萎缩与1年后患者死亡或依赖率呈显著正相关。
该研究通过大型队列研究证实了CSVD与脑出血预后存在显著的相关性。因此对于初次发生急性脑出血的患者,应用CT简单快速的确认颅内出血的同时,充分评价CSVD的影像学标记物是必要的。

