阿司匹林通过抑制STAT3磷酸化下调MCL-1和VEGF mRNA和蛋白表达促进胆囊癌细胞凋亡、抑制增殖
李皇保,周俊,赵凤庆,吴晓俊,闵捷
(嘉兴市第一医院/嘉兴医学院附属第一医院 肝胆外科,浙江 嘉兴 314000)
胆囊癌起病隐匿、发展迅速、预后较差[1]。虽然手术可以改善患者,但仍不理想[2]。在现有治疗方案的基础上探讨胆囊癌发展的分子机制,寻找潜在的化学治疗靶点具有重要意义。阿司匹林是非甾体抗炎药,国内外多项研究提示其可改善肝癌[3]、结直肠癌[4]、乳腺癌[5]及胰腺癌[6]的预后,可以降低胆囊癌的发病风险[7]。但是阿司匹林在胆囊癌中的具体作用机制目前国内外相关报道很少。本研究旨在通过阿司匹林干预胆囊癌细胞株GBC-SD中Janus酪氨酸激酶/信号转导和转录激活因子3(Janus kinase/signal transducer and activator of transcription 3,JAK/STAT3)信号通路中关键分子STAT3的表达水平及磷酸化水平,观察阿司匹林对胆囊癌细胞凋亡、增殖的影响,以及胆囊癌细胞凋亡、增殖与STAT3、磷酸化STAT3(pSTAT3)、髓细胞白血病因子-1(myeloid cell leukemia-1,Mcl-1)及血管内皮生长因子(vascular endothelial growth factor,VEGF)表达的关系,探讨阿司匹林对胆囊癌细胞株凋亡、增殖影响的潜在分子机制,为胆囊癌的化学治疗提供新的思路。
1 材料和方法
1.1 主要材料
GBC-SD细胞系(中科院细胞库),1640 培养基(Gibco公司),10%胎牛血清(Biowest),DMSO、噻唑蓝(MTT),阿司匹林(Sigma),0.25%胰酶-EDTA(Procell),VEGF抗体、MCL-1抗体(Sigma),STAT3抗体、磷酸化STAT3抗体(Abcam),Trizol液(Biosharp),逆转录-聚合酶链反应(RT-PCR)试剂盒(VAZYME),凋亡试剂盒(eBioScience),STAT3激动剂(Colivelin,MedChemExpress)。
1.2 细胞培养
复苏后的细胞于含10%胎牛血清的1640培养液中培养(37 ℃、5% CO2)。当细胞长满培养皿80%~90%,0.25%胰酶消化细胞,用新的培养基将细胞重悬,将细胞按适当比例传代,约2~3 d传代1次。
1.3 细胞增殖检测
MTT法。取对数生长期细胞,接种在96孔不含胎牛血清的平板中,每孔80 μL细胞悬液,细胞数1 500,并在37 ℃环境中培养24 h,然后各组分别加入空白溶剂、1 mmol/L、3 mmol/L和5 mmol/L阿司匹林溶液20 μL,在37 ℃、5% CO2、饱和湿度条件下继续培养。培养48 h后每孔加MTT贮存液10 μL,继续孵育4 h,弃细胞上清液后每孔加入10 μL的DMSO,10 min后采用全自动酶标仪检测570 nm处的各孔吸光度(A)值,5 mmol/L组未处理的细胞继续培养至72 h,弃细胞上清液后每孔加入10 μL的DMSO,10 min后采用全自动酶标仪检测570 nm处的各孔吸光度(A)值,按公式计算:细胞存活率(%)=药物组A值/对照组A值×100%。
1.4 GBC-SD细胞凋亡检测
流式细胞术。细胞培养同前,待对照组(空白对照,无阿司匹林)及实验组(阿司匹林,5 mmol/L)6孔板细胞生长至覆盖率约为70%时诱导凋亡,离心、洗涤,加入10 μL Annexin V-APC染色,室温避光10~15 min,上机检测,分析结果。
1.5 MCL-1、VEGF和STAT3的mRNA检测
Real-time PCR。根据GBC-SD细胞生长速度将其按400 000细胞每孔的细胞密度接种于6孔细胞板中,每孔接种2 mL细胞悬液,37 ℃、5% CO2培养箱,孵育过夜。处理组加入阿司匹林,对照组加入等体积无水乙醇,阿司匹林浓度为1 mmol/L、3 mmol/L、5 mmol/L,乙醇浓度为1%。细胞板放回培养箱,避光孵育6 h。结束孵育后,去除贴壁细胞上清,收集细胞置于1 mL Trizol试剂置于-80 ℃中保存。按照Trizol法提取RNA,然后逆转录成cDNA,最后PCR检测MCL-1、VEGF和STAT3 的mRNA表达,反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃1 min,40个循环。采用相对定量法(2-△△Ct法)计算mRNA的相对表达量。引物序列见表1。

表1 引物序列表
1.6 STAT3、pSTAT3、MCL-1和VEGF的蛋白检测
Western blotting。细胞培养同前。为检测阿司匹林浓度对以上蛋白的表达影响,分组设置为(A)空白对照组、阿司匹林浓度为1 mmol/L、3 mmol/L、5 mmol/L组;为检测STAT3激动剂对以上蛋白表达的影响,分组设置为(B)空白对照组、阿司匹林组(5 mmol/L)、激动剂+空白组、激动剂+阿司匹林组(5 mmol/L)。药物处理后细胞板放回培养箱,避光孵育48 h。结束孵育后,去除贴壁细胞上清,收集细胞,经细胞裂解液裂解后提取各组细胞的总蛋白,灌胶,电泳,转膜,TBST洗膜,共3次,最后显影。
1.7 统计学分析
MTT、流式细胞检测术及PCR结果使用Graph-Pad Prism软件进行统计分析及作图,各组别间的比较采用t检验(2组间比较)或单因素方差分析(3组以上比较);Western blotting结果比对电泳条带灰度,对每条条带重复测量3次,根据目标蛋白与GAPHD蛋白的相对灰度值计算P值。P<0.05表示差异有统计学意义。
2 结果
2.1 阿司匹林对GBC-SD细胞增殖的影响
48 h时空白对照、1 mmol/L、3 mmol/L和5 mmol/L 4个浓度点下各孔细胞存活率分别为(100.00±1.35)%、(95.17±3.97)%、(87.40±5.59)%、(81.42±2.55)%。结果发现,阿司匹林对GBC-SD的增殖抑制呈浓度依赖,与对照组相比差异有统计学意义(1 mmol/Lvs空白对照:t=-1.59,P=0.32;3 mmol/Lvs空白对照:t=-4.15,P<0.05;5 mmol/Lvs空白对照:t=-6.12,P<0.05;组间方差分析:F=14.68,P<0.001)。将未经处理的阿司匹林5 mmol/L组继续培养至72 h,同前处理后检测吸光度值为(37.17±0.49)%,与48 h组的阿司匹林处理组进行比较,结果证明阿司匹林对胆囊癌细胞株增殖抑制呈时间依赖,差异有统计学意义(t=29.5,P<0.001)。见图1。

图1 阿司匹林抑制GBC-SD细胞的增殖
2.2 阿司匹林对GBC-SD细胞凋亡的影响
对照组细胞凋亡比为(1.40±0.11)%,5mmol/L阿司匹林组的细胞凋亡比为(8.32±0.16)%,差异有统计学意义(t=-62.062,P<0.001),提示阿司匹林促进胆囊癌GBC-SD细胞凋亡。见图2。
2.3 阿司匹林对胆囊癌GBC-SD细胞中MCL-1、VEGF和STAT3 mRNA表达的影响
RT-PCR结果发现,阿司匹林可下调MCL-1[空白对照:1.40±0.52;1 mmol/L:1.04±0.27vs空白对照,t=-2.39,P=0.11);3 mmol/L:0.96±0.13vs空白对照,t=-3.09,P<0.05);5 mmol/L:0.81±0.57vs空白对照,t=-4.20,P<0.05)]、VEGF[空白对照:3.85±0.53;1 mmol/L:3.82±1.09vs空白对照,t=-0.04,P=0.99);3 mmol/L:2.11±0.78vs空白对照,t=-2.90,P<0.05);5 mmol/L:1.19±0.82vs空白对照,t=-4.85,P<0.05)]mRNA的相对表达,差异与对照组相比有统计学意义(MCL-1,F=6.30,P<0.05;VEGF,F=11.11,P<0.05)。与对照组相比,阿司匹林对STAT3(空白对照:1.51±0.17、1 mmol/L:1.48±0.28、3 mmol/L:1.48±0.29、5 mmol/L:1.56±0.26)mRNA的表达的影响无显著差异(F=0.03,P>0.05)。见图3。
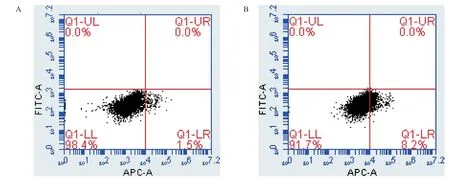
图2 流式细胞术检测阿司匹林对GBC-SD细胞凋亡的影响
2.4 阿司匹林对GBC-SD细胞中MCL-1、VEGF、STAT3和pSTAT3 蛋白表达的影响
Western blotting结果发现,阿司匹林可下调MCL-1、VEGF、pSTAT3蛋白的表达,电泳条带与对照组相比灰度均逐渐降低(MCL-1:空白对照:1.03,1 mmol/L:0.69,3 mmol/L:0.47,5 mmol/L:0.08,F=5935,P<0.05;VEGF:空白对照:1.57,1 mmol/L:1.22,3 mmol/L:0.61,5 mmol/L:0.18,F=6143,P<0.05;pSTAT3:空白对照:1.32,1 mmol/L:1.39,3 mmol/L:0.71,5 mmol/L:0.31,F=6688,P<0.05)。阿司匹林对STAT3蛋白表达的电泳条带与对照组相比灰度差异不明显(STAT3:空白对照:1.43,1 mmol/L:1.50,3 mmol/L:1.40,5 mmol/L:1.46,F=3.13,P>0.05)。见图4A。
2.5 STAT3激动剂处理后GBC-SD细胞中MCL-1、VEGF、STAT3和pSTAT3蛋白表达情况
实验条件为阿司匹林5 mmol/L,设置空白对照组、阿司匹林处理组、空白+激动剂组、阿司匹林+激动剂组。结果发现,与空白组相比,加入激动剂后MCL-1、VEGF、STAT3和pSTAT3电泳条带灰度均增加(图4B,组1vs组3,MCL-1:1.32vs1.50,t=-6.12,P<0.05;VEGF:1.09vs2.08,t=-18.3,P<0.05;STAT3:0.69vs1.77,t=-37.7,P<0.05;pSTAT3:1.51vs2.13,t=-9.41,P<0.05)。加入阿司匹林后,除STAT3(组1vs组2,0.70vs1.48,t=-57.1,P<0.05;组3vs组4,1.77vs2.27,t=3.3,P<0.05)异常外,MCL-1、VEGF和pSTAT3电泳条带灰度均降低(图4B,组1vs组2,MCL-1:1.32vs0.14,t=351.2,P<0.05;VEGF:1.09vs0.24,t=55.8,P<0.05;pSTAT3:1.51vs2.13,t=-9.41,P<0.05;组3vs组4,MCL-1:1.51vs0.37,t=34.3,P<0.05;VEGF:2.07vs0.77,t=24.4,P<0.05;pSTAT3:2.13vs0.78,t=-22.0,P<0.05)。在激动剂作用后,除STAT3变化与阿司匹林加入情况不一致外(但与激动剂加入情况一致),虽然加入阿司匹林可使MCL-1、VEGF和pSTAT3电泳条带相对灰度降低(图4B,组3vs组4,同前),但与无激动剂组相比,条带相对灰度较高(图4B,组2vs组4,MCL-1:0.14vs0.37,t=-16.9,P<0.05;VEGF:0.24vs0.77,t=-40.5,P<0.05;pSTAT3:0.33vs0.78,t=-28.3,P<0.05)。以上结果提示,阿司匹林不是通过影响STAT3 的表达,而是通过抑制STAT3 磷酸化从而下调MCL-1、VEGF的表达。

图3 阿司匹林对GBC-SD细胞中MCL-1、VEGF和STAT3 mRNA表达的影响

图4 不同浓度阿司匹林(A)及激动剂(B)对GBC-SD细胞中STAT3、pSTAT3、MCL-1和VEGF蛋白表达的影响
3 讨论
研究表明慢性炎症产生的炎症介质会引起原癌基因活化和抑癌基因失活,进而启动肿瘤进程,参与肿瘤的诱导、生长、血管生成及转移[8],同时慢性炎症也会导致核因子kappa B(NF-κB)、信号转导和转录激活因子3(STAT3)、缺氧诱导因子-1α(HIF-1α)等肿瘤相关的转录因子在肿瘤细胞中被激活,从而级联激活下游的效应分子,在肿瘤微环境中形成复杂的反应网络[9-10]。Grusz等[9]认为,阿司匹林作为非甾体类抗炎药,可能通过抑制这些与炎症和肿瘤相关的转录因子及其相关的信号通路发挥抑癌作用。已有研究证实,在胰腺癌中阿司匹林可以同时促进细胞凋亡和抑制细胞增殖[11]。在前列腺癌中,也可以通过抑制JAK-STAT3信号通路促进细胞凋亡而抑制肿瘤增殖[12];另外在前列腺癌中,阿司匹林可以通过抑制STAT3磷酸化促进前列腺癌细胞凋亡和抑制增殖[13]。虽然流行病学发现阿司匹林可降低胆囊癌发病风险[7],但是在机制研究方面目前国内外相关报道很少。本研究初步表明,阿司匹林可以抑制JAK/STAT3 信号通路中关键分子STAT3 的磷酸化,进而下调抗凋亡标记分子MCL-1和细胞增殖标记分子VEGF的表达水平,促进胆囊癌细胞凋亡,抑制增殖。
MCL-1基因是抗凋亡基因Bcl-2最主要的成员,具有Bcl-2家族基因的所有共同特征,在细胞抗凋亡中发挥广泛作用,是抗凋亡家族的标记分子和治疗靶点[14]。胆囊癌中MCL-1的表达高于正常上皮组织,与肿瘤细胞凋亡抑制相关[15]。结直肠癌[16]、乳腺癌[17]等肿瘤中也存在MCL-1基因及相应蛋白产物的高表达,与患者的不良预后、转移等呈正相关。既往研究表明,MCL-1是STAT3信号通路的下游效应分子,被STAT3激活后发挥抗凋亡作用,促进口腔鳞状细胞癌化疗耐药[18]。本研究结果提示,在胆囊癌细胞中,STAT3激动剂可上调MCL-1蛋白表达水平,阿司匹林作为抑制剂可下调MCL-1 的蛋白表达水平,证实在胆囊癌中MCL-1为STAT3信号通路的下游分子。由于阿司匹林可以通过抑制STAT3磷酸化下调MCL-1的表达,说明阿司匹林对胆囊癌细胞的抑制作用一部分是通过促进肿瘤细胞凋亡实现的。
VEGF由肿瘤细胞或基质产生,最主要的功能是促进血管生成[19],因VEGF通路激活是肿瘤增殖的基础,VEGF通常作为标记肿瘤增殖的常用参照基因[20-21]。已有研究证明VEGF在胆囊癌组织中有过度表达,并且与不良预后及转移相关[22-23]。既往的研究多数认为阿司匹林对于VEGF的影响主要是通过抑制COX-2过表达实现的[24]。然而其他研究发现阿司匹林可通过抑制JAK/STAT3通路[25]抑制结肠癌的生长,而该通路被相应的抑制剂抑制后,可导致VEGF的下调[26],但是阿司匹林是否直接通过抑制STAT3通路从而下调VEGF目前尚缺乏相关报道。本研究结果提示,STAT3 激动剂可上调VEGF蛋白表达水平,证实VEGF为STAT3 信号通路的下游分子,同时阿司匹林可以通过抑制STAT3磷酸化下调VEGF的表达,说明阿司匹林对胆囊癌细胞的抑制作用一部分是通过下调VEGF表达从而抑制细胞增殖实现的。
综上所述,MCL-1和VEGF都是炎症相关JAK/STAT3 信号通路的下游分子,而阿司匹林可以通过抑制STAT3磷酸化从而抑制STAT3信号通路的信号传递,进而下调MCL-1 和VEGF表达,促进胆囊癌细胞凋亡,抑制细胞增殖。
另外需要提及的是,虽然本研究探讨了阿司匹林对胆囊癌细胞的凋亡及增殖影响的可能机制,为胆囊癌的化学治疗提供了新的治疗依据,但仍有以下不足:(1)本研究仅使用了GBC-SD胆囊癌细胞系,未检测阿司匹林在其他胆囊癌细胞系中的作用;(2)仅限于体外研究,未在动物模型中进行体内验证;(3)由于已有较多研究提示阿司匹林通过阻断细胞周期的G0/G1期向S期的进程促进细胞凋亡[27-28],本研究未对阿司匹林对胆囊癌细胞周期的阻断时期做重复性研究;(4)在图4B中,STAT3变化趋势与是否加入阿司匹林相反,结合图4A中的结果及文献[27],考虑可能为实验误差。虽然存在以上不足,但本研究在阿司匹林对胆囊癌细胞的作用机制上做出了有意义的尝试,可以为后续研究提供参考。

