降解鸡毛真菌板蜡蚧的鉴定及产酶培养优化
刘宇星,沈 鑫,张芝元,韩燕峰,梁宗琦
(贵州大学 真菌资源研究所,贵州 贵阳 550025)
角蛋白酶是一种诱导型蛋白酶,具有广谱底物特性,能够降解可溶性蛋白以及其他不可溶性蛋白,还可通过变性、水解及转氨基作用等,将化学结构稳定的天然角蛋白的高级结构降解为氨基酸、多肽等次级结构[1-3]。角蛋白酶具有极大的综合利用价值,可广泛应用于处理各种角蛋白垃圾及废弃物,解决因其大量堆积造成的生态环境污染和自然资源浪费等社会问题[4]。此外,角蛋白酶在动物饲料加工、食品行业、医药卫生、皮革脱毛、去除污垢等诸多方面均有着重要的应用价值和开发潜力,故其研究倍受重视[5-6]。微生物可诱导角蛋白酶的生成,无论是在放线菌,或是与细菌、真菌相关的研究中均可见角蛋白酶产生菌的报道[7-11]。真菌来源的角蛋白酶较细菌来源的角蛋白酶更容易获得和纯化,其开发和研究备受关注[12]。现有资料显示,真菌是最早被发现可产生角蛋白酶且能够降解角蛋白的微生物[7],1899年,Ward 等[13]在其研究中提到:由马爪甲团囊菌(Onygenaequina(Willd.)Pers.)分离得到的角蛋白酶能够被应用于角蛋白的降解中,随后数年,全球各国学者开始了基于角蛋白降解真菌的相关研究。主要涉及皮肤类真菌,如小孢子菌属(MicrosporumGruby)[14]、节菱孢属(ArthriniumKunze)[15]和赛多孢属(ScedosporiumSacc.ex Castell.& Chalm.)[16]等;后来发现很多非皮肤类真菌也能产生角蛋白酶,如曲霉菌属(Aspergillus)P.Micheli)[17]、金孢属(ChrysosporiumCorda)[18]等。早期以角蛋白降解菌的分离和筛选,角蛋白酶的纯化和理化性质研究等为主。近年来,随着分子生物学技术的不断发展和完善,利用基因工程技术对角蛋白酶基因进行了改造,解决了野生菌株角蛋白酶纯化困难、天然角蛋白酶稳定性差的问题[5]。目前角蛋白降解菌株仍存在产酶水平低、发酵周期长、研究技术不够成熟、生产成本高[19]等问题,故需不断优化角蛋白降解菌株的产酶培养条件,以降低成本,便于工业化应用。本研究从贵州医科大学附属医院花坛土中分离得到3株角蛋白高效降解真菌,对其进行鉴定并优化其产酶条件,以期为真菌角蛋白酶的科学研究和发展应用提供理论基础与新兴真菌资源。
1 材料与方法
1.1 材料
1.1.1 菌种来源 于加入无菌鸡毛粉30 d的贵州省贵阳市云岩区贵州医科大学附属医院花坛土中分离获得3株形态一致的角蛋白降解真菌1Y2-12、1Y1-12-2和1Y1-12-3,菌株被完整保藏于贵州大学真菌资源研究所(GZAC)和中国微生物菌种保藏管理委员会普通微生物中心(编号:CGMCC 19366)。
1.1.2 培养基 ①PDA培养基:用于菌株的活化及形态描述。②加双抗和孟加拉红的PDA培养基:加入孟加拉红3.3 mL于PDA培养基中,pH自然,121 ℃灭菌 20 min。使用前,待温度冷却至40 ℃左右,加入青霉素20 μg/mg,链霉素40 μg/mg,用于分离和纯化菌株。③发酵基础培养基(g/L):鸡毛(经浸泡后多次用水冲洗,烘干后剪至3~5 mm,灭菌)5.0 g,氯化钠1.2 g,磷酸二氢钾0.5 g,磷酸氢二钾1.2 g。pH 7.0,121 ℃灭菌 20 min。用于菌株产角蛋白酶的单因素优化实验。
1.1.3 试剂与仪器 青霉素、链霉素、无水乙醇、孟加拉红、75%乙醇、丙三醇、葡萄糖、琼脂糖、蛋白胨、乳酸、K2HPO4、KCl、MgSO4、NaNO3、FeSO4、牛血清蛋白购自Sigma公司,考马斯亮蓝G250购自上海试剂公司,真菌基因组DNA提取试剂盒(北京百泰克生物技术有限公司)。高速离心机(Mikro 22R,德国Hittich);制冰机(SIM-FI24,日本SANYO);漩涡震荡仪(WORTOEX 4 digital,德国IKA);凝胶成像仪(Gel Doc XR,美国BIO-RAD);数码显微镜(Moticl 300,麦迪奥公司);电泳仪(DYY-2,北京六一);灭菌锅(YXQSG41,上海医用核子仪器厂);PCR扩增仪(PTC-100TM,美国MJ Reaserch Inc)。
1.2 方法
1.2.1 菌株形态观察与鉴定 将待测定真菌菌块接种于PDA培养基,25 ℃培养14 d,测量菌落直径并记录菌落形态。取已培养好的真菌,用透明胶带将菌落边缘的菌丝粘取下来,并以其制片。显微镜观察真菌的孢子大小、形状以及孢子结构[20-21]。参照已创建的蜡蚧属Access数据库进行形态鉴定。刮取PDA培养基上的菌丝以及孢子,按照真菌基因组DNA提取试剂盒的相关操作步骤,完成DNA提取[22],并于-20 ℃保存备用。通用引物ITS4(5′-TCCTCCGCTTATTGATATGG-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)用以扩增ITS区域,将上一步骤得到的扩增产物送昆明硕擎生物技术有限公司测序,测序序列报送GenBank(MT512658、MT512659、MT512660)。采用Clustal X 2.1、MEGA 6.0针对序列加以比对,并按照相关要求剪齐,利用RxAML软件构建最大似然树(最大似然法),经过1 000次bootstrap后,建立系统发育树。
1.2.2 孢子悬浮液与粗酶液的制备 前期预实验发现,3株菌株对鸡毛的降解效果存在差别,选用降解效果较好的菌株1Y2-12,进行单因素和正交实验优化角蛋白酶的发酵实验。1Y2-12分生孢子悬浮液的浓度配置为107个/mL,取1 mL加入250 mL的三角瓶中(瓶中装100 mL发酵基础培养基),25 ℃,120 r/min培养7 d,发酵液4 000 r/min离心5 min,快速定性滤纸过滤,经标准离心后得上清液,即粗酶液。
1.2.3 酶活力的测定 在pH 8.0条件下,将0.5 mL粗酶液和20 mg底物(鸡毛粉)置入预先准备好的9.5 mL 0.1 mol/L Tris-HCl缓冲液,120 r/min,37 ℃反应2 h,立即用冰水冷却10 min,停止反应。用滤纸过滤,滤液再经0.45 μm真空纤维微孔过滤器进行二次过滤[23-24]。以发酵基础培养基上清液为对照,测量280 nm处的吸收值。酶活力定义为在37 ℃、pH 8.0的环境条件下,水解角蛋白1 h。以0.01作为一个单位增加量,光吸收值(对照空白组)每出现一个单位的增加量,相应的酶活力为1个酶活力单位(U),前后需测量3次,取3次结果平均值[24]。酶活力(U/L)=1 000×测定所得的酶活力单位(即:0.5 mL×2 h×(OD值/0.01)×1 000)。
1.2.4 菌株1Y2-12液体发酵产酶的单因素优化 ①碳源对菌株1Y2-12产角蛋白酶活力的影响:100 mL发酵基础培养基的三角瓶中,定量添加质量分数为2%的葡萄糖、可溶性淀粉、蔗糖、乳糖,接种1 mL 1.2×107个/mL的孢子悬浮液,25 ℃,120 r/min培养7 d。以发酵基础培养基上清液作为空白对照,测定酶活力。②氮源对菌株1Y2-12产角蛋白酶活力的影响:100 mL发酵基础培养基的三角瓶中,定量加入质量分数为0.1%的蛋白胨、牛肉膏、尿素、酵母膏,接种1 mL 1.2×107个/mL的孢子悬浮液,25 ℃,120 r/min培养7 d。以发酵基础培养基上清液作为空白对照,测定酶活力。③不同无机离子对菌株1Y2-12产角蛋白酶活力的影响:100 mL发酵基础培养基的三角瓶中,定量加入质量分数为0.01%的Mn2+、Ca2+、Cu2+、Zn2+以及Fe2+,接种1 mL 1.2×107个/mL的孢子悬浮液,25 ℃,120 r/min培养7 d。以发酵基础培养基上清液作为空白对照,测定酶活力。
1.2.5 正交实验 为获得菌株1Y2-12降解鸡毛的最优发酵条件,确定各实验因素的最佳组合,再结合单因素实验的结果,以乳糖(A)、酵母膏(B)、Zn2+(C)3个因素作为影响因子,以角蛋白酶活力大小为影响值,设计正交实验,各因素水平和取值见表1。

表1 菌株1Y2-12产角蛋白酶正交实验设计
2 结果与分析
2.1 菌株鉴定
2.1.1 菌株1Y2-12形态描述 将菌株1Y2-12接种于PDA培养基,25 ℃培养14 d,菌落直径25 mm左右,颜色介于白色、淡黄色之间,偏向短绒状,中心褶皱,边缘相对规则,背面呈淡黄色。菌丝光滑,宽约0.3~1.0 μm,分隔;分生孢子梗长度不定,其上着生锥形瓶梗,大多单生,(15~45)μm×(0.5~1.0)μm;分生孢子呈侧生或顶生分布,梭形,(3.5~5.0)μm×(0.5~1.5)μm,或椭圆形、卵圆形至肾形,(1.5~3.0)μm×(1.0~1.5)μm,常聚集成团。见图1。

图1 菌株1Y2-12的菌落特征和产孢结构
2.1.2 分子鉴定 以SimplicilliumlanosoniveumCBS704.86为外群,基于蜡蚧霉属的50条序列选用的是最大似然法,结合具体要求构建系统发育树,结果见图2。蜡蚧霉属不同菌株能独立于外群较好地聚在一起,本研究分离的3株菌株1Y2-12、1Y1-12-2、1Y1-12-3和板蜡蚧(Lecanicilliumtestudineum)的菌株以100%的支持率聚为一独立的亚支。结合形态特征将其鉴定为板蜡蚧(Lecanicilliumtestudineum。)
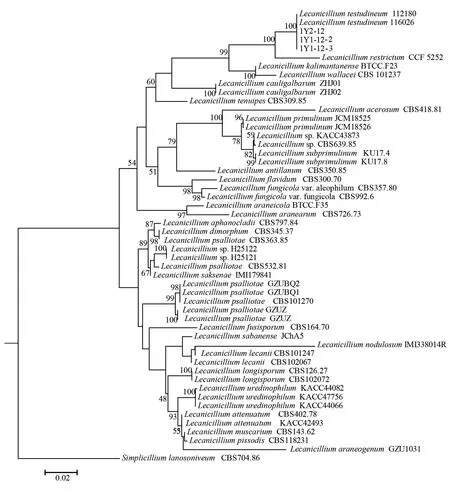
图2 3株菌株与蜡蚧属内种基于ITS-5.8S rDNA序列构建的系统发育树
2.2 高效角蛋白降解真菌液体发酵产角蛋白酶活力的单因素优化
2.2.1 碳源对菌株1Y2-12产角蛋白酶活力的影响 由图3可知,在基础发酵培养基中分别加入2%(质量分数)的4种不同碳源,得到的酶活力相较于未添加的偏高。结果表明,这些碳源均对酶活力具有促进作用。根据不同碳源对菌株酶活力的差异性分析,4种碳源对不同菌株的酶活力具有促进作用,综上文分析,将其依次排列为乳糖>蔗糖>葡萄糖>淀粉,其中,乳糖的促进作用最为明显。

图3 碳源对菌株1Y2-12产角蛋白酶活力的影响
2.2.2 氮源对菌株1Y2-12产角蛋白酶活力的影响 由图4可知,在基础发酵培养基中分别加入0.1%(质量分数)的4种氮源,所测得的酶活力均存在显著性差异;各氮源均可促进酶活力提高;根据不同氮源对菌株酶活力影响的差异分析,4种氮源对菌株酶活力影响的大小顺序为酵母膏﹥牛肉膏﹥蛋白胨﹥尿素,其中以酵母膏对角蛋白酶活力的促进作用最大。

图4 氮源对菌株1Y2-12产角蛋白酶活力的影响
2.2.3 无机离子对菌株1Y2-12产角蛋白酶活力的影响 由图5可知,分别于基础发酵培养基中添加0.01%的5种无机离子时,酶活力存在显著性差异。当添加Zn2+和Mn2+时,菌株的酶活力升高,表明Zn2+和Mn2+对酶活力均有促进作用,且Zn2+对菌株酶活力的促进作用最大。加入Ca2+时,与对照相比,促进作用不大;而加入Cu2+和Fe2+时,菌株酶活力下降,说明Cu2+和Fe2+对菌株酶活力均具有抑制作用。不同无机离子对菌株酶活力作用的差异性分析表明,5种无机离子对菌株产角蛋白酶活力作用的大小排序依次为Zn2+>Mn2+>Ca2+>Cu2+>Fe2+。Zn2+对菌株产角蛋白酶活力的影响最大。
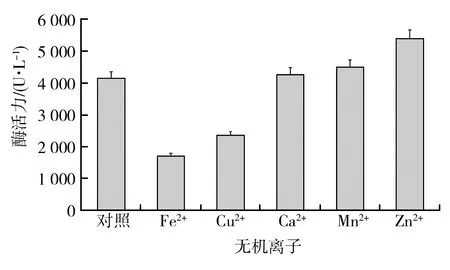
图5 无机离子对菌株1Y2-12产角蛋白酶活力的影响
2.3 正交实验结果
对菌株1Y2-12降解鸡毛的最优发酵条件进行了三因素三水平的正交实验,测定角蛋白酶活力(见表2、表3)。
从表2和表3可看出,针对酶活力的方差分析进行探究后发现,基于菌株1Y2-12产酶的影响效果由大到小为B>C>A,即酵母膏>Zn2+>乳糖,其中以酵母膏对菌株发酵产酶的影响最显著。从K值来看,菌株1Y2-12产酶最为理想的培养条件可设定为A2B3C1,正交实验得到的最佳培养条件为酵母膏0.15%,乳糖2%,Zn2+0.01%,在此条件下菌株1Y2-12酶活力为22.03 U/mL,是未优化前的2.1倍。

表2 菌株1Y2-12产角蛋白酶活力正交实验分析

表3 菌株1Y2-12发酵正交实验方差分析
3 讨 论
本研究分离筛选的3株菌株与Zhou等[25]报道的L.testudineumsp.nov.形态特征基本一致,并与2个L.testudineum序列以100%的支持率聚在一起,综合形态特征和分子系统学分析结果,将3株菌株鉴定为板蜡蚧(LecanicilliumtestudineumHubka, Kubátová, Schauflerová, Déniel & Jany),为中国新记录种。蜡蚧菌属于子囊菌纲肉座菌目蜡蚧属,现有30个种[26],可寄生多种害虫,目前主要被广泛应用于生物防治,如丝枝蜡蚧菌(L.aphanocladiiZare & W.Gams)[27]、蛀虫蜡蚧菌(L.cauligalbarumX.Zou, J.R.Zhi & Y.M.Zhou)[1]、渐狭蜡蚧菌(L.attenuatumZare & W.Gams)[28]、长孢蜡蚧菌(L.longisporum(Petch)Zare & W.Gams)[29]等均具有生防潜力。国内外学者相继报道了能降解角蛋白多个属的真菌,如发癣菌属、串胞菌属、曲霉属、金孢属、毁丝霉属、帚霉属和赛多孢属等[30]。本研究首次发现蜡蚧菌属真菌对鸡毛角蛋白具有较好的降解效果,该结果丰富了角蛋白降解真菌资源并为降解角蛋白真菌的开发提供参考。
多项研究结果表明,营养条件的差异往往会影响微生物菌株的正常生长发育。如果养分相对匮乏会直接或间接影响到菌株性状,使之呈现出不同程度的退化现象,如出现产孢量下降、菌落局变、毒力降低等反应[31-32]。角蛋白降解菌的产酶活力也受营养条件所控制,对其影响的营养因素很多,如碳氮源、无机离子等。其中,碳源是微生物生命活动的主要能量来源,是组成细胞的主要元素[33];氮源对于微生物生长和繁衍具有重大影响,是构成蛋白质的主要成分[32];无机离子一般作为辅酶成分或充当辅酶功能[34]。学者们将研究重点放于培养基组分、培养条件上,在此基础上对酶活力的影响展开研究,并基于如何优化角蛋白降解菌相应的产酶条件进行讨论[4,35-36]。周礼玮[37]设计Plackett-Burman实验与Box-Behnken优化,筛选并确定了菌株GZD-23产角蛋白酶的最佳接种量、温度和培养基组成等,在此优化条件下,该菌的酶活力提升了1.05倍。张秀江等[36]基于优化了菌株BacillussubtilisYKM05 产角蛋白酶发酵条件及培养基的相关研究,给出了最佳诱导物、碳源、氮源等参数,酶活力于优化后提高了3.5倍。朱耀霞等[38]对菌株B.subtilisFJ-3-16的发酵培养进行了单因素实验和正交实验,其酶活力大幅提高至78~100 U/mL。本研究对菌株1Y2-12降解鸡毛角蛋白的发酵培养基组成进行了优化,酶活力提高了2.1倍。此外,在不同碳源、氮源、无机离子的单因素实验中发现,以乳糖为碳源,酵母膏为氮源,Zn2+为无机离子,促进了菌株的产酶能力。这与蒋彪[39]的研究结果不太一致,他们发现当向培养基中添加硫酸锌后,菌株Bacillussp.CJPE209的酶活力反而受到强烈抑制。Mini等[40]报道,发酵培养基中添加的碳源、氮源对菌株AspergillusflavusLink S125酶活力的影响不大。Anbu等[23]也发现乳糖作为碳源时,会对短尾帚霉ScopulariopsisbrevicaulisBainier产角蛋白酶产生抑制作用。本研究中所涉及的最适碳源、氮源和无机离子与其他研究存在差异,这可能是由于不同微生物菌株的生长条件和其对添加的碳、氮源及无机离子的利用程度存在差异。
本研究发现板蜡蚧对鸡毛角蛋白同样有很好的降解效果,而对于这类昆虫病原菌,产角蛋白酶是否为该属真菌的特性还有待对该属的其他种做进一步研究。本研究仅对碳源、氮源、无机离子对菌株1Y2-12产角蛋白酶的影响进行了初步研究,而影响其产酶条件的因素很多,且各因素间存在复杂的交互作用,因此对其产酶发酵条件的研究也需要进行更多的实验。

