细菌外膜囊泡(OMV)研究进展
周舒扬,张丕奇, 戴肖东,赵晓宇
(黑龙江省科学院 微生物研究所,黑龙江 哈尔滨 150010)
20世纪60年代,研究人员在革兰阴性细菌的电子显微图像中观察到球形膜泡,当时对它的内容物、组成和用途是未知的,被认为是细胞凋亡所产生的细胞碎片[1]。1987年,Johnstone等[2]首次发现羊网状细胞分泌的囊泡,并将其命名为外泌体(exosome)。随着研究领域的不断扩展,研究人员发现在诸多生物中均产生类似exosome的囊泡,功能与exosome相似,称为外膜囊泡(outer membrane vesicles,OMV)。因此,OMV也被称为exosome。2007年,Valadi等[3]首次在OMV中发现了miRNA和RNA,显示其可能在细胞间传递遗传信息。为了揭示这一生物学现象,揭示分子之间相互作用的原理,近年来研究细胞间通讯机制成为研究热点。细胞间通讯是通过细胞间隙连接、细胞膜表面分子接触和细胞分泌的化学物质来进行的。除了这些机制外,最近的研究表明,OMV也参与细胞间通讯。研究人员也把注意力转移到OMV的研究上,OMV似乎彻底改变了细胞间通讯的传统概念。近年来,OMV 在肿瘤、感染性疾病、代谢性疾病、心血管疾病、自身免疫性疾病、神经系统疾病中的重要生物学作用逐渐成为研究热点,而细菌OMV研究还处于开始阶段。本文综述近几年关于细菌OMV的研究进展,包括OMV及其产生、OMV特定成分以及OMV的功能等,以期为细菌与宿主多种多样的互作机制研究提供参考。
1 外膜囊泡的发现
细菌OMV首次被报道发现于大肠埃希菌(Escherichiacoli),之后越来越多的革兰阴性细菌被证明可以产生和分泌OMV,如铜绿假单胞菌(Pseudomonasaeruginosa)、鼠伤寒沙门氏菌(Salmonellatyphimurium)、幽门螺杆菌(Helicobacterpylori)等[4-10]。随着对炭疽杆菌(Bacillusanthraci)、枯草芽胞杆菌(Bacillussubtilis)和金黄色葡萄球菌(Staphylococcusaureus)的深入研究,发现革兰阳性菌也可产生OMV[11-13](表1)。

表1 已报道产生OMV的细菌
细菌的OMV是闭合的大小不均的球体粒子,平均直径10~300 nm。电子显微镜(EM)观察,OMV的产生是由外膜(OM)向外凸起,包裹着周质、胞质蛋白、DNA和RNA等物质,以出芽方式形成的囊泡[14](图1)。对OMV蛋白质组的分析表明,其内部含有非母体细胞所具有的蛋白质成分,说明OMV不是细胞死亡的产物,因为其含有新合成的蛋白质[15]。
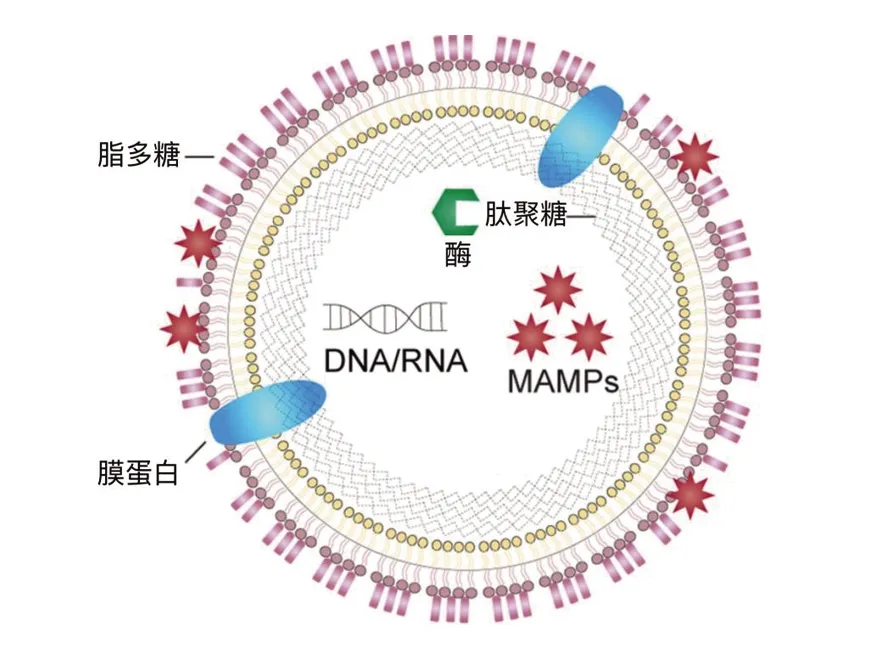
图1 OMV的结构
2 外膜囊泡的产生
根据各种生化和遗传研究,科学家们提出了几种OMV产生的模型。Burdett等[16]对OMV生物起源的研究表明,肽聚糖(PG)和外膜(OM)之间交联的减少触发了OMV的形成。由于脂蛋白(Lpp)参与了OM-PG的连锁反应,所以推测可能是由于lpp基因突变引起OMV的形成[17]。脂蛋白(Vfgl)与E.coliAIEC和E.coliK12株中OMV的产生有关,Vfgl是一种参与合成和降解PG的脂蛋白,在OMV产生过程中,vfgl可能与PG产量的增加有关,或是参与下调和维持OM膨压[18]。随着OMV数量的增加,OMV以出芽形式从OM释放,减轻了PG和胞壁酸在细胞壁合成过程中所施加给OM的压力。虽然生化研究显示OMV和OM具有相似的蛋白结构,但胞质分子是如何被包装进入OMV的尚不清楚。
Mashburn等[19]提出,通过磷脂、脂多糖(LPS)和其他特定分子富集在OM上,使得OM的曲率发生变化从而产生OMV。对铜绿假单胞菌(Pseudomonasaeruginosa)的研究揭示了群体感应(quorum sensing)分子PQS(2-heptyl-3-hydroxy-4-quinolone)插入膜后所带来的膜曲率变化,从而产生OMV[20]。通过添加螯合剂(EDTA)可以观察到OMV产量的增加,但是向铜绿假单胞菌添加Mg2+会导致拮抗作用[21]。相反,OM蛋白如OmpA、TolA/B(toll-pal)、YbgF和Lppab,也有助于OMV的生物发生[22]。此外,高温胁迫、抗生素等也会增加OMV的产生。
3 细菌外膜囊泡的成分
对OMV成分的分析表明,囊泡含有多种活性因子,这些活性因子包括蛋白黏附素、毒素、酶以及脂多糖(LPS)等非蛋白抗原。纯化的OMV与原核细胞和真核细胞相互作用,显示出毒力因子的传递能力。此外,OMV中含有病原体相关分子模式(MAMPs)和其他外膜成分,这些成分可以影响感染过程和宿主对感染的反应。通过密度梯度离心法纯化OMV分析其组分,鉴定了OMV的成分信息,包括蛋白质、脂质和核酸等。
3.1 蛋白质
OMV的研究揭示了大量的OM蛋白(OmpA、OmpC和OmpF)、周质蛋白(AcrA、碱性磷酸酶)和一系列毒力因子参与了细菌对宿主的黏附和侵染。随着蛋白质组学分析技术的发展,已鉴定3 500多种与OMV相关的蛋白质[23]。当细菌在不同的环境条件下生长时,囊泡的产生速率和OMV的蛋白质含量会发生变化,这暗示特定蛋白质有选择地进入OMV[24]。在粘质沙雷氏菌(Serratiamarcescens)中,外膜蛋白(OMPs)、孔蛋白(porin)和外膜通道蛋白(TolC)等大量蛋白存在于OM上,而在OMV中未被检测到。在粘质沙雷氏菌中,OMV检测到外膜蛋白MipA,但在OM中却没有检测到[25]。痢疾杆菌(Dysenterybacillus)通过促进OMV的产生而促进其志贺毒素的分泌[26]。在OMV中导入或排除特定蛋白质的机制尚不明确,目前是研究的热点[27-29]。为引起疾病而选择性分泌的蛋白质,以及为细菌健康而选择性去除的蛋白质之间的区别,解决这些问题将是解释各种细菌OMV蛋白质组学数据的关键挑战。
3.2 脂质
脂质是细菌OMV的重要结构成分。Horstman等[30]报道大肠埃希菌OMV以甘油磷脂、磷脂酰甘油、磷脂酰乙醇胺和心磷脂为主要脂质,这些脂质与OMV的曲度有关。Chowdhury等[31]在对紫丁香进行质谱(MS)分析时发现磷脂酰甘油和磷脂酰乙醇胺是OMV中主要的脂质成分。同样,其他研究也发现磷脂酰甘油是OMV的主要成分,但也发现磷脂酰乙醇胺是OM的主要成分。此外,OMV中较高比例的饱和脂肪酸使其结构更加稳定。LPS在生物膜中起黏附作用,同时也是OMV的组成部分。与蛋白质类似,OMV中只存在少量的亲本LPS[32]。
3.3 核酸
外膜囊泡既携带腔内DNA,也携带表面DNA,二者之间的区别在于用DNA酶处理之后,腔内 DNA仍然具有抗性。与此同时,从大肠埃希菌、淋球菌(Neisseriagonorrhoeae)、铜绿假单胞菌和流感嗜血杆菌(Haemophilusinfluenza)中发现了几种不同形式的腔内 DNA。除了DNA,OMV还包含miRNA、mRNA和其他非编码RNA。自首次在动物体内OMV中发现含有RNA以来,人们对使用OMV中RNA作为诊断生物标志物的研究产生了极大的兴趣。Skog等[33]发现,胶质母细胞瘤患者的血清中OMV含有可用于提供诊断信息的特征性突变mRNA(EGFRvIII mRNA)和miRNA。这些核酸的发现让研究人员提出了OMV可以在细胞间传递遗传信息的假设。事实上,Valadi等[33]和Skog等[34]均发现OMV中含有mRNA,可以在进入宿主细胞后被转移和翻译。逆转录转座子和其他非编码RNA在OMV中也有报道[35-36]。这些发现强调了OMV作为遗传信息载体和传递者的重要性[37-38],但核酸进入OMV的机制尚不清楚。
4 外膜囊泡的功能
外膜囊泡(OMV)具有介导DNA片段、自溶酶、细胞毒素、毒力因子和多种生物分子转移的特性。OMV的分泌有助于细菌种间和种内的信息交流,也加强了与宿主的相互作用。OMV在多种生理和病理功能中发挥着重要作用。
4.1 OMV免疫调节功能
OMV的组成使其成为激活宿主先天和获得性免疫应答通路的重要因子。除了强大的免疫调节分子LPS外,囊泡还含有OM孔蛋白和其他重要的先天免疫激活配体。总之,OMV 成分协同作用,调节宿主的反应,既可以促进病原体的清除,也可以增强感染的毒性,或是两者兼有。此外,OMV的免疫原性可导致保护性黏膜和全身杀菌抗体反应,已被用于疫苗开发。目前所有实验证据表明,对OMV的先天免疫反应是由细菌相关分子模式(PAMPs)和对LPS的识别共同作用的结果。囊泡中的脂蛋白和OM蛋白是一种生物活性分子,可以激活免疫细胞并诱导白细胞迁移[39]。
OMV中最丰富、最有效的免疫刺激成分是脂多糖(LPS)。LPS可激活巨噬细胞、内皮细胞等引起炎症因子的释放,导致宿主的损伤乃至败血症休克。许多研究已经表明toll样受体4(TLR4)复合物直接将LPS的刺激信号向细胞内传递,从而触发宿主炎症反应导致细菌感染[40]。OMV作为LPS的载体,可以通过激活炎症反应而引起宿主组织损伤。许多关于TLR4介导的LPS的研究都使用化学方法提纯LPS,很可能是由于LPS以OMV的形式从细菌中分泌,OMV是一种异质的蛋白质脂质体,其尺寸比由LPS组成的脂质体大[41],这些性质可能影响先天免疫应答的效力。TLR4对LPS的介导需要从膜中提取LPS,主要是通过辅助蛋白如CD14、LPS结合蛋白(LBP)或通透性蛋白(BPI)等来提取的。虽然这些因子清除细菌膜上的LPS或将LPS传递给TLR4的机制尚不清楚,但研究已确定OMV既是脂多糖激活炎症的关键因子,又是诱导炎症的诱饵,结合这些可溶性因子抑制炎症。Vesy等[42]发现沙门氏菌(Salmonellasp.)OMV中的LPS是通过LBP提取的,而不是通过CD14等其他因素。缺失LBP抑制了LPS与细胞表面TLR4-CD14复合物的结合。纯化的LPS和OMV中的LPS不仅在刺激先天免疫反应的能力上不同,而且在宿主组织内的分配和清除也可能不同。这对于将纯LPS注入动物模型内研究尤为重要。OMV作为异质的蛋白质具有亲水性结构,使得更多的OMV通过各组织更快地与宿主膜结合,相比之下,纯脂多糖可能表现出更多的疏水性。这些特性也可能导致OMV更容易被吞噬细胞识别和清除。
4.2 OMV的分泌促进了细菌感染过程
OMV分泌的一个特征是能够协同地将多个效应分子同时传递到目标位点。铜绿假单胞菌释放带有毒力因子的OMV,保护性地将毒力因子移动到宿主细胞膜的目标位置,在那里囊泡与宿主细胞膜融合,将毒力因子运送到细胞质[43]中。这一现象在某种程度上类似于某些植物病原菌Ⅲ型分泌系统(T3SS)将效应物直接有效地输送到宿主细胞质中(图2)[44]。与T3SS系统相比,OMV有可能向宿主细胞质提供更大、更多样的因子,而不需要直接接近细菌和宿主细胞。
虽然OMV与植物细胞的融合尚未被证实,但OMV在对植物的细菌毒性方面发挥着作用。木质部难养菌(Xylellafastidiosa)通过产生和感知扩散信号因子(DSF)来进行群体感应、诱导聚集、表面附着和生物膜的形成。Ionesco等[45]的研究表明,缺乏DSF如ΔrpfF突变体,产生大量游离形式的OMV。研究人员认为OMV是一种抗黏附因子,参与调节细菌从生物膜形态向自由游离形态转变,在木质部分散并促进毒性。OMV分泌途径也被发现可作为Ⅱ型分泌(T2SS)系统[46]分泌胞外酶的替代途径。OMV[47]蛋白组学分析发现,如脂肪酶、蛋白酶和细胞壁修饰蛋白酶等可作为损伤相关分子模式(DAMPs)的来源,被模式识别受体(PRRs)识别。事实上,通过T2SS系统分泌的酶和OMV内含的酶似乎有重叠。木聚糖酶是一种植物细胞壁降解酶,其由T2SS系统和OMV分泌到细胞外对木质部难养菌的毒力有重要作用。其他毒性因子也采取同样的途径。例如,在木质部难养菌中T2SS系统分泌的一种脂肪酶LesA被包装进OMV,从而促进了疾病的传播[48]。与T2SS相比,将LesA和木聚糖酶包装进入OMV可以保护蛋白质免受细胞外环境的影响,从而扩大有效的活性范围,并允许同时靶向和协同传递[49]。对T3SS分泌的效应蛋白及植物病原菌OMV中转运相关蛋白的研究表明,OMV也可能是T3SS系统的替代途径,或与之协同作用。
因此,OMV可促进细菌近端和远端毒力因子的传递。了解OMV的传递机制以及OMV的产生与其他细菌分泌系统的相互作用,将有助于阐明细菌是如何影响细胞外环境的。
5 展 望
综上所述,不同于细菌I-IX分泌系统,OMV介导毒力因子、黏附分子、毒素和其他免疫调节化合物的转移,构成了一个独立的分泌系统,促进细菌对不同宿主的黏附和定殖。此外,OMV在营养获取、细胞间通讯、防御和宿主的免疫调节等过程中的贡献引起了科学界的极大兴趣。
OMV作为抗原复合物与天然佐剂已经成功应用到疫苗中。通过设计高效的脂质体纳米载体(siRNA、microRNA和蛋白质),意在实现药物靶向性传递,在特定条件下促进药物的释放,以实现药物更好的靶向性,增加药物的吸收[50]。除了动物病原细菌外,其他微生物如植物病原细菌、真菌以及共生菌,如根瘤菌等互利微生物也可能分泌OMV[51]。细菌OMV是否能进入植物细胞或是否有植物胞质受体检测到OMV尚不清楚。植物细胞壁的存在是否阻止了OMV与植物细胞质膜的融合,OMV诱导的免疫反应与直接由细菌引起的免疫反应有何不同,OMV在发病机制和共生中的作用是什么,这些挑战植物微生物相互作用领域的问题都有待研究人员一一解开。并且随着科研的不断深入,预计在不远的将来,外泌体的研究将在疾病治疗药物、疫苗生产研发、动植物营养调节剂开发等领域展现巨大潜力。