红细胞分布宽度联合毛细血管渗漏指数对脓毒症并发急性呼吸窘迫综合征的预后评估价值
查佳安 方长太 陈园园
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是呼吸系统严重疾病,表现为顽固的低氧血症,它的发病率为0.1%~0.86%,死亡率为40%~60%[1]。为更好地治疗ARDS,临床上需要更方便的预测因子来帮助做出病情评估。ARDS的病理生理改变是严重的氧化应激损伤,红细胞分布宽度(Red blood cell distribution width ,RDW)作为循环红细胞大小变异的定量指标,它的高低能够反映炎症和氧化受损程度[2]。毛细血管渗漏指数(capillay leakage index,CLI)是一种评估毛细血管通透性的指标,Ylmaz等[3]证实其在胰腺炎早期诊断及预后中有预测价值,其他学者[4-5]发现其在肺癌、胰十二指肠切除术后瘘疾病中的评估作用。本研究回顾性分析我院收治的脓毒症并发ARDS患者,探讨RDW联合CLI指标在脓毒症致ARDS预后评估价值。
资料与方法
一、研究对象
1 回顾性收集 2017年10月~2019年12月收住我院急诊科以及重症监护病房的脓毒症患者。入选患者符合《拯救脓毒症运动:脓毒症与脓毒性休克治疗国际指南(2016版)》中的诊断标准。参照2012年柏林标准,评估患者入院时是否发展至ARDS,住院时间超过24小时者,纳入研究。
2 排除标准 1)手术外伤者;2)入院24 h内死亡者;3)肿瘤以及有基础心、肝、肾功能障碍者;4)有基础慢性阻塞性肺疾病者;5)严重贫血者;6)诊断不明确、预测因素丢失的患者。
二、方法
1 收集患者的资料 1)年龄、性别、原发感染疾病;2)入院24小时内白蛋白、CRP、RDW、氧合指数值;3)急性生理与慢性健康评分Ⅱ(APACHEⅡ)、序贯性器官功能衰竭评分(SOFA评分);4)计算CLI:CRP/白蛋白(c-reactive protein/albumin ratio)。除生存情况以外的其他数据均取患者收住或转入病房24小时内的最差值。
2 记录患者转归 分为28天存活组和死亡组。
三、统计学方法

结 果
一、一般资料
最终纳入76例患者,其中死亡组患者45例,存活组患者31例,2组间性别、SOFA评分差异无统计学意义(P>0.05)。死亡组年龄、RDW、CLI、APACHEⅡ评分均高于存活组(P=0.002;P=0.031;P=0.041;P=0.005),死亡组氧合指数低于存活组(P=0.048),差异有统计学意义(见表1)。
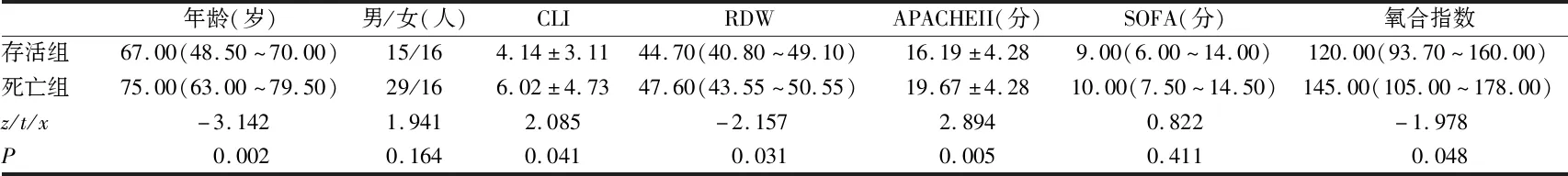
表1 两组患者一般临床资料、RDW、CLI、氧合指数、APACHEⅡ评分、SOFA评分比较
二、脓毒症并发ARDS患者RDW与APACHEⅡ评分、氧合指数的相关性分析
对患者的RDW与APACHEⅡ评分、氧合指数进行Spearman相关分析,结果显示RDW与APACHEⅡ评分呈显著正相关(rs=0.314,P<0.001),RDW与氧合指数呈显著负相关(rs=-0.720,P<0.001)(见表2)。

表2 脓毒症并发ARDS患者RDW与APACHEⅡ评分、氧合指数的相关性分析
三、ROC曲线分析 RDW、CLI、APACHEⅡ及联合变量(RDW+CLI)对脓毒症并发ARDS患者预后的影响(见表3、图1)。

表3 RDW、CLI、APACHEⅡ及联合变量(RDW+CLI)对脓毒症并发ARDS患者预后的预测价值

图1 RDW、CLI、APACHEⅡ及联合变量(RDW+CLI)对ARDS患者死亡风险ROC曲线
讨 论
ARDS是炎症反应在肺内的过度表达[6]。炎症抑制骨髓增生,并抑制红细胞成熟,大量网织红细胞提前入血后导致RDW增加[7]。除炎症外,ARDS患者还存在氧化应激损伤,Ghaffari[8]研究发现,ARDS死亡患者血浆中次黄嘌呤水平升高,黄嘌呤氧化酶及其底物增加氧化应激,氧化应激破坏红细胞,导致贫血的同时,幼稚红细胞增产并释放入外周循环血。死亡组理论上存在更严重的炎症反应和氧化应激,其RDW值会更高,本研究证实了RDW值在ARDS死亡组较存活组有升高,差异有统计学意义。为了更进一步了解RDW的评估价值,本研究选取了柏林标准共识中的能够反映疾病严重度的APACHEⅡ评分和氧合指数两个参数,分别分析RDW与每种参数的相关性。在分析相关性之前,本研究对比了存活组和死亡组的APACHEⅡ评分和氧合指数这两项指标,死亡组的APACHEⅡ评分较存活组偏高,差异具有显著统计学意义,相反的,死亡组的氧合指数较存活组偏低,差异具有统计学意义,这也符合全球共识,确实代表ARDS疾病的严重度。Spearman相关分析结果显示RDW与APACHEⅡ 评分呈正相关,RDW与氧合指数呈负相关,均具有显著统计学意义,提示RDW在脓毒症并发ARDS患者疾病预后中具有评估价值,进一步的ROC曲线分析示AUC值为0.646,稍低于经典的APACHEⅡ评分,截断值为46.55,提示临床上出现RDW>46.55时,临床医师需要更多的关注患者的炎症程度以及氧化应激水平。
患者感染后血浆中会出现一种急性蛋白,即为CRP,2小时内会快速的升高,48小时内达到高峰,它可以与病原体结合,有利于吞噬细胞识别和吞噬。同时,诱导产生补体参与免疫应答,为了更多的参与免疫反应,血液内CRP会成倍地增长,炎症后期患者营养消耗后,肝脏合成减少,CRP会逐渐下降[9]。脓毒症并发ARDS患者全身炎症反应可引起肺毛细血管渗漏,血清白蛋白漏至肺间质以及肺泡内,低蛋白血症是危重患者发生急性肺损伤并导致不良预后的独立危险因素[10],白蛋白联合呋塞米脱水治疗可以改善 ARDS 患者的氧合情况,促进液体平衡以及血流动力学稳定[11]。考虑到这两种指标数值呈负向分离,学者们提出CRP与血清白蛋白比值的概念,并发现与单项CRP或者白蛋白相比,能更准确反映毛细血管渗漏情况,在危重患者中起到早期预警作用,并可作为脓毒症90天死亡的独立危险因素[12]。学者们发现其在急性冠脉综合征、溃疡性结肠炎、肿瘤[13-14]等疾病中能够反映炎症程度。但在脓毒症并发ARDS患者中治疗应用报道比较少。本研究统计了此项比值,显示存活组与死亡组的差异具有统计学意义,进一步的ROC曲线分析示AUC值为0.601,以CLI>5.87为28 d死亡预测界点时,敏感性为53.3%,特异性为77.4%。
脓毒症并发ARDS患者死亡率高,反映预后的指标最好是简单易得,价格低廉。鉴于本研究中RDW、CLI联合变量的ROC曲线分析AUC值高于单项APACHEⅡ评分,建议临床医师可以联合应用RDW与CLI这两种指标对脓毒症并发ARDS患者作出病情评估。本研究只截取了患者入院24小时内RDW、CLI最差值,目的在于了解初始RDW、CLI与预后的关系,而不是评估治疗变化带来的影响。至于针对此两项指标治疗所带来的影响是什么,仍需要更大样本做进一步的前瞻研究。

