负载雷公藤甲素的TPGS-b-(PCL-ran-PGA)纳米制剂体外抑制宫颈癌细胞生长的研究
郑义, 郑静薇, 周煜玲, 梁欣, 包君丽, 杨菊红, 曾凡杞*
1.中国科学院大学深圳医院医学实验中心, 广东 深圳 518106;2.吉林大学临床医学院, 长春 220100
宫颈癌在全球妇女的发病率仅次于乳腺癌。据统计,全球每年约有57万宫颈癌新发病例,占所有癌症新发病例的5%,其中80%的病例来自发展中国家[1-2]。我国宫颈癌每年新增发病例数超过13万,占世界新发病例的28.8%[3],我国每年有2万妇女死于宫颈癌,且其发病呈年轻化态势[4]。目前,宫颈癌的治疗主要以手术切除、放化疗为主,但疗效有限,易复发;新型免疫治疗,如抗体靶向治疗(如抗CTLA4抗体、PD-1抗体或PD-L1抗体)和过继细胞治疗(adoptive cell therapy, ACT)已在临床上应用,但疗效不理想[5-6]。故研究新的宫颈癌治疗药物和方法仍非常必要和迫切。
雷公藤甲素(triptolide,TPL),又称雷公藤内酯、雷公藤内酯醇,是传统中药雷公藤的主要活性成分之一。雷公藤甲素含有独特的化学结构和生物活性,不溶于水,溶于二甲基亚砜、三氯甲烷、丙酮、乙醇等有机溶剂。研究表明TPL具有抗肿瘤、抗炎、抗老年性痴呆、抗生育和免疫抑制活性等[7-8],是广泛用于临床的中药单体。但雷公藤甲素能产生严重的不良反应,如胃肠道毒性、肝脏毒性、血液毒性、心脏毒性、泌尿系统毒性、男性和女性生殖系统功能异常、免疫系统毒性等,这些毒副作用呈现剂量依赖[7-8]。因此,为了推广雷公藤甲素在临床上的使用,需要对雷公藤甲素减毒增效,一般有两种方法:①对TP的结构进行修饰,雷公藤甲素被改造成水溶性的新药明尼甲素能更有效地抑制胰腺癌细胞生长[9];②对雷公藤甲素的剂型进行改造,如采用纳米技术,制备负载雷公藤甲素纳米粒,达到减毒增效的目的[10-11]。
基于纳米载体的药物传递系统,特别是纳米粒,在药物传递领域已产生巨大进步,因为载药纳米粒具有游离型药物的比较优势,包括靶向能力,能加强在肿瘤部位药物的累积,克服因胞内药物传递的耐受,实现可控和持续性释放,以加强药物的生物依从性,也能改变游离型药物动力学和毒性。我们之前利用聚ε-己内酯(PCL)、含有PEG链的聚乙二醇1000维生素E琥珀酸酯(TPGS)和聚乙醇酸 (PGA)首次成功合成了TPGS-b-(PCL-ran-PGA)生物可降解材料[12],并以其作为载体负载紫杉醇、伊曲康唑和siRNA等小分子化合物[12-14]。
本研究以TPGS-b-(PCL-ran-PGA)为载体,制备包载雷公藤甲素的纳米粒(TPGS-b-(PCL-ran-PGA)/TPL),研究载有雷公藤甲素的纳米粒的表征,包括粒径大小、表面zeta电位、包封率、累积释放率等,并研究TPGS-b-(PCL-ran-PGA)/TPL对宫颈癌细胞HeLa的体外抑制和凋亡的影响,以期为治疗宫颈癌药物的研究提供参考。
1 材料和方法
1.1 主要试剂
本研究中生物可降解材料TPGS-b-(PCL-ran-PGA)按照Huang等[12]的方法合成,最后的产品通过热重分析、液体核磁共振波谱仪等鉴定表征,证明是成功的;聚乙烯醇(PVA)购自德国Fluka公司;二氯甲烷(分析纯)购自上海化学试剂有限公司;外消旋丙交酯(rac-LA)购置于山东代罡生物有限公司,HeLa细胞本实验室保存,DMEM培养基和胎牛血清(FBS)购自Gibco公司。
1.2 主要仪器
超声波匀质仪(UH 500A,天津奥特赛斯仪器有限公司);光学显微镜(Olympas BHA,日本);低温高速离心机(Avanti J-25,Beckman 美国);液体核磁共振波普仪(INOVA500,美国);红外光谱仪(Therl TIO Nicrolet 1510,美国);紫外可见全波长扫描仪(SpectraMax 384 Plus 美国分子仪器);热重分析(TGA,TGA 2050热重分析仪,美国);低温冷冻真空干燥机(LABCONCO公司,美国);粒径及电位分析仪(zeta PALS Brookhaven Instruments CO,美国)。
1.3 纳米粒的制备
1.3.1TPGS-b-(PCL-ran-PGA)共聚物的合成和表征 准确称取 7.5 g 己内酯单体、1.5 g 外消旋丙交酯单体、1 g 维生素E TPGS 为原料,取原料质量0.1%的催化剂辛酸亚锡催化剂加入聚合管中,进行抽真空脱气和氮气置换过程,重复3次,将聚合管封口,于145℃油浴加热下进行开环聚合反应。聚合反应16 h后,产物经冷却溶于二氯甲烷中,并加入过量甲醇使共聚物沉淀。过滤除去甲醇未反应的单体和 Vitamin E TPGS。将所得沉淀于45 ℃真空干燥48 h即得聚合产物TPGS-b-(PCL-ran-PGA)共聚物。利用质谱仪、热降解曲线和傅立叶变换红外光谱等仪器设备对 TPGS-b-(PCL-ran-PGA)共聚物进行表征[12]。
1.3.2TPGS-b-(PCL-ran-PGA)/TPL纳米粒的制备和表征 采用修正的超声乳化/溶剂挥发法制备成负载TPL的TPGS-b-(PCL-ran-PGA)纳米粒。简要地说,一定量的雷公藤甲素和100 mg TPGS-b-(PCL-ran-PGA)共聚物完全溶解于8 mL二氯甲烷(DCM)。将形成的溶液转入搅拌的120 mL含0.03%(质量体积分数)TGPS溶液中,同时采用25 W超声120 s,形成水包油乳状液。将乳液在减压条件下挥发过夜,去除其中的有机溶剂后,20 000 r·min-1离心15 min,清洗3遍去除空载药物和表面活性剂。将产生的颗粒再悬浮在10 mL的去离子水中,冷冻干燥2 d。用相同方法制备TPGS-b-(PCL-ran-PGA) 空纳米粒和TPGS-b-(PCL-ran-PGA)/香豆素-6纳米粒。我们对TPGS-b-(PCL-ran-PGA)与TPL之间的比例(200∶1,100∶1,150∶1,20∶1)进行了优化。
1.4 纳米粒的鉴定
1.4.1纳米粒的粒径大小、zeta电位和形态学检测 空TPGS-b-(PCL-ran-PGA)和TPGS-b-(PCL-ran-PGA)/TPL纳米粒用去离子水(pH 7.0)分散。TPGS-b-(PCL-ran-PGA)/TPL纳米粒的粒径大小和zeta电位用动态光散射检测仪(nanobrook omni, brookhaven instrument corp, USA)检测。所有测试在室温下3管平行检测。纳米粒的形态检测用透射电子显微镜(TEM, JEOL JEM-1230, Japan)检测。
1.4.2载药量和包封率 TPGS-b-(PCL-ran-PGA)/TPL纳米粒的包封率和载药量用Agilent 1050 HPLC (agilent technologies, Palo Alto, CA, USA)分析。在25°C用1个C18柱(250 mm×4.6 mm, 5 μm, agilent technologies, USA)分析。甲醇:水(58∶42,体积分数)作为TPL的流动相,流速为1 mL·min-1。检测波长为218 nm。根据下列公式计算纳米粒的包封率(encapsulation efficiency,EE)和载药量(drug loading, DL)。EE(%)=纳米粒中药物量/加入的药物量×100%,DL(%)=纳米粒中载药量/纳米粒的量×100%。
1.4.3体外药物释放 从TPGS-b-(PCL-ran-PGA)/TPL纳米粒TPL的累积释放动力学在pH 7.4的磷酸盐缓冲液(PBS)中确定。等量的TPGS-b-(PCL-ran-PGA)/TPL纳米粒悬浮在PBS,用有盖的玻璃瓶分离,在37 ℃孵育箱孵育,以120频次·min-1晃动。在预定的时间点(0.5、1、2、4、6、8、10、12、14 d),通过离心(14 000 r·min-1, 15 min)分离纳米粒,用HPLC检测上清3个小瓶中TPL的累积量,测量TPL的累积释放量。
1.5 细胞培养
1.5.1体外细胞摄取 HeLa细胞单层培养在含10%胎牛血清(FBS)DMEM中,37 ℃和湿化的5% CO2培养箱。
用荧光显微镜分析HeLa细胞对纳米粒的摄取。 5×104细胞·孔-1接种在12孔细胞培养板,孵育24 h。培养液中用游离的香豆素-6(coumarin 6,C6)或负载C6的纳米粒(相当于培养物中含有0.5 μmol·L-1C6)孵育5、30和60 min,用预温的D-PBS洗2次,然后用胰酶消化,用预冷的D-PBS洗涤。最后,细胞重悬在500 μL冰冷的D-PBS中,放在冰上暗室中10 min。样本用荧光显微镜观察。
1.5.2MTS实验 为了体外评估不同浓度的TPGS-b-(PCL-ran-PGA)空纳米粒、TPGS-b-(PCL-ran-PGA)/TPL纳米粒以及TPL的细胞毒性,以6×103HeLa细胞·孔-1接种在96孔板,细胞孵育24 h,加入不同浓度TPGS-b-(PCL-ran-PGA)空纳米粒、TPGS-b-(PCL-ran-PGA)/TPL纳米粒以及TPL[与TPGS-b-(PCL-ran-PGA)/TPL纳米粒中TPL等量],继续孵育72 h,除去生长培养基,加入100 μL含20% MTS和1% phenazine methosulfate (PMS)的无血清培养基孵育1 h。在490 nm检测吸光度。未处理细胞的细胞活性定义为100%,含有培养基但没有活细胞的吸光度视为0。用Prism 软件(san diego,CA)分析IC50值。每个实验至少做3次。
1.5.3克隆形成实验 克隆形成实验用于确定TPGS-b-(PCL-ran-PGA)/TPL纳米粒是否能抑制宫颈癌细胞。1×103细胞接种在6孔板中。在第3天,用不同浓度的TPL或对应的含等量TPL的TPGS-b-(PCL-ran-PGA)/TPL纳米粒处理细胞,继续孵育4 d。然后,用新鲜培养基替换,维持7 d。细胞用冰冷的甲醇和乙酸(3∶1,体积分数)混合物固定15 min。然后,用0.5%结晶紫染色。观察克隆形成情况并拍照。计算百分克隆形成数,百分克隆形成数=实验组克隆数/对照组克隆数×100%,以对照组为100。
1.5.4凋亡实验 用Annexin V-FITC凋亡检测试剂盒做凋亡实验,操作严格按照试剂盒说明书(南京凯基生物科技有限公司)进行。以5×104HeLa细胞接种在24孔板中,孵育24 h,然后用空纳米粒TPGS-b-(PCL-ran-PGA)、TPL(4.5 nmol·L-1)和含TPL等量的TPGS-b-(PCL-ran-PGA)/TPL纳米粒处理细胞48 h。之后用预冷的PBS洗涤2次,胰酶消化,离心后,再用预冷的PBS重悬细胞。500 μL悬液中加入Annexin V FITC 5和10 μL PI溶液,在暗室冰上孵育10 min。立即用流式细胞仪分析。测试用3个复孔。
1.6 统计分析
统计采用GraphPad Prism分析软件(La Jolla, CA)。数据用均值±标准差表示。用单向或双向ANOVA确定统计学意义,之后用Tukey’s检验,当P<0.05时视为具有统计学差异。
2 结果与分析
2.1 负载TPL的TPGS-b-(PCL-ran-PGA)纳米粒的制备和表征
2.1.1粒径大小、ζ电位和形态学特征 TPGS-b-(PCL-ran-PGA)/TPL纳米粒球形,呈单分散(图1)。电镜观察到的纳米粒大小为84 nm左右(图2),小于用DLS检测的结果,DLS检测的纳米粒大小为95 nm,这主要由于准备TEM样品过程中纳米粒脱水收缩导致的。TPGS-b-(PCL-ran-PGA)/TPL纳米粒的ζ电位为-12.2 mV(图3)。
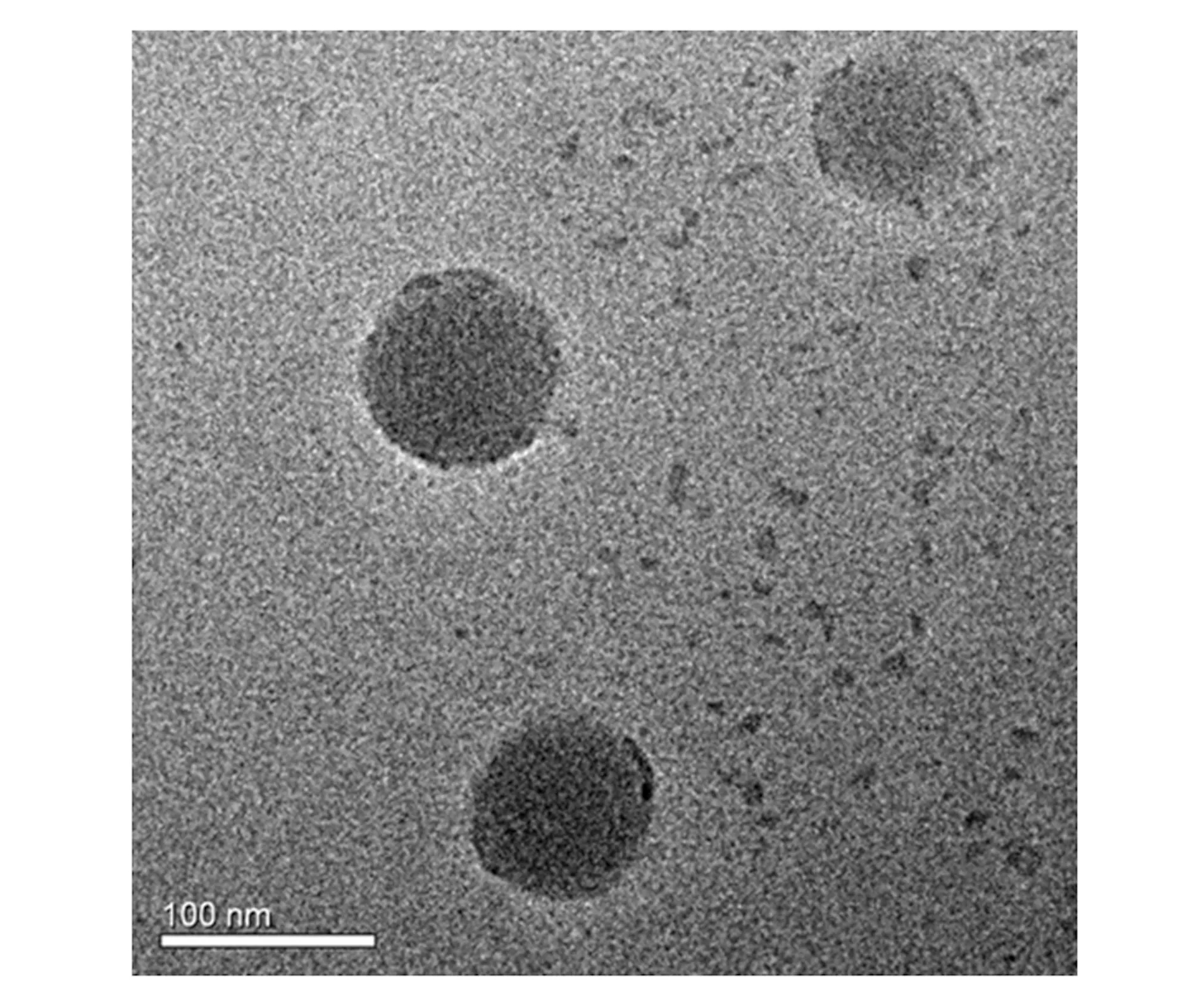
图1 包载TPL的TPGS-b-(PCL-ran-PGA)纳米粒的透描电镜图Fig.1 TEM images of TPL loaded-TPGS-b-(PCL-ran-PGA) nanoparticles
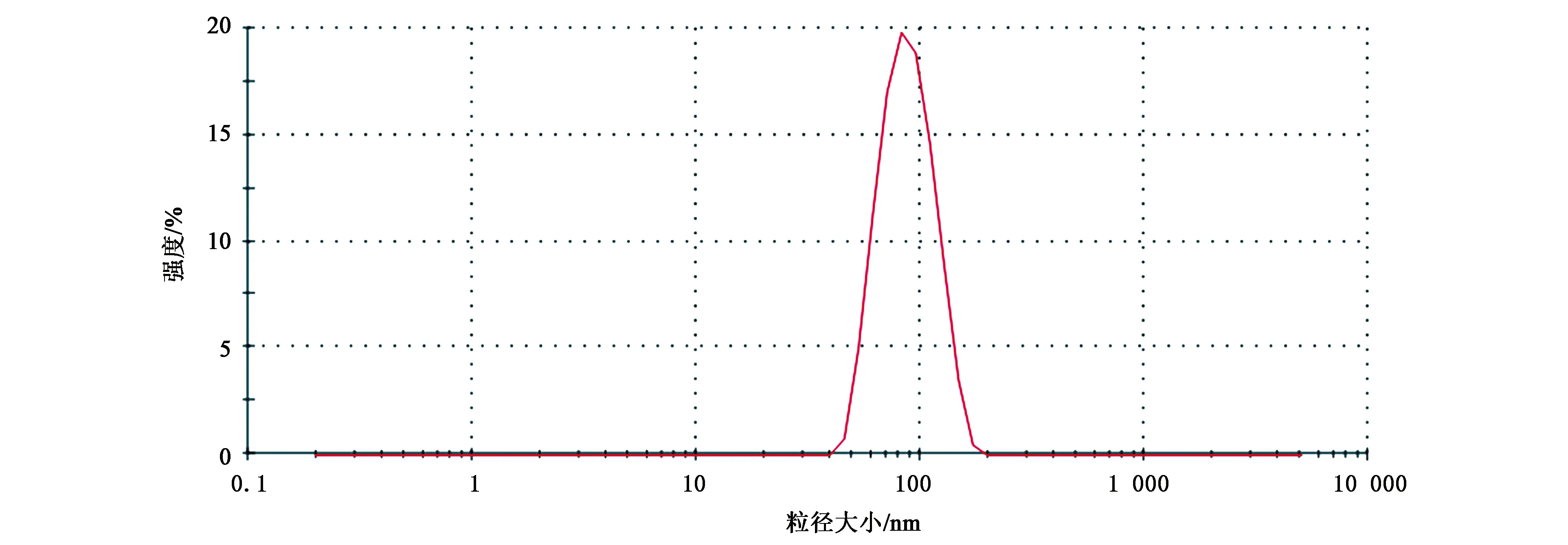
图2 包载TPL的TPGS-b-(PCL-ran-PGA)纳米粒的粒径大小分布Fig.2 Size distribution of TPGS-b-(PCL-ran-PGA)/TPL nanoparticles by intensity
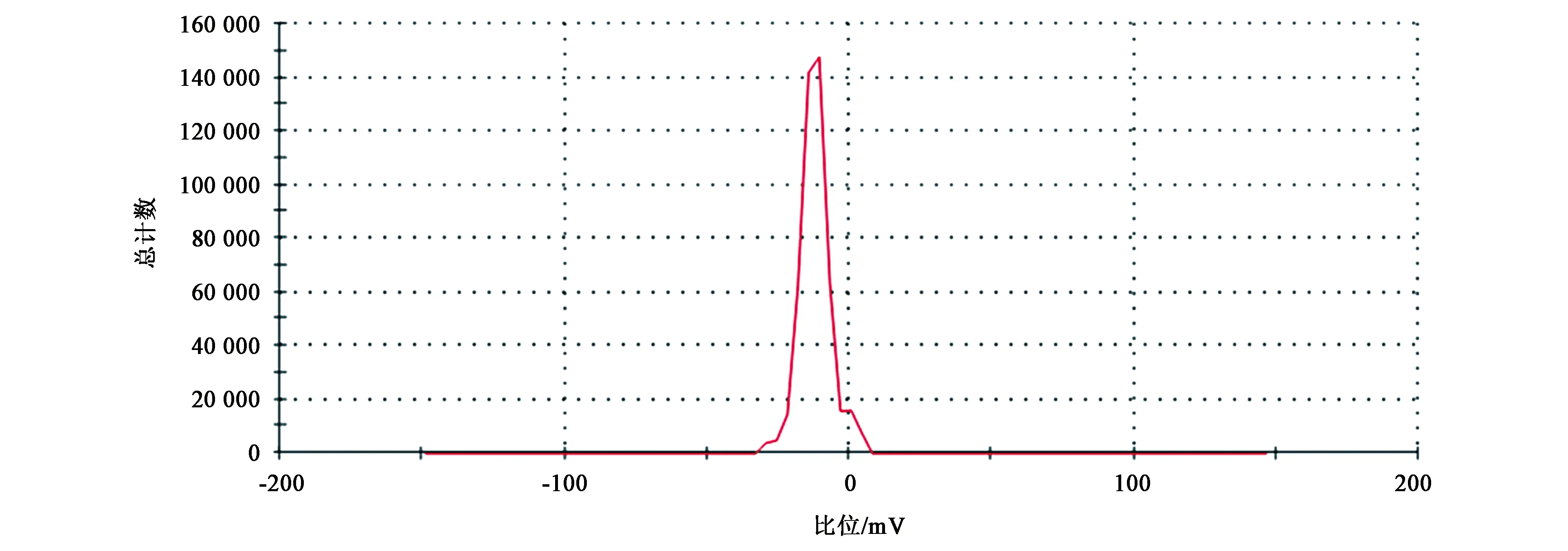
图3 包载TPL的TPGS-b-(PCL-ran-PGA)纳米粒的zeta电位Fig.3 Zeta potential of TPGS-b-(PCL-ran-PGA)/TPL nanoparticles
2.1.2载药能力和包封率 载药量(drug loading capacity, DL)和包封效率(encapsulation efficiency, EE)在药物传递中起重要作用。为了获得较高的载药量和满足治疗需要,我们对载体TPGS-b-(PCL-ran-PGA)和TPL比例进行了优化,其中载体与TPL比例为50∶1,有较为满意的DL,为(50.2±4.3) μg·mg-1,EE为72.6%±2.5%(表1)。后续的实验均以比例为1∶50制备TPGS-b-(PCL-ran-PGA)/TPL纳米粒。
2.1.3体外药物释放 来自TPGS-b-(PCL-ran-PGA)/TPL纳米粒累积TPL释放在pH 7.4被研究,pH 7.4相当于正常细胞的生理pH。如图4所示,在pH 7.4缓冲液中,从纳米粒的TPL逐渐释放,表示在纳米粒中药物的包封在血浆中可以显著延长释放。体外释放实验表明纳米粒药物累积释放呈双相释放,早期(1~48 h)释放较快,在24 h累积释放达到56.3%,在7 d内累积释放达到71.5%。
2.2 体外细胞摄取
为了研究细胞对纳米粒的摄取,负载C6纳米粒加到培养了24 h的HeLa细胞培养物中,1 d后观察。TPGS-b-(PCL-ran-PGA)/C6被细胞有效摄取,纳米粒主要分布在胞浆和核外周(图5),表明包封在纳米粒的药物能有效被细胞摄取,使药物在胞内释放。纳米粒内化进入细胞被视为一个结合(吸附)过程,并通过内吞方式进行。
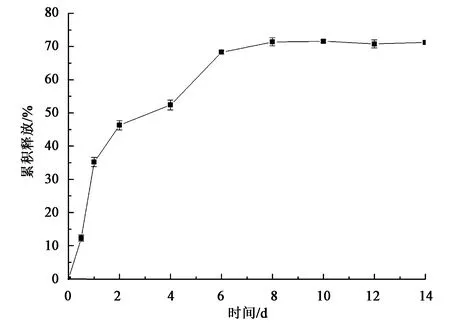
图4 TPGS-b-(PCL-ran-PGA)/TPL纳米粒累积TPL释放Fig.4 Accumulative TPL release of TPGS-b-(PCL-ran-PGA)/TPL nanoparticles
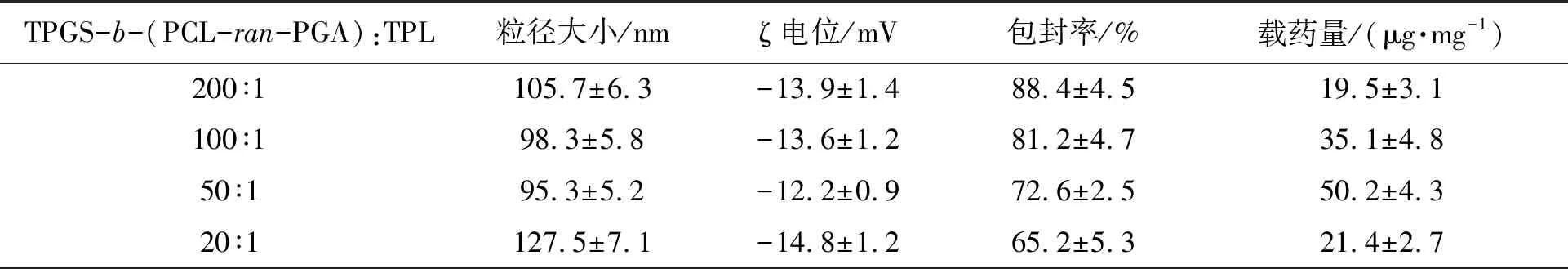
表1 TPGS-b-(PCL-ran-PGA)与TPL不同比例制备的纳米粒的粒径大小、ζ电位和包封率和载药量的比较Table 1 Comparison of particle size, zeta potential, encapsulation efficiency and drug loading of nanoparticles composed of different ratio between TPGS-b-(PCL-ran-PGA) and TPL
2.3 TPGS-b-(PCL-ran-PGA)/TPL纳米粒的细胞毒性
为了研究TPGS-b-(PCL-ran-PGA)/TPL纳米粒对HeLa细胞的生长抑制,我们用MTS实验比较游离型TPL和TPGS-b-(PCL-ran-PGA)/TPL的抑制浓度值(IC50)。结果表明游离型TPL和纳米粒释放的TPL均能以剂量依赖的方式减少Hela细胞的增殖。但是,于24、48和72 h,纳米粒的IC50远低于游离型的TPL,证明同剂量TPL的纳米粒较游离型对肿瘤细胞生长的抑制更显著。因此,本研究结果表明当TPL被纳米化后具有减毒增效的作用(表2)。
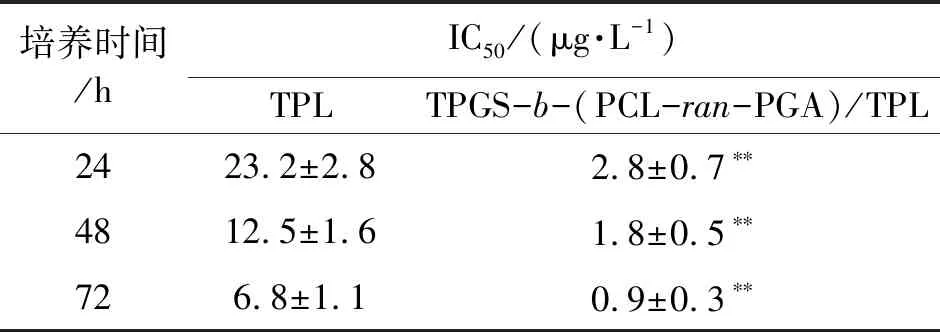
表2 TPL和TPGS-b-(PCL-ran-PGA)/TPL纳米粒对HeLa细胞的毒性分析Table 2 Toxicity analysis of TPL and TPGS-b-(PCL-ran-PGA)/TPL nanoparticles on HeLa cells
2.4 克隆形成的抑制作用
克隆形成实验是基于单个细胞生长成一个克隆的体外细胞存活实验。克隆形成实验主要是通过细胞生长抑制确定TPL和TPGS-b-(PCL-ran-PGA)/TPL纳米粒的抗癌活性。在本研究中,未被处理的细胞产生大量的克隆,而TPL和TPGS-b-(PCL-ran-PGA)/TPL纳米粒显示剂量依赖的克隆形成抑制。其中TPGS-b-(PCL-ran-PGA)/TPL与等量的TPL比较,抑制能力更强,显著减少了克隆形成(P<0.01)。总之,与等量的游离型TPL比较,纳米粒中的TPL能快速内化和持续释放,有望显著提高抗癌效应(图6)。
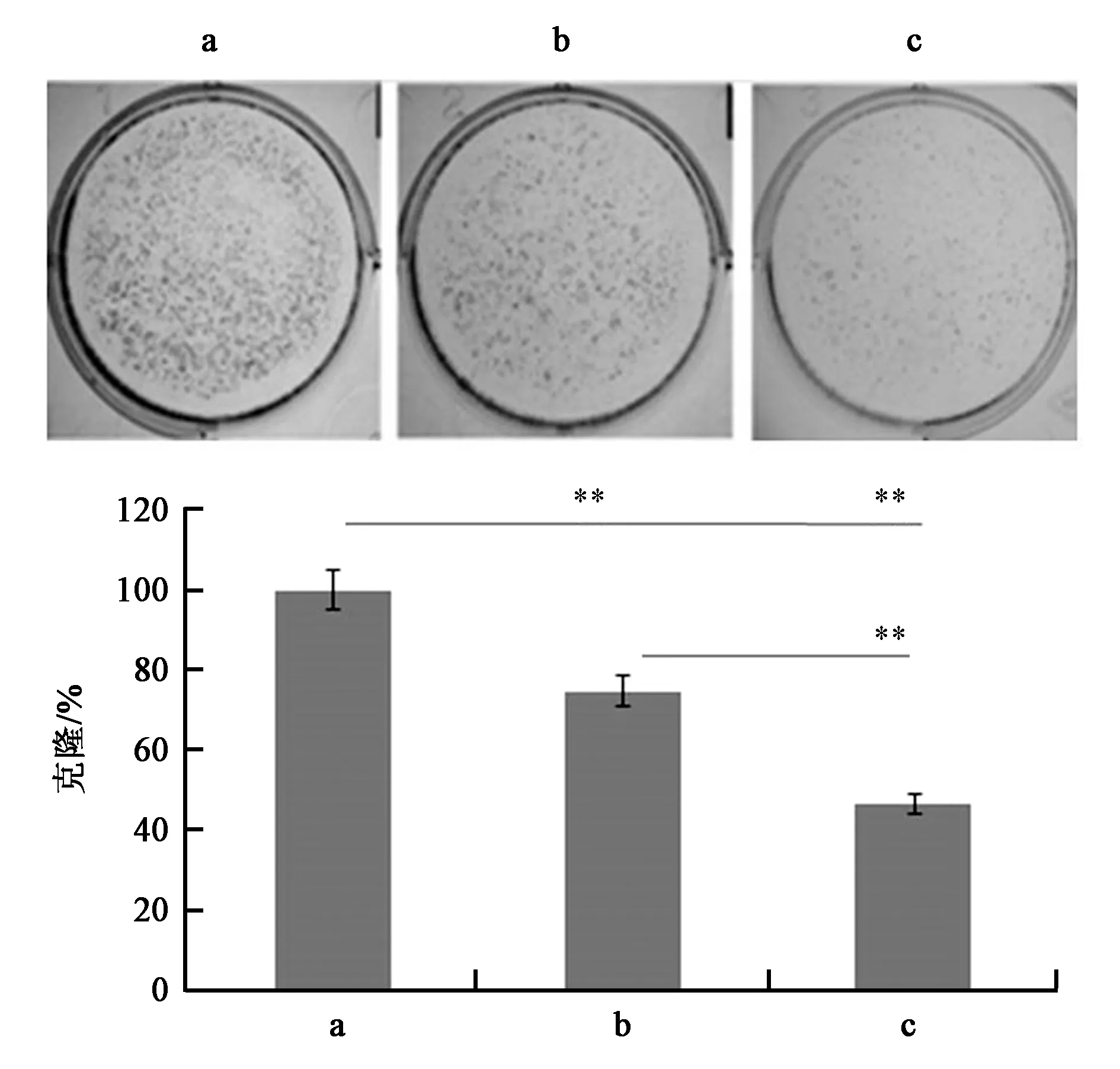
a,b,c—分别表示PBS、TPL和含等量TPL的TPGS-b-(PCL-ran-PGA)/TPL纳米粒。**—两者之间的差异在P<0.01水平上有统计学意义。图6 克隆形成实验Fig.6 Colony formation assay
2.5 TPGS-b-(PCL-ran-PGA)/TPL纳米粒的凋亡诱导作用
为了研究TPGS-b-(PCL-ran-PGA)/TPL纳米粒对HeLa细胞的凋亡诱导作用,我们通过Annexin-V结合和PI染色实验进行流式细胞仪分析。以5×105HeLa细胞接种到12孔细胞板中培养24 h后,加入空纳米粒TPGS-b-(PCL-ran-PGA)、TPL和TPGS-b-(PCL-ran-PGA)/TPL纳米粒,TPL的浓度为0.5 μmol·L-1,即18.0 μg·L-1,继续孵育48 h。结果表明TPL的早期凋亡率和晚期凋亡率分别为23.1%、1.1%,总凋亡率为24.2%,而等量的TPL的TPGS-b-(PCL-ran-PGA)/TPL纳米粒的凋亡率为38.0%,表明等量的TPL纳米粒较TPL诱导细胞凋亡率增加,有趣的是,空纳米粒TPGS-b-(PCL-ran-PGA)也能诱导细胞凋亡,可能是由于TPGS的作用。
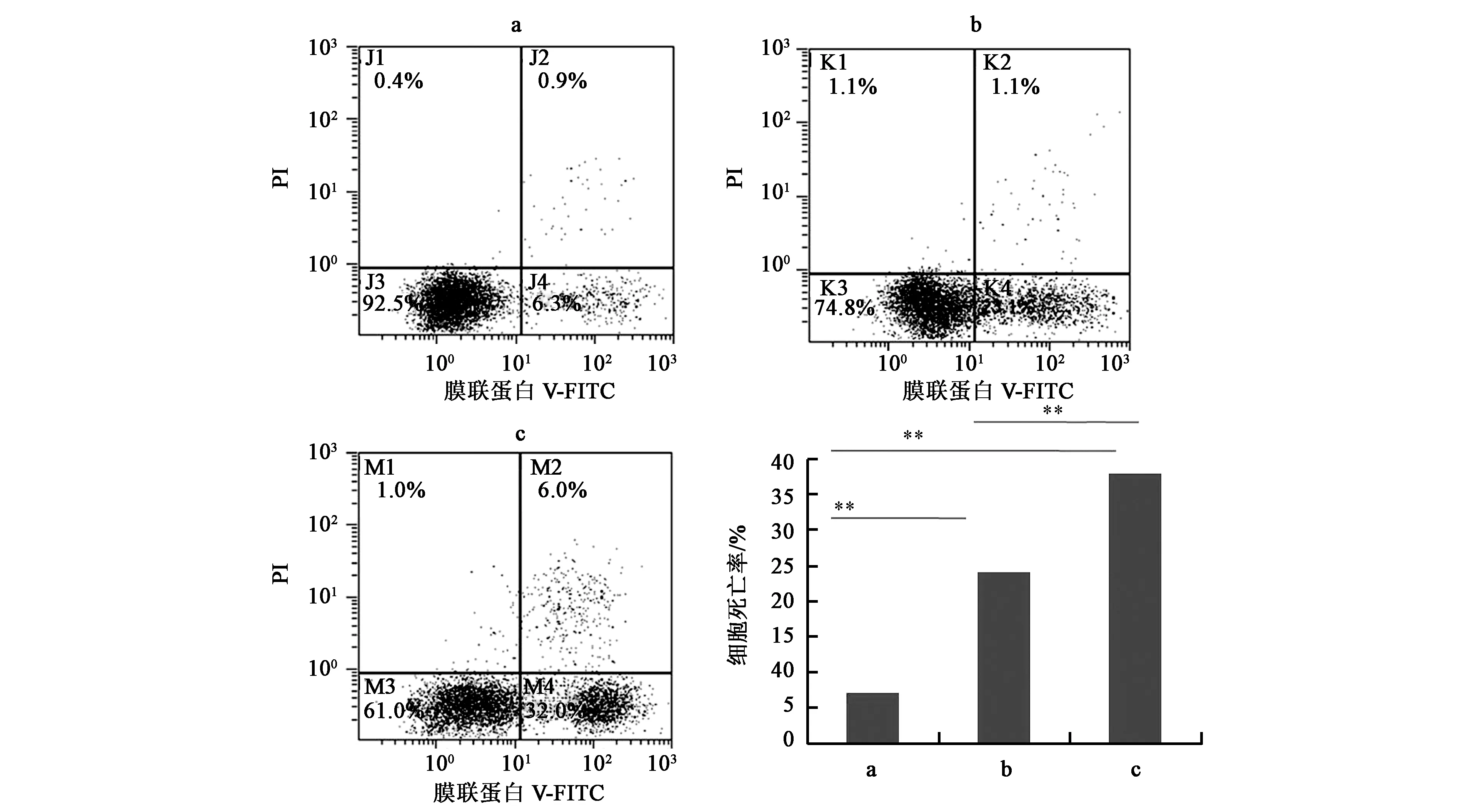
注:a、b和c—分别表示空纳米粒TPGS-b-(PCL-ran-PGA)、TPL和含等量TPL的TPGS-b-(PCL-ran-PGA)/TPL纳米粒。**—两者之间的差异在P<0.01水平上有统计学意义。图7 细胞凋亡分析Fig.7 Apoptosis analysis
3 讨论
雷公藤甲素(TPL)能在体内和体外抑制癌症细胞生长[7-8]。但因为其高度疏水性和对健康细胞的无选择性导致其使用受限。因此,为了解决这些问题,本研究基于生物可降解材料TPGS-b-(PCL-ran-PGA)制备负载TPL的纳米粒,体外评价其对HeLa细胞是否具有减毒增效作用。
我们用乳化/溶剂挥发法,优化TPGS-b-(PCL-ran-PGA)与TPL之间的比例制备TPGS-b-(PCL-ran-PGA)/TPL纳米粒,经过检测发现它们之间比例为50:1时得到TPGS-b-(PCL-ran-PGA)/TPL纳米粒较为合适。其粒径约为95 nm,ζ电位为-12.2mV,其大小和透射电镜基本一致,其形态为球形,大小较为均一。电荷可以减少纳米粒的聚集,维持长循环。纳米粒的大小和粒径影响纳米粒进入细胞,我们制备的TPGS-b-(PCL-ran-PGA)/TPL纳米粒的大小较适合其运载,肿瘤血管的孔径较正常组织血管的孔径大,有助于纳米粒在肿瘤部位滞留,实现被动靶向的目的。TPGS-b-(PCL-ran-PGA)/TPL纳米粒包封率为72.6%,载药量为50.2%,其体外累积释放率呈双相分布,在72 h内其累计释放率达到50%左右,在7 d累积释放率达到70%左右,然后缓慢释放,也间接证明了纳米粒具有缓控释作用。免疫荧光显微镜可以观察到细胞能摄取标记TPGS-b-(PCL-ran-PGA)/TPL纳米粒。我们用MTS实验分析TPGS-b-(PCL-ran-PGA)/TPL纳米粒的细胞毒性,结果发现在24、48和72 h,与游离型TPL比较,TPLTPGS-b-(PCL-ran-PGA)/TPL纳米粒的IC50远远低于游离型TPL,表明纳米剂型具有更大的潜力抑制癌症细胞生长。这可能因为纳米粒被细胞快速摄取,在细胞浆内释放药物[15-16]。克隆形成实验结果表明与等量的TPL和TPGS-b-(PCL-ran-PGA)空纳米粒比较,纳米粒具有缓释特性,对肿瘤细胞持续作用,克隆形成细胞较少,此外,由于TPGS-b-(PCL-ran-PGA)成分中的TPGS具有抑制细胞的p蛋白泵,有助于抑制细胞泵出对细胞有毒的TPL,增强了对肿瘤细胞的细胞毒作用。但TPL组克隆形成细胞较TPGS-b-(PCL-ran-PGA)空纳米粒少,证明TPL对肿瘤细胞的杀伤作用是主要的。TPGS-b-(PCL-ran-PGA)空纳米粒较未处理组的克隆细胞少,且差异具有统计学意义。这表明TPGS-b-(PCL-ran-PGA)/TPL纳米粒对肿瘤细胞生长抑制可能是TPL和TPGS共同作用的结果。
总之,我们成功制备了适当的粒径大小和ζ电位的TPGS-b-(PCL-ran-PGA)/TPL纳米粒,能克服游离型TPL的水溶性差和毒副作用大的缺陷。与游离型TPL比较,TPGS-b-(PCL-ran-PGA)/TPL纳米粒具有更强的抗肿瘤活性,较高的克隆形成抑制和诱导肿瘤细胞凋亡的能力,主要因为TPL持续从TPGS-b-(PCL-ran-PGA)/TPL纳米粒中释放以及包载在纳米粒中的药物稳定性提高了细胞的摄取。TPGS-b-(PCL-ran-PGA)/TPL纳米粒的抗肿瘤细胞活性是TPL和TPGS共同作用的结果。TPGS-b-(PCL-ran-PGA)/TPL纳米粒有望成为抗宫颈等肿瘤的潜在候选药物。

