蒺藜苜蓿糖基转移酶基因SMALL AND EMERALD1的克隆和功能研究
孙志康, 王娜, 孟颖颖, 林浩, 牛丽芳
中国农业科学院生物技术研究所, 北京 100081
类黄酮代谢是重要的植物次生代谢途径之一,以苯丙氨酸(由莽草酸途径产生)为起点,经过一系列酶促反应,产生了最大一类的多酚代谢物,大约包含6 000多种化合物[1-3],对植物生长发育及植物-环境互作有重要作用[4]。黄酮类物质作为类黄酮代谢途径的产物之一,其通过甲基转移酶、酰基转移酶、羟化酶和糖基转移酶的生物活动产生[5-6]。黄酮的糖基化赋予了其结构复杂性和不同的生物活性[7]。在类黄酮代谢中,糖基化是一种常见的化学修饰,它能提高天然产物的代谢活性和生物利用度,并有助于丰富这些化合物的多样性[8]。
植物中的糖基转移酶是糖基化修饰中非常重要的一种酶,在植物生长发育过程中扮演着不可替代的角色,植物体内有很多激素以及次生代谢物都需要通过糖基转移酶的糖基化来改变其生物活性[9]。在水稻(Oryzasativa)中,GSA1 (UGT83A1)的自然变异导致糖基转移酶活性降低和GSA1底物(如山奈酚和槲皮素)的积累,因此,干扰了生长素运输[10]。Yin等[11]鉴定了一个糖基转移酶基因UGT78D2,在其缺失突变体中由于类黄酮代谢中间产物过量累积抑制了生长素的转运,造成了拟南芥(Arabidopsis)植株矮小的表型。糖基转移酶UGT84A1-A4通过调控拟南芥中的类黄酮代谢,来调节类黄酮的生物活性及含量,进而提供在逆境胁迫中的长期保护[12]。类黄酮代谢途径也影响着植物雄性生育能力,水稻oschs1突变体产生类黄酮缺失的花粉粒,并且丧失雄性育性[13-14]。尽管目前在拟南芥和水稻中关于糖基转移酶参与类黄酮代谢途径开展了大量研究工作,但关于豆科植物中糖基转移酶的生物学功能还有待深入研究。
蒺藜苜蓿(Medicagotruncatula)是一年生二倍体(2n=16)豆科植物,因其生长周期短(80~100 d)、自花授粉、基因组小(452~536 Mb)、遗传转化效率高,是研究豆科生物学的理想模式材料。本研究以蒺藜苜蓿为实验材料,定向筛选蒺藜苜蓿中有关类黄酮糖基转移酶基因的Tnt1逆转座子插入突变体,通过表达量检测野生型和突变体中类黄酮合成途径关键基因表达水平,从而探究类黄酮糖基转移酶基因对类黄酮代谢的调控作用。本研究通过初步探究蒺藜苜蓿中糖基转移酶可能参与的生物学活动,以期为豆科植物的遗传改良提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验材料 蒺藜苜蓿野生型R108由本实验室保存。蒺藜苜蓿Tnt1插入突变体se1-1、se1-2和se1-3从美国诺贝尔研究所(Noble Research Institute)获得。所有的野生型和突变体材料均放置于温度24 ℃、湿度50%、光照强度380 μE·m-2·s-1、光周期16 h(光)/8 h(暗)的人工气候室种植培养,用于表型数据收集和DNA、RNA的提取。
1.1.2实验试剂 2×TaqPCR Mix购自南京诺唯赞生物科技有限公司;高保真酶KOD FX购自东洋纺公司;焦炭酸二乙酯(DEPC)、TRIzol试剂、DNA凝胶回收试剂盒(DP214-03);快速质粒小提试剂盒(DP105-03)、反转录试剂盒(AU311-02)、实时荧光定量试剂盒(AQ141-04);Gateway LR Clonase Ⅱ Enzyme mix和Gateway BP Clonase Ⅱ Enzyme mix 均购自美国Invitrogen公司;In-fusion连接酶购自北京迪宁生物科技公司;Rutin(芦丁)标品购自美国MedChenExpress公司;pDONR-207载体和pMDC83载体由本实验室提供。
1.1.3实验器材 PCR扩增仪(杭州博日科技有限公司);稳压稳流电泳仪(美国Bio-Rad公司);5424R/5702R离心机(德国Eppendorf公司);凝胶成像系统1600(上海天能科技有限公司);实时荧光定量 PCR扩增仪(瑞士Roche公司);ESO 600D相机(日本Nikon公司);Nanodrop 2000c超微量分光光度计(美国Thermo公司);LSM700激光共聚焦显微镜(德国卡尔·蔡司公司)。引物合成和样品测序由睿博兴科生物技术(北京)有限公司完成。
1.2 方法
1.2.1野生型和突变体蒺藜苜蓿表型收集 分别选取人工气候室条件下生长40 d的蒺藜苜蓿野生型和se1突变体的整株幼苗进行表型分析,用Nikon ESO 600D相机收集表型。统计植株主茎从下往上数第3片复叶的叶柄长度,野生型R108和每个突变体至少统计15株。
1.2.3RT-PCR检测突变体中SE1基因表达情况
采用Trizol法提取野生型R108和突变体se1-1、se1-2和se1-3复叶的总RNA,参照全式金反转录试剂盒的操作说明进行反转录,以反转录后的cDNA为模板,内参基因参照Meng等[16]的引物序列,使用SE1基因的特异性引物,通过RT-PCR方法对3个突变体中的SE1基因进行基因表达量分析(特异性引物见表1)。PCR反应体系以及PCR反应程序参考李辉等[17]的方法,其中,MtActin基因扩28个循环,SE1基因扩30个循环。

表1 实验所用引物Table 1 Primers used in the experiment
1.2.4SE1系统进化树的构建及蛋白序列比对
根据SE1氨基酸序列,从数据库(https://phytozome.jgi.doe.gov/)中获得拟南芥、大豆和水稻中的同源序列,通过MEGA7.0软件构建系统进化树。利用ClustalW对SE1氨基酸序列与AtUGT84A1蛋白(与SE1亲缘关系最近)进行序列比对,并分析两者共同的保守结构域。
1.2.5类黄酮含量测定 在Day[18]的方法上略作修改,首先制作芦丁标准曲线,取120 ℃真空干燥至恒重的Rutin标准品约50 mg精密称定,置于50 mL容量瓶中,加适量60%乙醇,水浴微热使其溶解,放冷却后用60%乙醇稀释至刻度,摇匀。然后,精密吸取标准溶液0.00、1.00、2.00、3.00、4.00和5.00 mL,分别置于50 mL容量瓶中,各加60%乙醇定容至刻度线,在300 nm波长下测定各溶液的吸光度,以溶度为横坐标、吸光度为纵坐标,绘制标准曲线(回归系数R2应大于0.9)。
取新鲜的野生型R108和突变体叶片20 mg,用1 mL酸化甲醇(甲醇∶水∶盐酸=79∶20∶1)在4 ℃下避光浸提24 h,用分光光度计测定浸提液在300 nm波长下的紫外吸收值,利用Rutin标准曲线计算类黄酮浓度。
1.2.6实时荧光定量(qRT-PCR)分析 收集生长40 d的蒺藜苜蓿野生型和se1-1、se1-2和se1-3突变体由下往上第3片复叶用于比较类黄酮合成途径关键基因(CHS、F3H、F3’H)的表达变化。采用1.2.3相同的方法反转录合成cDNA,以稀释25倍的cDNA为模板,用基因特异性引物(参见表1)参照李辉等[17]的方法进行qRT-PCR检测和结果分析。
综上所述,随着我国经济发展进入新常态,随着产业结构的不断优化和调整,在不断变化的内外部环境中,我国企业必须从内部控制助手,加大内部控制力度,消除内部控制中存在的缺陷,实现内部控制的有效运行,为保证企业的健康、规范、稳定成长提供保障。
1.2.7SE1蛋白的亚细胞定位 以蒺藜苜蓿野生型R108的总RNA反转的cDNA为模板,使用KOD高保真酶克隆SE1基因CDS。反应体系 (50 μL)为:KOD Buffer 25 μL,模板cDNA 1 μL,10 μmol·L-1上、下游引物各1 μL,KOD高保真酶1 μL,2 mmol·L-1dNTP 4 μL,ddH2O 17 μL。反应程序为:98 ℃ 2 min;98 ℃ 15 s,55 ℃ 30 s,68 ℃ 1 min 15 s,共35个循环;68 ℃ 2 min;24 ℃ 1 min。通过BP反应构建到Gateway系统的中间载体pDONR207上,获得重组质粒pDONR207-SE1,然后进行LR反应将目的基因构建到pMDC83载体上,获得植物表达载体pMDC83-SE1,再通过农杆菌GV2260介导的烟草叶片瞬时转化法将pMDC83-SE1载体转入生长4周的烟草叶片中,避光静置48 h后,在激光共聚焦显微镜下观察SE1蛋白的亚细胞定位情况。
1.2.8叶绿素含量测定 参考Almomani和Örmeci[19]的方法,取野生型R108和每个突变体从下往上数第3片复叶的顶叶,称取质量(大约30 mg)后放入10 mL离心管中,加入2 mL无水乙醇置于4 ℃避光浸提,24 h后叶片全部变为白色,此时用分光光度计分别测定浸提液在665 nm、649 nm和470 nm的紫外吸收值。用下列公示计算叶绿色的含量。
Ca=13.95×A665-6.88×A649
Cb=24.96×A649-7.32×A665
叶绿素浓度=Ca+Cb
叶绿素的含量(mg·g-1)=[叶绿素浓度(mg·g-1)×提取液体积(L)×稀释倍数]/样品重量(g)
1.2.9数据处理与分析 利用Excel软件对测定的叶柄长度、类黄酮含量、类黄酮合成途径关键基因的表达水平和叶绿素含量数据进行处理。显著性差异分析采用Student’st-test,P<0.05和P<0.01表示差异具有统计学意义。
2 结果与分析
2.1 se1突变体的表型分析
本课题组前期通过定向筛选蒺藜苜蓿Tnt1逆转座子插入突变体库,分离获得了3个表型类似的叶色和株型异常突变体材料。相比于野生型,上述突变体植株明显矮化变小,叶片卷曲且深绿,统计野生型和突变体主茎从下往上数第3片复叶的叶柄长度后发现,突变体的叶柄长度小于野生型的叶柄长度,且差异极显著(P<0.01)(图1)。基于上述表型观察结果,将上述突变体分别命名为smallandemerald1(se1)-1、se1-2和se1-3。

注:A~H为植株形态;A、E:WT野生型;B、F:se1-1;C、G:se1-2;D、H:se1-3;I、J为野生型和se1突变体叶柄长度统计比较,J中n=15,**表示与野生型相比差异极显著(P<0.01)。Bar=1 cm。图1 se1突变体表型分析Fig.1 The phenotypic analysis of se1
2.2 se1突变体的分离鉴定和分子克隆
本研究从蒺藜苜蓿突变体数据库(https://medicago-mutant.noble.org/mutant/index.php)中筛选获得了插入突变体se1-1、se1-2和se1-3的Tnt1侧翼序列标签,并通过基于PCR的基因分型对分离群体进行分析[20],鉴定到1个候选基因Medtr1g107285,该基因内没有内含子。通过分析突变体株系的侧翼序列发现,se1-1中的Tnt1插在外显子的313 bp处,se1-2中的Tnt1插在外显子的525 bp处,se1-3中的Tnt1插在外显子的1 204 bp处(图 2A)。通过RT-PCR检测,发现并没有完整的SE1基因在突变体中表达(图2B)。上述结果证明se1突变体植株矮小、叶片卷曲且深绿等发育异常的表型可能是由于SE1基因的功能缺失造成的。
2.3 SE1同源蛋白序列比对和系统进化分析
为了研究SE1功能方面的保守性和分化情况,构建了SE1的系统进化树。进化分析显示(图3),SE1与拟南芥中调控类黄酮的AtUGT84As家族聚在一支,表明其与AtUGT84As具有较高的同源性,推测SE1可能参与蒺藜苜蓿中类黄酮代谢的调控。
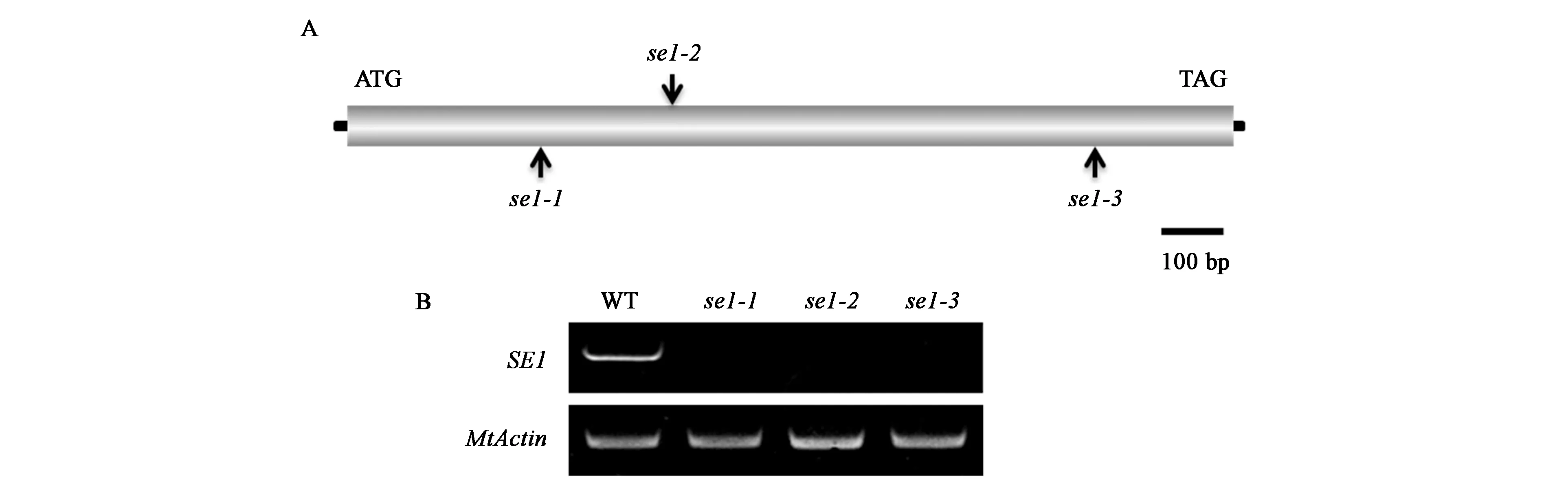
注:A:SE1基因结构示意图和Tnt1逆转座子的插入位置;B:RT-PCR 检测SE1基因在突变体中的表达。图2 SE1基因的分子克隆Fig.2 Molecular cloning of SE1 gene

注:At: 拟南芥(Arabidopsis thaliana) ;Glyma: 大豆(Glycine max); Os: 水稻(Oryza sativa)。图3 SE1蛋白和不同物种中同源蛋白的系统进化分析Fig.3 Phylogenetic analysis of SE1 and homologous proteins in different species
如图4所示,将SE1全长氨基酸序列与拟南芥AtUGT84A1(进化分析与SE1亲缘关系最近)全长氨基酸序列进行序列比对,发现两者氨基酸同源性为52.8%。在NCBI结构域分析网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)上分析2个蛋白质的保守结构域,发现同时具有Glycosyltransferase_GTB-type super family保守结构域,表明SE1可能和AtUGT84A1存在相同的分子功能。
2.4 类黄酮含量测定
为了初步验证SE1对蒺藜苜蓿中类黄酮的调控作用,测定了野生型和突变体叶片中的类黄酮含量。首先,绘制了芦丁标准曲线,得到了线性回归方程y=14.076x+0.010 4(R2=0.997 5)。经过测定和比对标准曲线,突变体叶片与野生型叶片中的类黄酮含量存在显著差异(P<0.01)(图5),前者的含量略低于后者,因此,可初步判定SE1基因的中断表达造成了蒺藜苜蓿中类黄酮的合成受阻。
2.5 se1突变体中类黄酮合成途径关键基因的表达检测
鉴于se1突变体内源类黄酮的含量较野生型低,本研究检测了se1突变体中类黄酮合成途径关键基因的表达量(图6)。结果表明,与野生型相比,突变体中CHS、F3H和F3’H的表达量明显降低。上述结果表明se1突变体中类黄酮合成途径的关键基因表达量下降,引起突变体中的类黄酮含量下降,进而可能导致se1突变体出现植株矮化、叶片卷曲深绿等表型。

注:虚线表示Glycosyltransferase GTB-type super family保守结构域。图4 SE1和AtUGT84A1蛋白序列比对Fig.4 Protein sequence alignment of SE1 and AtUGT84A1

注:**表示与野生型(WT)相比差异极显著(P<0.01)。 图5 类黄酮含量测定Fig.5 Determination of flavonoids content
2.6 SE1的亚细胞定位
为了对SE1蛋白功能进行深入研究,以更好地解析其在生命过程中的作用,本研究构建了融合GFP标签的SE1过表达载体pMDC83-SE1,通过烟草瞬时转化系统进行亚细胞定位分析表明SE1定位在细胞核和细胞膜中(图7),与其糖基转移酶的生物学功能相吻合。
2.7 叶绿素含量测定
为了探究突变体叶片深绿色的原因,经过测定野生型和突变体叶片中叶绿素含量发现,突变体叶片与野生型叶片中的叶绿素含量存在显著差异(P<0.05)(图8),前者的含量略高于后者,可初步判定突变体叶片颜色变得较野生型更绿是由于其中的叶绿素增多导致的,推测SE1基因对于叶绿素合成可能具有负向调控作用。
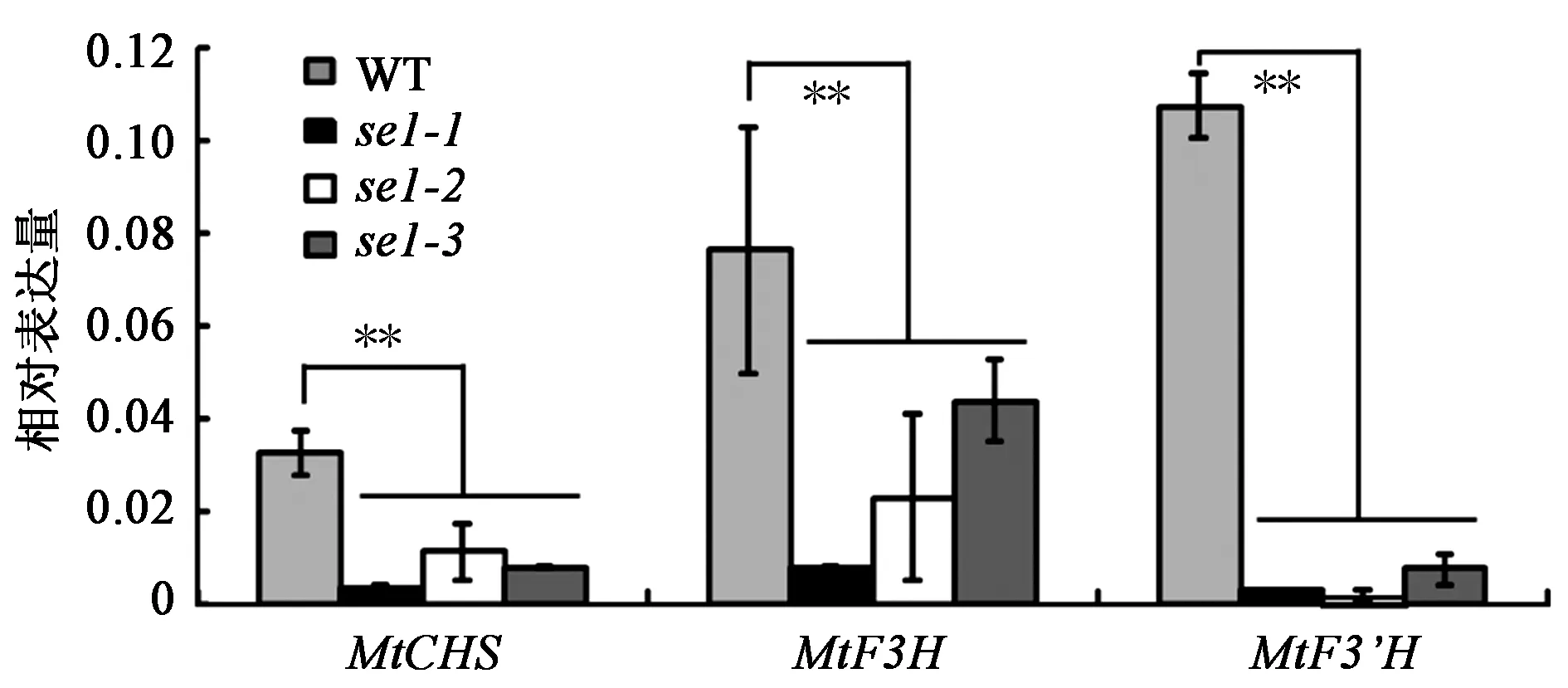
注:**表示与野生型(WT)相比差异极显著(P<0.01)。图6 野生型和se1突变体中类黄酮合成通路关键基因的表达比较分析Fig.6 Transcriptional expression of flavonoid biosynthetic genes in the wild-type (WT) and se1
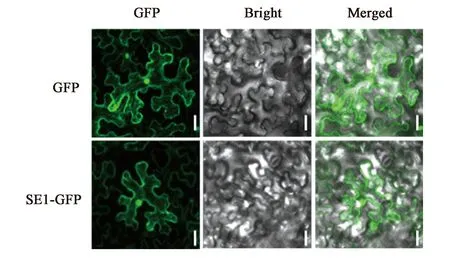
注:Bar = 25 μm。图7 SE1蛋白的亚细胞定位分析Fig.7 Subcellular localization of SE1
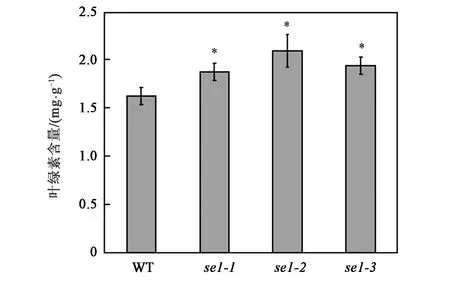
注:*表示与野生型(WT)相比差异显著(P<0.05)。图8 叶绿素含量测定Fig.8 Determination of chlorophyll content
3 讨论
糖基转移酶参与体内重要的活性物质如糖蛋白和糖脂中的糖链合成,通过糖基化修饰类黄酮等次生代谢产物,在植物的生长发育及适应环境的过程中起重要作用[21]。在拟南芥中有许多糖基转移酶参与了类黄酮的糖基化修饰,UGT76E11具有糖基化类黄酮的功能,过量表达该基因的植株表现出较强的抗氧化能力,帮助植物抵御逆境胁迫[22];UGT84A家族是已被证明具有类黄酮糖基转移酶活性的一类蛋白[23],UGT84A1-A4酶在植物类黄酮代谢中表现出显著的功能冗余,单个UGT84A1-A4基因突变后,类黄酮含量并不会发生显著变化,另外UGT84A1-A4受到增强的UV-B诱导表达,能够通过糖基化产生更多的类黄酮以提供长期保护[10]。豆科植物中也有许多类黄酮转移酶,但是能够鉴定出活性和具体功能的糖基转移酶较少。
本研究以豆科模式牧草蒺藜苜蓿为实验材料,发现SE1基因编码一个糖基转移酶,属于GTB型超家族,是AtUGT84As家族的同源基因。通过分析SE1功能缺失突变体,发现SE1可能通过调控类黄酮合成途径基因表达,引起类黄酮含量下降,进而可能导致了se1突变体出现植株矮化、叶片卷曲深绿等表型。表明糖基转移酶在拟南芥和蒺藜苜蓿的类黄酮合成代谢中发挥保守作用。需要提出的是AtUGT84A1-A4存在严重的基因功能冗余问题,而蒺藜苜蓿中SE1单基因功能缺失就可以导致明显表型,说明糖基转移酶基因功能在蒺藜苜蓿中存在分化,进一步说明SE1是一个调控蒺藜苜蓿类黄酮合成代谢的关键因子。SE1的基因挖掘和功能解析可能对于豆科植物类黄酮合成代谢遗传改良具有一定的理论和应用价值。
随着人类工业的发展和生活水平的提高,臭氧层“空洞”现象愈发严重,臭氧层变薄导致的直接结果是太阳辐射中到达地面的紫外线B (UV-B, 280~320 nm)辐射增强,为抵御UV-B辐射带来的伤害,植物不仅可以通过抗氧化酶系统的调节以降低 UV-B对其产生的氧化损伤,还会促进以黄酮类化合物为主的次生代谢产物的合成,来吸收紫外辐射、发挥抗氧化作用[24]。例如:Righini等[25]通过构建表达黄酮合成酶(flavone synthase,FNS)的拟南芥转基因植株,证实了黄酮在植物抗UV-B胁迫中的作用;研究发现表达有黄酮类化合物积累的ZmFNSⅠ或ZmFNSⅡ的转基因拟南芥植株比野生型植株表现出更少的UV-B损伤[26]。拟南芥brt1突变体是AtUGT84A2的基因功能缺失突变体,该突变体的叶片在紫外光的照射下会发出蓝色荧光,其原因是类黄酮代谢中芥子酰苹果酸的大量积累,说明以芥子酰苹果酸为底物的代谢通路受阻,造成了芥子酰苹果酸的积累[27]。AtUGT84A1和AtUGT84A2基因在拟南芥类黄酮代谢中存在显著的功能冗余,都可以通过调控拟南芥中的类黄酮含量为植物提供对UV-B的长期保护[10]。鉴于SE1与拟南芥AtUGT84As家族蛋白高度同源,因此进一步分离鉴定SE1的直接作用底物并揭示其是否参与UV-B胁迫响应是未来研究的重点方向。

