RTN4对于结肠癌细胞增殖的调控作用
杨梦恬, 袁菊懋
1.暨南大学生命科学技术学院, 广州 510000;2.珠海中科先进技术研究院, 广东 珠海 519000
结肠癌是发生于结肠部位的消化道恶性肿瘤,据2018年的全球癌症统计调查显示,全球新增结肠癌病例约为180万,结直肠癌的新增病例约占患癌新增病例的12.1%[1]。全球约有88万例结肠癌的死亡病例,死亡率大概占全球癌症死亡率的9.2%[2-3]。有研究表明,我国约54%的人口存在肠道问题[4]。结肠癌的发生有饮食因素和遗传因素,其中遗传因素对于结肠癌的发生尤为重要。导致未满25岁的青少年患结肠癌的首要诱发条件便是遗传性的结肠疾病[4]。现阶段关于结直肠癌的基因治疗包括原癌基因沉默治疗、抑癌基因治疗、免疫基因治疗和抑制肿瘤血管生成基因治疗等[5]。然而,由于基因的多态性,靶向基因治疗仍有风险,所以目前仍需进一步研究有效治疗结肠癌的策略。因此,寻找与新的结肠癌发生有关的基因显得尤为迫切。同时,这也为揭示结肠癌病理、发现新的治疗靶点以及提高临床预后提供了理论和依据。
RTN4基因(reticulon 4)属于网纹网基因编码家族,此家族与内质网有关,参与神经分泌或者神经内分泌细胞的膜运输。RTN4与促生存以及细胞骨架相关过程有关,其下调降低了鞘磷脂的合成,能够干扰AKT的质膜定位以及影响微管蛋白的稳定性[6],这提示其可能参与调控细胞自噬。除此之外,RTN4基因在人类的多种癌症细胞中发生突变[6]。
有研究表明,在正常组织中可以通过自噬介导的损伤缓解来抑制肿瘤细胞。因此,正常细胞激活自噬可以抑制肿瘤的发生,在肿瘤治疗中,激活自噬可能有助于肿瘤治疗[7]。自噬小体中存在的LC3-I和LC3-II是细胞发生自噬的分子标志。在自噬发生的过程中,LC3先通过切除C端的氨基酸转化为产生胞浆定位的LC3-I、LC3-I,再通过结合磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)产生LC3-II[8]。LC3-II的含量和发生自噬的程度成正比,LC3-II/I比值的大小可估计自噬水平的高低。
由此,本文对与结肠癌细胞相关的RTN4基因进行生物信息学数据分析,通过设计构建敲低的RTN4基因质粒,将其转染进结肠癌细胞HCT116,观察被转染了敲低RTN4基因的质粒的结肠癌细胞的增殖能力以及检测自噬相关蛋白标志物,以期探索RTN4基因与结肠癌发生发展的关系,为结肠癌的防治研究提供参考。
1 材料与方法
1.1 材料
1.1.1细胞株 本次研究所用到的细胞系主要有:HCT116、HEK293T。其中培养HCT116细胞的培养基为GIBCO 1640完全培养基,培养HEK293T的培养基为GIBCO DMEM完全培养基。
1.1.2实验试剂 1640培养基、胎牛血清购自美国GIBCO公司;DMSO购自美国Sigma公司;细胞培养板购自美国Corning公司;Lipofectamine 3000、无血清培养基Opti-MEM ©、细胞增殖检测Cell TraceTMCFSE Cell Proliferation Kit购自美国Invitrogen公司;质粒DNA小提试剂盒、DNA胶回收试剂盒购自天根生化公司。
1.1.3主要仪器设备 二氧化碳细胞培养箱购自香港Heal Force公司;荧光定量PCR仪、凝胶成像分析仪、PCR仪购自美国Bio-Rad公司。
1.2 方法
1.2.1通过生物信息学网站分析基因功能 通过The Human Protein Atlas(https://www.proteinatlas.org/)查询RTN4基因的生存曲线,查看RTN4基因的表达水平与患者生存率的联系。
1.2.2构建RTN4敲低质粒 利用Thermo Fisher公司RNAi网站设计出针对RTN4基因特异性敲减的片段,然后通过对pLKO.1载体进行双酶切,胶回收纯化后,经T4连接酶将双酶切线性化载体与设计的目的片段进行连接、转化和质粒提取,采用双酶切和测序的方法对重组质粒进行序列鉴定。
1.2.3RTN4敲低质粒转染至HCT116细胞 通过胰酶消化收集细胞,用适当的完全培养基平铺HCT116细胞于35 mm 培养皿上,当细胞贴壁完全后即可开始转染。转染前2 h换液(用1.5 mL 完全培养基置换旧的培养基)。收集病毒上清。将细胞平铺于6孔板,最佳密度为30%~70%。加入病毒上清和8 g·mL-1polybrene, 充分摇匀后置于37 ℃温箱孵育。12~24 h 后换液,长满后传代。经嘌呤霉素筛选获得稳定株,并通过实时荧光定量PCR对稳定转染细胞株的敲减效率进行验证。引物设计为:RTN4:F:5’-TCTTCCTGCTGCATCTGAGCCT-3’,R:5’-GCAGTTTCAAGCAGGACAGATGG-3’; ACTIN:F:5’-CACCATTGGCAATGAGCGGTTC-3’,R:5’-AGGTCTTTGCGGATGTCCACGT-3’。
1.2.4WST-1检测细胞增殖实验 96孔板每孔加入5 000个细胞。分别于培养48和72 h检测细胞活性。每孔加入10 μL WST-1溶液。用加了相应量细胞培养液和WST-1溶液但没有加入细胞的孔作为空白对照。在细胞培养箱内继续孵育0.5~4 h,把96孔板置于130 r·min-1摇床上1 min,以充分混匀待检测体系,在450 nm测定吸光度。
1.2.5Western blot实验 配置分离胶为12% SDS-PAGE凝胶,接着加入适量的电泳缓冲液在电泳槽中。取出蛋白样品,用移液器移入凝胶孔中上样。盖上电泳槽,设置电泳参数进行电泳。剪出与凝胶相同尺寸的PVDF膜,将凝胶放在滤纸中间且浸在都是缓冲液的转移槽中贴膜,接着合上转移槽,通电,在装满冰的盆中放入转移槽,恒压90 V转膜1.5 h。将转移好的膜移至含有封闭液的平皿中,室温下封闭1 h。将一抗稀释至适当浓度,4 ℃孵育过夜。从一抗中取出膜,用TBST洗涤共3次,每次5 min。将膜放置于装有二抗的平皿中室温孵育1 h。1 h后,从二抗中取出膜,用TBST洗涤共3次,每次5 min。显影液的配置:放入等体积的发光试剂A液和B液混匀于EP管中。最后用滤纸吸干膜上残留水分,显影盘上摆放膜,加入适量显影液后,用图像处理软件Image J,进行显影、拍照,并分析结果。
2 结果与分析
2.1 结肠癌相关基因与结肠癌患者生存率分析
为了更好地了解RTN4与结肠癌的关系,根据The Human Protein Atlas数据库分析,查询RTN4基因与结肠癌患者生存率的关系,发现RTN4基因表达水平高的结肠癌患者的生存率高于RTN4基因表达水平低的结肠癌患者(图1)。这说明,RTN4基因有可能是潜在的抑癌基因。
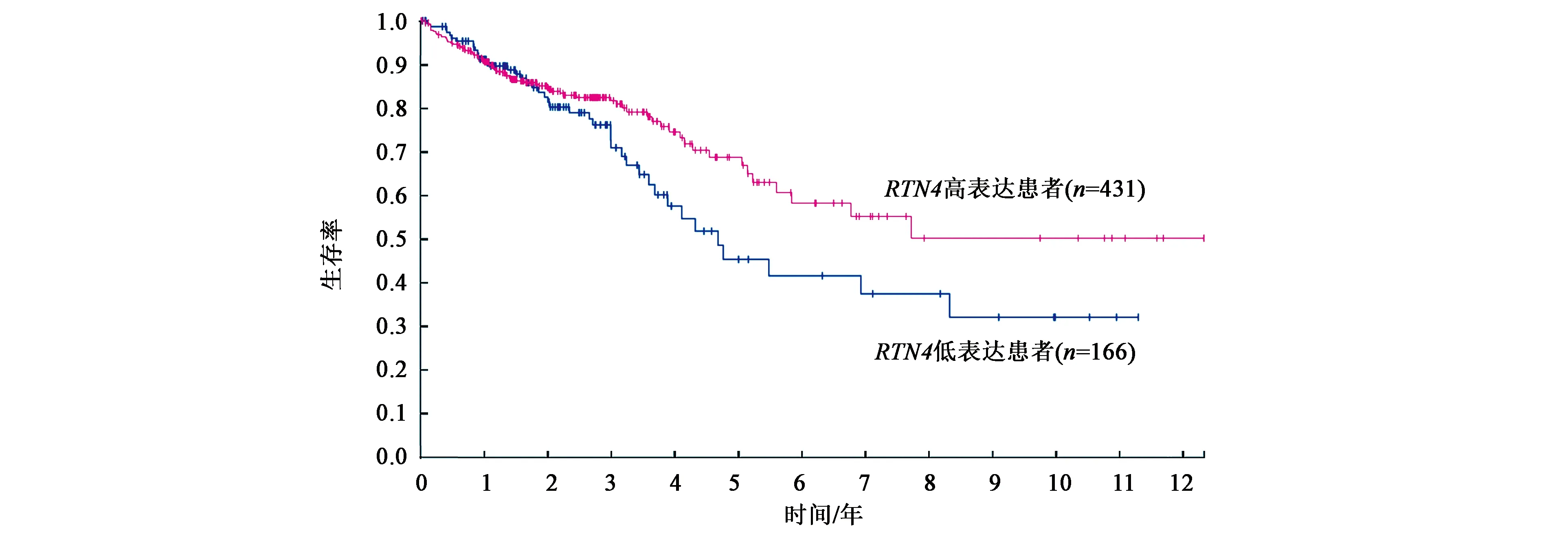
图1 RTN4基因与结肠癌患者的生存率分析Fig.1 Survival analysis of colon cancer patients with RTN4 gene
与此同时,本研究根据The Human Protein Atlas数据库分析,发现69%的病人在5年内生存情况下RTN4基因表达水平较中位数高,45%的病人在5年内生存情况下RTN4基因表达水平较中位数低。
2.2 RTN4基因表达在结肠癌组织中的表达情况
为了系统地观察RTN4基因是否对于结肠癌细胞的增殖有作用,本研究通过比较正常人与结肠癌病人的结肠组织(图2),利用The Human Protein Atlas数据库,分析表达谱数据,发现RTN4基因在结肠癌患者组织中表达水平偏低。
2.3 RTN4基因的敲低对结肠癌的影响
2.3.1获得低表达RTN4的细胞株 为了进一步验证RTN4基因对结肠癌细胞增殖能力的影响,本研究构建了低表达RTN4的细胞系。通过qPCR检测RTN4基因mRNA水平的表达量,结果显示RTN4在细胞中的表达量显著下调(图3),证明成功构建了低表达RTN4的HCT116细胞系。
2.3.2RTN4基因的敲低对细胞增殖能力的影响
为了验证敲低RTN4基因是否对结肠癌细胞的增殖产生影响,通过WST-1细胞增殖实验,结果(图4)显示,敲低RTN4基因促进了HCT116细胞增殖,结果有统计学意义(P<0.05)。
2.3.3敲低RTN4基因后对自噬蛋白表达情况的影响 通过对比对照组(图5),发现RTN4基因敲低组的LC3-II/LC3-I蛋白的转化量增多,p62蛋白减少。本研究发现结肠癌细胞的增殖能力变强,验证了敲低RTN4基因会显著增强结肠癌细胞的增殖能力,并且可能通过激活LC3/p62蛋白自噬来诱导自噬。
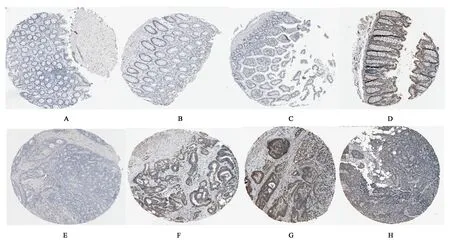
A:女性,62岁,正常结肠组织;B:男性,14岁,正常结肠组织;C:男性,73岁,正常结肠组织;D:女性,61岁,正常结肠组织;E:男性,87岁,结肠癌组织;F:男性,55岁,结肠癌组织;G:男性,82岁,结肠癌组织;H:女性,86岁,结肠癌组织图2 正常结肠组织与结肠癌组织Fig.2 Normal colon tissue and colon cancer tissue
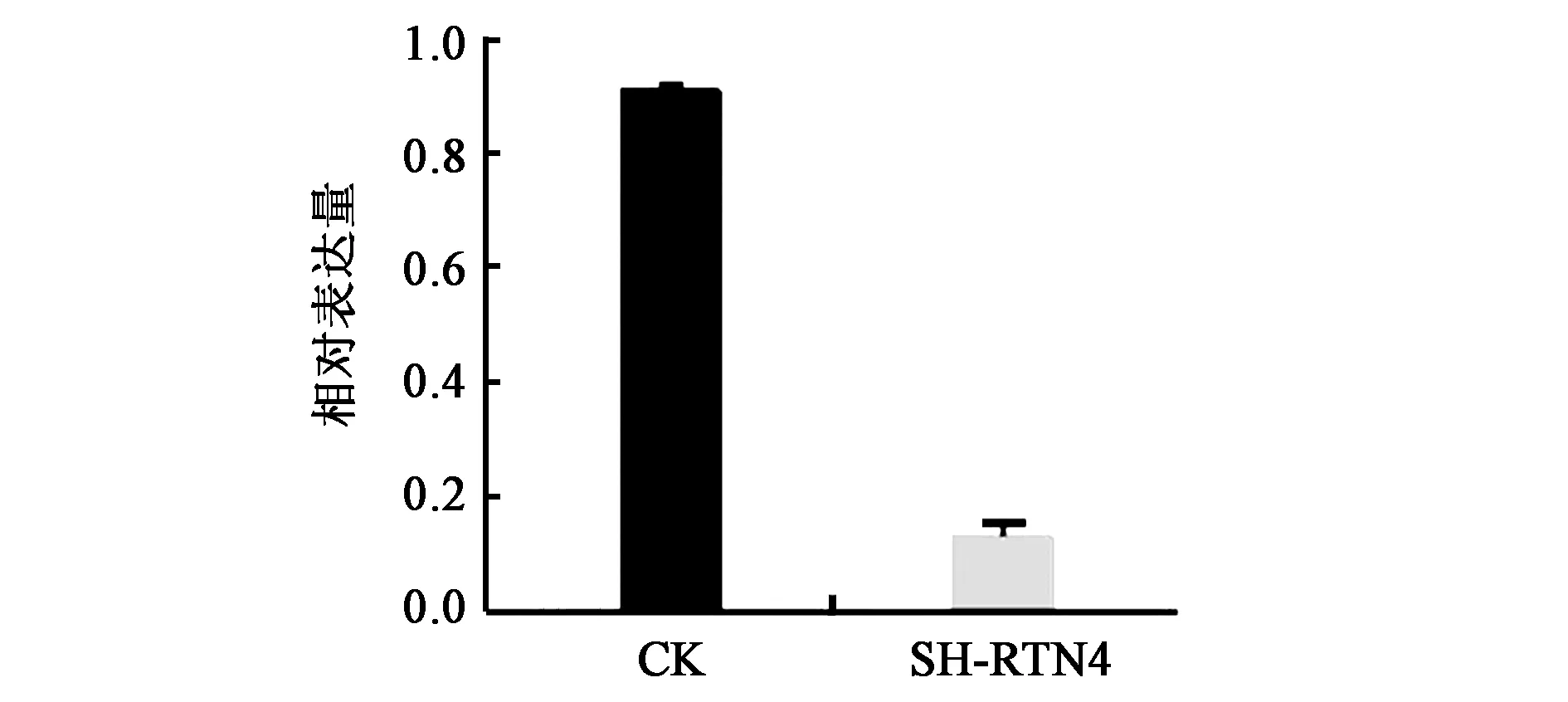
注:SH-RTN4—RTN4低表达细胞系。图3 插入RTN4敲低质粒后细胞内RTN4基因mRNA的表达情况Fig.3 Expression of RTN4 mRNA in cells after insertion of RTN4 knock-down plasmid
3 讨论
将生物信息学大数据分析应用于肿瘤相关的研究是近年来炙手可热的手段之一。有研究团队利用生物信息学分析对甲状腺癌症患者的病理组织与正常人进行对比,通过高通量测序分析,发现甲状腺癌症患者1 133位氨基酸处的Nebulin gene(NEB)突变频率高于正常人[9]。也有研究利用生物信息学分析了与免疫相关的长链非编码RNA,通过评估其预后,发现它在免疫治疗效果方面具有潜力[10]。本团队通过文献查阅以及使用大数据分析平台The Human Protein Atlas在线数据库(https://www.proteinatlas.org/)分析,发现PRKCB、SLC9A3R1、CYB5A以及RTN4基因与结肠癌患者生存率具有显著的相关性,是潜在的抑癌基因,CYB5A和SLC9A3R1目前研究较多。有关胰腺癌的研究通过实验与分析发现CYB5A可诱导自噬,且同时抑制胰腺癌肿瘤细胞的生长与转移来提高生存率[11];有研究表明,在恶性卵巢癌肿瘤中的SLC9A3R1基因剪接识别位点的突变会影响癌细胞行为[12]。这与我们通过数据库分析的结果一致。本研究通过数据分析,发现高表达RTN4基因的病人的生存率高于低表达RTN4的病人的生存率,因而选取RTN4基因研究其在结肠癌发生发展中的功能。后续实验仍有待进一步研究PRKCB、SLC9A3R1和CYB5A在结肠癌中的作用。
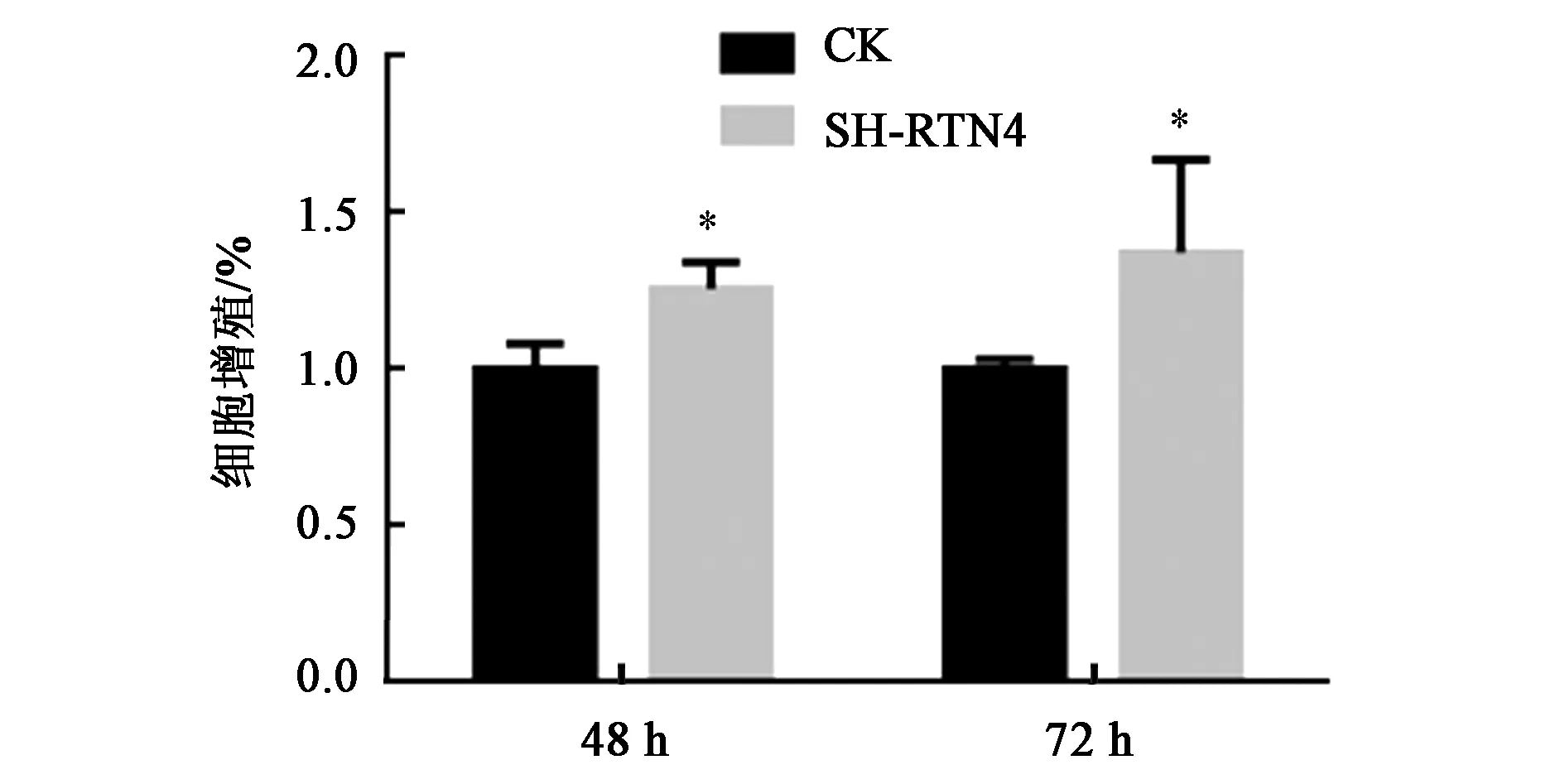
注:SH-RTN4—RTN4低表达细胞系。*—同一时间处理内与对照相比,差异具有统计学意义(P<0.05)。图4 RTN4敲低后结肠肿瘤细胞在不同时间的增殖情况Fig.4 Proliferation of colon tumor cells at different time after RTN4 knock-down
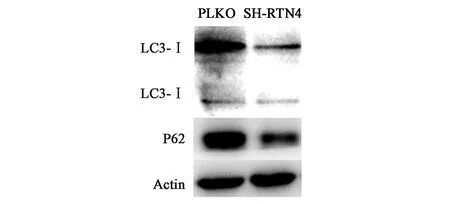
图5 RTN4基因敲低后自噬蛋白的表达情况Fig.5 Expression of autophagy proteins after RTN4 knock-down
在与鼻咽癌相关研究中,RTN4基因中的rs292081多态性与鼻咽癌易感性的增加有显著关联[13]。在相关的前列腺癌研究中,通过实验表明,慢病毒介导的RTN4过表达可以显著抑制前列腺癌细胞(DU145以及LNCaP),RTN4过表达前列腺癌细胞在细胞周期阻滞G2/M期明显衰老,这些结果表明RTN4基因以某种方式参与了前列腺癌肿瘤的进展[14]。在胃癌、肺癌、肾癌、乳腺癌等相关研究中,RTN4的基因表达会影响病人的存活率,RTN4基因高表达会显著提升病人的存活率。由此可见,RTN4在肿瘤形成中参与了重要的作用[6]。
本研究成功构建了RTN4干扰质粒,通过慢病毒转染构建了敲低RTN4的直结肠癌细胞系HCT116,发现了敲低RTN4基因的表达后,会促进结肠癌肿瘤细胞的增殖。这些结果提示RTN4基因在结肠癌中的低表达与结肠癌肿瘤的发生和增殖有着密切的关系,同时说明了RTN4基因对结肠癌HCT116细胞的生长具有抑制作用,揭示了该基因是潜在的治疗结肠癌的基因靶点。
自噬分子通路也与恶性肿瘤密切相关。目前有3种自噬测量方法:电镜观察、Western blot蛋白免疫印迹技术以及LC3免疫荧光显微镜技术。其中,主要通过在不同条件下观察LC3蛋白(微管相关蛋白1的轻链3,microtubule-associated protein1 light chain3)的浓度变化来研究。在自噬发生过程中,LC3蛋白合成后立即在其羧基端被Atg4所剪切,Atg7和Atg3在内的泛素样本体系会修饰和加工产生细胞浆定位的LC3-I,产生分子量为14 kD的LC3-II,并定位到自噬小体中。LC3的表达以及LC3-I到LC3-II的转化程度已在检测自噬水平中成为重要标志[15]。自噬可以保护休眠的肿瘤细胞,在乳腺癌相关研究中,发现肿瘤细胞通过上调自噬水平表达,可以抑制TRAIL(肿瘤坏死因子相关凋亡诱导配体,TNF-related apoptosis-inducing ligand),而TRAIL可以抑制肿瘤转移[16]。有研究发现,自噬会促进肿瘤细胞的增殖。在缺氧、营养缺失的肿瘤微环境下,激活自噬有助于肝肿瘤干细胞CD133+的存活[17]。因此,研究自噬表达水平对观察肿瘤细胞的侵袭和转移有着重要作用。研究表明,RTN4基因的下调会影响鞘磷脂的合成以及削弱AKT的质膜定位,同时也会在体外抑制癌细胞的增殖。本研究中敲低RTN4基因后,p62蛋白表达显著下调,LC3-I到LC3-II的转化程度提高,表明敲低RTN4促进了结肠癌细胞HCT116发生自噬,可能是潜在的抑制肠癌细胞增殖的机制,然而其具体的关键效应分子仍待进一步研究验证。
本研究对结肠癌相关基因RTN4进行生物信息学大数据分析,查询了RTN4基因的功能信息,然后构建了敲低RTN4基因的质粒并转染进肠癌HCT116细胞,观察肿瘤细胞的生长速度。研究发现RTN4基因与结肠癌肿瘤细胞有密切联系,敲低RTN4基因转染进肠癌细胞会促进其生长,同时激活了自噬通路。因此,本研究为进一步探索RTN4基因对于结肠癌细胞的影响机制提供了研究方向和理论基础。

