磺胺甲恶唑高效降解菌群的多样性分析和降解微生物的分离表征
赵冬雪, 刘璐, 穆迎春, 韩刚, 张洪玉, 房洪博, 阮志勇, 宋金龙*
1.渤海大学食品科学与工程学院, 辽宁 锦州 121013;2.中国水产科学研究院, 北京 100141;3.黑龙江省博物馆, 哈尔滨150001;4.中国农业科学院农业资源与农业区划研究所, 北京 100081
我国水产养殖量常年位居世界首位,巨大的产量主要依靠高密度养殖,该类养殖方式增加了水生动物病害的发生风险。抗菌药物具有杀灭水产病原菌的效果,可有效抑制水产动物疾病。磺胺甲恶唑(sulfamethoxazole,SMX),又名新诺明,化学名为N-(5-甲基-3-异恶唑基)-4-氨基苯磺酰胺,可有效抑制水产养殖中嗜水气单胞菌、温和气单胞菌、荧光假单胞菌和诺卡氏菌等引起的细菌性疾病,是目前水产养殖中最常用的广谱抗菌药物[1]。然而,随着该药物的大量使用,残留污染问题越来越严重。磺胺甲恶唑中67%~90%不能被水生动物完全代谢,部分药物以原形或代谢产物形式被排出体外,经养殖废水和污水汇集,最终回流入地表水中[2]。养殖污废水[3]、地表水[4-5]和地下水[6]等多种水体环境中均已检出该药物残留,水生环境遭到威胁。而部分残留在水生动物体内的药物,一旦通过食物链进入人体,将对泌尿系统功能造成破坏,威胁人类健康[7-9]。2017年10月27日,世界卫生组织国际癌症研究机构进一步将磺胺甲恶唑列为3类致癌物。因此,研究并解决当前水产养殖生产中频发的磺胺类药物药害残留问题,对保障水产品质量安全以及我国渔业绿色可持续发展具有重要价值。
国内外研究表明,磺胺甲恶唑的降解主要有物理法、化学法和微生物法,物理法包括吸附、光降解和热降解等[1]。其中,微生物法具有成本低、生态环境友好和无二次污染等特点,被证明是目前修复养殖水体中磺胺甲恶唑残留的有效方法[10]。迄今为止,已有超过20株可降解磺胺甲恶唑的微生物被报道,这些菌株在实验室条件下都表现出优秀的降解能力。
磺胺甲恶唑浓度较低时,Ochrobactrumsp. SMX-PM1-SA1、Labryssp. SMX-W1-SC11和Gordoniasp. SMX-W2-SCD14对5 mg·L-1磺胺甲恶唑288 h的降解率为45.2%、62.2%和51.4%[11],Phanerochaetechrysosporium[12]和PlanococcuskocuriiO516[13]对10 mg·L-1磺胺甲恶唑在72 h和24 h降解率为74.0%和20%。磺胺甲恶唑浓度较高时,Achromobactersp. JL9对50 mg·L-1磺胺甲恶唑120 h的降解率为63.1%[14],硫酸盐还原菌对200 mg·L-1磺胺甲恶唑192 h的降解率为21.3%[15]。此外,AchromobacterdenitrificansPR1[16]、Acinetobactersp.[17]、Pseudomonassp.[18]、Marinobactersp.[18]等菌株对磺胺甲恶唑也表现出了一定的降解能力。
综上所述,已报道的菌株中大部分对高浓度磺胺甲恶唑耐受能力较差,降解效率较低,缺乏对降解后代谢产物和代谢途径的研究。为进一步获得磺胺甲恶唑高效降解菌株,本研究采用连续富集配合组学分析的研究方法,以期获得高效磺胺甲恶唑降解菌,并进行最适环境条件优化,推测了其可能的降解途径,为水产养殖环境中磺胺甲恶唑的去除提供了优良降解菌株。
1 材料与方法
1.1 材料
1.1.1样品采集 活性污泥样品采自江苏省苏州市某药厂废水处理池,用于磺胺甲恶唑降解菌的分离。
1.1.2主要试剂 磺胺甲恶唑标准品购自索莱宝公司,纯度为≥99.5%;甲醇,乙腈等试剂购自国药集团化学试剂北京有限公司,实验用水为高纯水。
1.1.3培养基 无机盐(MSM)培养基(g·L-1)∶K2HPO41.5,KH2PO40.5,NH4Cl 1,NaCl 1,MgSO4·7H2O 0.2,pH 7。Luria-Bertani(LB)培养基(g·L-1):胰蛋白胨 10,酵母提取物 5,NaCl 10,pH 7.2。
1.2 方法
1.2.1活性污泥中菌群的富集 以活性污泥样品为初始接种物,进行微生物群落的富集。将5 g样品加入盛有100 mL MSM培养基的三角瓶中,以50 mg·L-1磺胺甲恶唑为唯一碳源,置于恒温振荡器(30℃、150 r·min-1)培养7 d,后按10%(体积质量分数)接入新鲜无机盐培养基,并将磺胺甲恶唑的浓度提升1倍,连续传代4次,最终使富集物中的磺胺甲恶唑浓度达到300 mg·L-1,将每个代次的富集培养物分别命名为SMX1、SMX2、SMX3和SMX4[19]。
1.2.2富集培养物微生物群落组成和区系变化分析 运用Omega土壤细菌总DNA试剂盒对活性和富集样品行了总DNA提取,纯化回收后进行了16S rRNA V3-V4区扩增。通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′),806R(5′-GGA-CTACHVGGGTWTCTAAT-3′)。PCR体系参照王亚妮等[20]的方法进行。PCR产物纯化回收后,送交百迈克基因科技公司进行文库构建和高通量测序。对获得的序列数据进行OTU(operational taxonomic units)物种注释,分析每个代次群落菌群丰度变化,比较菌群组成结构差异。
1.2.3磺胺甲恶唑降解菌的分离 根据对富集物菌群组成和区系变化的分析,选择第4代富集样品开展磺胺甲恶唑降解菌的分离。将100 μL富集样品均匀涂布在含有100 mg·L-1磺胺甲恶唑的MSM固体平板上,挑选形态不同且生长良好的菌落,通过连续多次划线纯化分离磺胺甲恶唑降解菌。
1.2.4磺胺甲恶唑降解菌的鉴定 对分离到的降解菌株进行全基因组提取,方法参照(Omega)细菌总DNA提取说明书进行。纯化回收后,以菌株总DNA为模板进行16S rDNA扩增,通用引物分别为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′ACGGHTACCTTGTTTACGACTT-3′)。PCR扩增体系和反应条件与王亚妮等[21]的方法一致。对PCR产物回收后送交博迈德科技有限公司进行测序。获得序列后运用Clustal X软件进行多序列比对分析,并运用MEGA 6.0软件构建系统发育树。
1.2.5磺胺甲恶唑降解试验 将分离到的菌株接种于LB培养基中,置于恒温振荡器(30 ℃、150 r·min-1)培养12 h,取10 mL菌液加入离心管后,以6 000 r·min-1离心并弃上清液,沉淀菌体部分用无菌生理盐水洗涤3次后备用。降解试验采用100 mg·L-1磺胺甲恶唑的初始浓度,以1%菌体量接种,研究降解菌在MSM培养基中对磺胺甲恶唑的降解效果。磺胺甲恶唑残留运用高效液相色谱(Agilent 1290,USA)检测,采用Eclipse Plus C18(4.6 mm×150 mm,5 μm)色谱柱;流动相A为0.1%甲酸(体积分数),B为甲醇。靶向筛查梯度洗脱程序:0~2 min,95% A;2~25 min,95%~5% A;25~35 min,5% A;35~40 min,95% A;进样量为20 μL,柱温30 ℃[22],通过标准曲线换算出培养液中磺胺甲恶唑浓度,计算降解能力[23]。
1.2.6环境因素对LLE3降解效率的影响 分别设置不同的培养温度(15、20、25、30、35、40和45 ℃),不同MSM培养基初始pH(4、5、6、7、8和9)以及不同初始接种量(1×107、2×107、3×107、5×107、8×107和10×107CFU·mL-1)研究环境因素对菌株LLE3降解能力的影响。
1.2.7菌株LLE3降解磺胺甲恶唑的代谢产物鉴定 运用液相和高分辨率质谱联用检测菌株LLE3的代谢产物。将菌株LLE3降解磺胺甲恶唑的培养液10 mL与等体积甲醇加入离心管中,在涡旋混合仪上均匀混合1 min。随后将离心管放入摇床中以220 r·min-1混合30 min,再将离心管以5 000 r·min-1离心5 min。吸取上层有机相,并用0.22 μm孔径的滤膜过滤。采用Waters液质联用检测,具体条件为,Waters ACQUITY UPLC BEH C18色谱柱(100.0 mm×2.1 mm,1.7 μm),流速为0.2 mL·min-1,流动相A为0.1%甲酸(体积分数),B为甲醇。靶向筛查梯度洗脱程序:0~2 min,95% A;2~25 min,95%~5% A;25~35 min,5% A;35~40 min,95% A;进样量为20 μL,柱温30 ℃[14]。质谱条件DuoSprayTM离子源,电喷雾电离(ESI),正离子模式扫描,离子源温度为550 ℃;喷雾电压为5 500 V,去簇电压(DP)为65 V;雾化气(GS1)为60 psi;辅助雾化气(GS2)为60 psi;气帘气(CUR)为35 psi。积累时间为0.25 s,信息依赖性扫描(IDA)模式;IDA触发15个子离子扫描;碰撞电压为(35±15)eV,TOF MS进行全扫描,TOF MS/MS进行二级子离子扫描。
2 结果与分析
2.1 磺胺甲恶唑降解菌群组成和区系变化分析
经高通量测序污泥样品和4代富集培养物SMX0、SMX1、SMX2、SMX3和SMX4,分别获得了5 978、6 012、6 048、6 005和6 003个有效序列。经统计分析和OTU注释,结果(图1)表明污泥样品SMX0中的6 015个基因序列被聚集成166个OTU,属水平上总OTU比值由高到低主要分属于BSV13、Lentimicrobium、Flavisolibacter、Ramlibacter和Rhodoferax。经过富集后,培养物SMX1中细菌多样性迅速降低,6 005个序列仅聚集为23个OTU,主要菌群分属于Pseudomonas、Sphingobacterium、Escherichia-Shigella、Alcaligenes和Sedimentibacter。2次传代后,Sphingobacterium的总OTUs比值从8.92%提升到52.72%,逐渐成为优势菌群。再经3、4次传代后,最终富集物SMX4中6 003个序列聚类到16个OTU,细菌多样性明显降低,Sphingobacterium则成为绝对的优势菌群,占总OTUs比值达93.68%。从整体上看,随着磺胺甲恶唑初始浓度的增加,每个代次富集培养中的微生物多样性逐渐降低,OTUs从最初的166个降至16个,菌群丰度和组成也发生了显著改变,经4次连续富集后Sphingobacterium占OTUs总数比值高达93.68%,说明Sphingobacterium菌属很有可能在SMX的降解中发挥重要作用,为进一步分离高效磺胺甲恶唑降解菌群提供了重要信息。
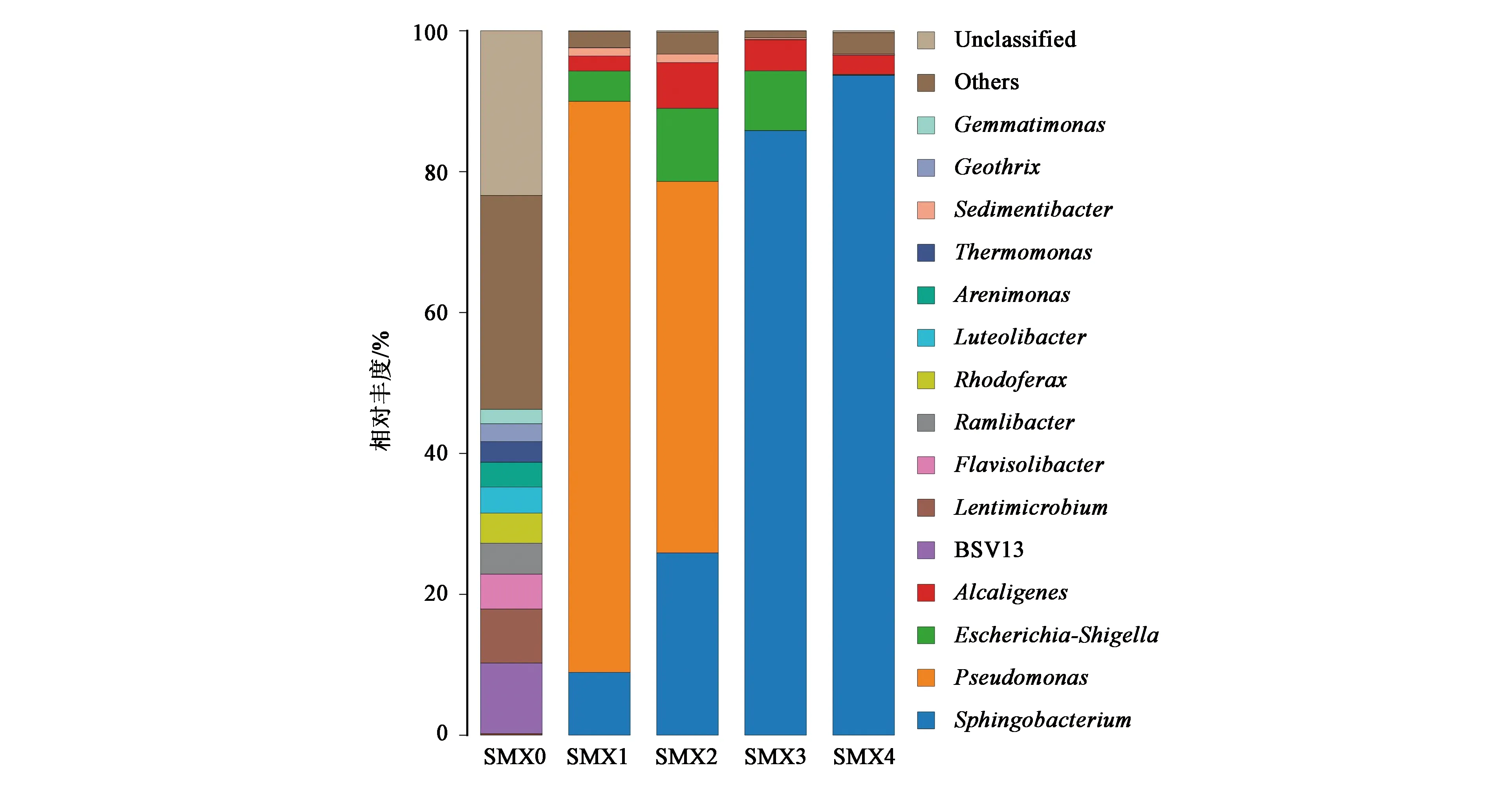
图1 富集培养物中微生物属水平相对丰度分布图Fig.1 Relative abundance distribution of microbial genus level in enriched cultures
2.2 降解菌株的分离与鉴定
在富集培养物SMX4中分离到5株磺胺甲恶唑降解菌,分别命名为LLE1~5,其中LLE3和LLE5降解效果较好,且LLE3 在7 d内对100 mg·L-1的磺胺甲恶唑降解率达89.5%,因此,选择菌株LLE3进行形态学、生理生化和16S rDNA鉴定。从菌落形态上看,菌株LLE3菌落表面光滑,边缘整齐,呈柠檬黄色。在显微镜下,菌株LLE3呈短杆状,长0.6~1.8 μm,宽0.3~0.6 μm,革兰氏染色阴性。生理生化结果表明,菌株LLE3可以利用葡聚糖、D-麦芽糖、D-海藻糖、D-纤维、二糖龙胆、二糖、蔗糖、D-松二糖、水苏糖等,但不能利用D-山梨醇、D-甘露醇和D-阿糖醇。将菌株LLE3的16S rRNA基因序列提交GenBank数据库,序列登录号为MW261785,BLAST结果表明,LLE3与水谷鞘氨醇杆菌(Sphingobacteriummizutaii) NCTC12149 16S rRNA 基因的相似性为99.09%,通过MEGA 6.0构建的系统发育树中可以看出(图2),菌株LLE3与鞘氨醇杆菌属(Sphingobacterium)的菌种汇聚在一起。因此,根据形态、生理生化和16S rRNA序列分析,初步将LLE3鉴定为水谷鞘氨醇杆菌(Sphingobacteriummizutaii)。
2.3 温度对菌株LLE3降解效率的影响
本文研究了不同温度梯度对菌株LLE3降解磺胺甲恶唑效率的影响。从图3中可以看出菌株LLE3在15~40 ℃范围内均可降解磺胺甲恶唑,温度耐受性较好。其中,在25~35 ℃的区间内7 d时对初始浓度100 mg·L-1磺胺甲恶唑降解效率均达到60%以上,30 ℃时降解效率最高,达到了93.6%。当温度低于20 ℃时降解效率明显下降,在20 ℃和15 ℃时降解率分别为33.8%和56.7%。当温度为40 ℃时,降解率为48.2%。由此可见,菌株LLE3具有一定的耐冷性,这也与鞘氨醇杆菌属的其他菌株类似。
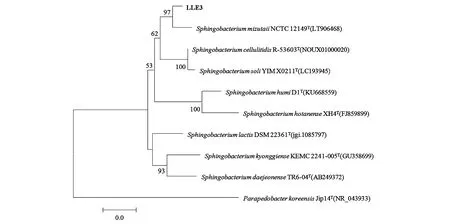
图2 基于LLE3 16S rRNA序列构建的系统发育进化树Fig.2 Phylogenetic tree based on LLE3 16S rRNA sequence
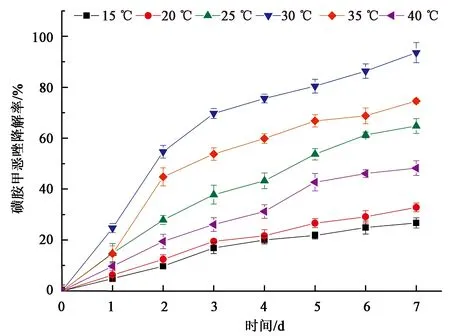
图3 不同温度对LLE3降解效率的影响Fig.3 Effect of different temperatures on the degradation efficiency of LLE3
2.4 初始pH对菌株LLE3降解效率的影响
pH是影响菌株降解效率的关键因素之一,不同pH对菌株降解影响的结果(图4)表明,LLE3可以在pH为4~9的范围内降解磺胺甲恶唑,最适pH为7,最高降解效率达到了92.2%。此外,LLE在pH为5~8的范围内降解效率均超过50%,说明菌株LLE3在偏中性的条件下降解效率较高。当pH降低至4时,降解效率仍有35.5%,说明菌株对酸性条件具有一定的耐受性。当pH为9时,降解效率为42.4%,说明LLE3在偏酸、中性和偏碱的条件下均可使用。
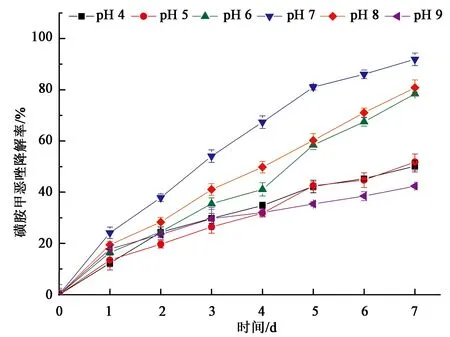
图4 不同pH对LLE3降解效率的影响Fig.4 Effect of different pH on the degradation efficiency of LLE3
2.5 初始接种浓度对菌株LLE3降解效率的影响
研究了不同初始接种浓度对菌株降解磺胺甲恶唑的影响,如图5所示,当接种浓度为5×107CFU·mL-1时,菌株LLE3降解效率最高,为92.1%,且在初始接种浓度(2~8)×107CFU·mL-1的范围内降解效率均超过90%,当接种量增加为8×107CFU·mL-1时降解效率为85%,10×107CFU·mL-1时降解效率为76.9%。由此可见,菌株LLE3在提高接种浓度时降解效率无明显变化,初始接种量对菌株LLE3降解率影响较低。
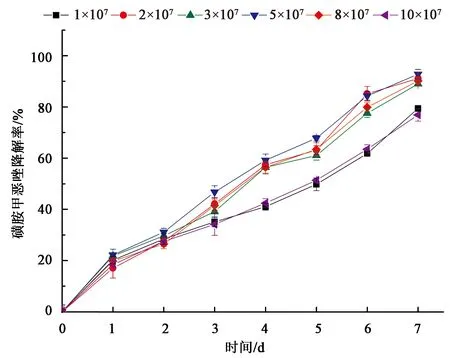
图5 接种量对LLE3降解效率的影响Fig.5 Effect of inoculation on the degradation efficiency of LLE3
2.6 菌株LLE3降解磺胺甲恶唑特性研究
研究了最适条件下菌株LLE3对磺胺甲恶唑的降解特性,从结果(图6)中可知,菌株LLE3对磺胺甲恶唑的降解效率最高发生在1~4 d,在4 d时降解率达82.2%,而菌体浓度也相应达到了83.2×107CFU·mL-1,降解效率与菌体生长浓度呈正相关。5~7 d时,菌株LLE3进入了生长平台期,相应的对磺胺甲恶唑降解速率逐渐降低,最终,菌株LLE3在7 d内对初始浓度为100 mg·mL-1的磺胺甲恶唑降解率达到了93.4%。本研究首次发现水谷鞘氨醇杆菌对磺胺甲恶唑具有较好的降解效果。
2.7 菌株LLE3降解磺胺甲恶唑代谢产物的研究
运用高效液相色谱与质谱联用的方法,检测了磺胺甲恶唑在MSM液体培养基中经菌株LLE3降解3 d后的代谢产物,结果如图7所示。检测到2个片段的质荷比分别为253和281 m·z-1,根据磺胺甲恶唑的化学结构以及质谱数据库的推断,质荷比253 m·z-1为磺胺甲恶唑母体化合物,降解质荷比为281 m·z-1的物质推断为N-[4-(1,2-恶唑-3-基氨磺酰基)苯基]乙酰胺。该菌株主要是将磺胺甲恶唑一端的苯基上的氨基氧化为乙酰胺基,同时将甲恶唑环上的甲基去掉,从而成为最终的产物N-[4-(1,2-恶唑-3-基氨磺酰基)苯基]乙酰胺。
3 讨论
鞘氨醇杆菌属(Sphingobacterium)为不产生芽孢的革兰氏阴性细菌,广泛存在于自然界中。Yabuuchi等[24]首次提出将Sphingobacterium单独成属以来,鞘氨醇杆菌属的新种相继被科研工作者们从不同的生境中发掘,如土壤、植物、动物,甚至心室体液、尿液等临床样本。其中,嗜温鞘氨醇杆菌(Sphingobacteriumthalpophilum)和多食鞘氨醇杆菌(Sphingobacteriummultivorum)被报道具有石油烃的降解能力,如SphingobacteriummultivorumSWH-2具有较强的石油降解活性,并在该菌中发现了降解酶[25]。此外,虽然目前发现的大部分鞘氨醇杆菌都对多种抗生素具有抗药性,但迄今为止,尚无鞘氨醇杆菌属对抗菌药物直接降解的相关报道。本研究分离的水谷鞘氨醇杆菌是第一次报道鞘氨醇杆菌属可以降解磺胺甲恶唑。该菌的发现不但填补了鞘氨醇杆菌属菌株的功能范围,也为修复磺胺甲恶唑污染的养殖环境提供了宝贵的微生物资源。
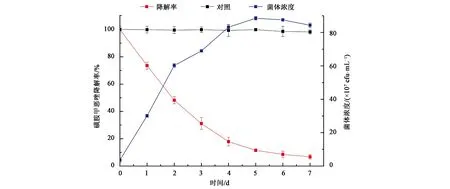
图6 LLE3降解磺胺甲恶唑降解特性Fig.6 Degradation characteristics of LLE3 degrading sulfamethoxazole
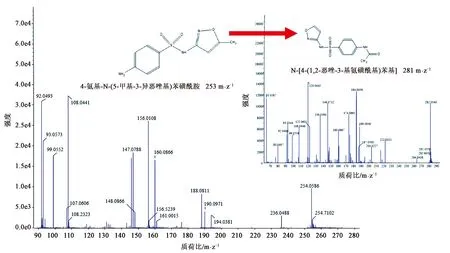
图7 菌株LLE3降解磺胺甲恶唑产物的质谱图Fig.7 Mass spectrum of the sulfamethoxazole degradation product by strain LLE3
近年来,研究人员已经从土壤、活性污泥、养殖水体中分离到了一批具有较好磺胺甲恶唑降解能力的菌株,如PlanococcuskocuriiO516[13],Achromobactersp. JL9[14],Phanerochaetechrysosporium[12]和Acinetobactersp.[17]等,与已报道的菌株相比较,菌株LLE3具有更佳的环境适应性和耐受性。从环境因素对降解效果影响的研究中可以看出,菌株LLE3在15~45 ℃、pH 4~9的范围内均可降解磺胺甲恶唑,这对于将来该菌株在养殖环境中的实际应用提供了基础。且生理生化结果显示,LLE3可以利用多种碳源,可见该菌对环境的适应能力强,营养代谢类型丰富,具有降解其他复杂化合物的潜力。
现有报道结果表明,鞘氨醇杆菌属的菌株大多都不能产生抗生素,但对抗生素具有抗药性,这是鞘氨醇杆菌适应极端环境的重要因素[26]。抗生素是一类本身抑制微生物生长的化合物,因此降解菌首先需要具备抗生素的耐药性。然而,有研究指出,Klebsiellapneumoniae能利用氯霉素作为唯一碳源进行生长,但是药敏试验发现这些菌株对氯霉素是敏感的,这表明细菌的耐药过程和降解药物过程是两个独立的途径[27-28]。从菌株LLE3降解磺胺甲恶唑的产物来看,该菌主要是将磺胺甲恶唑一端的苯基上的氨基氧化为乙酰胺基,同时将甲恶唑环上的甲基去掉,从而成为最终的产物N-[4-(1,2-恶唑-3-基氨磺酰基)苯基]乙酰胺。说明该菌具有明确的磺胺甲恶唑的降解功能,不仅仅是具有较好的耐受性。虽然从降解产物上来看,该菌并不能完全矿化磺胺甲恶唑,但产生的代谢产物N-[4-(1,2-恶唑-3-基氨磺酰基)苯基]乙酰胺为首次报道,为研究微生物降解磺胺类药物途径的研究提供了一定参考。
本研究运用连续富集传代结合高通量测序的方法,分析了磺胺甲恶唑降解富集物中微生物群落组成和变化,找出了与降解相关的核心微生物。进一步分离纯化到了高效磺胺甲恶唑降解菌,经初步鉴定为SphingobacteriummizutaiiLLE3。通过单因素试验确定了该菌最适的降解条件为30 ℃,pH 7,初始接种量5.0×107CFU·mL-1。该菌7 d内对磺胺甲恶唑降解效率为93.7%。菌株LLE3降解磺胺甲恶唑的主要代谢产物为N-[4-(1,2-恶唑-3-基氨磺酰基)苯基]乙酰胺,本研究为磺胺甲恶唑污染的生物修复提供了优良的微生物资源。

