血清UA 水平与脑梗死患者颅内外动脉粥样硬化性狭窄的关系
苑宝文 李筹忠 陈瑜峰 魏 玲
1.贵州省骨科医院神经内科,贵州贵阳 550000;2.贵州省人民医院神经外科,贵州贵阳 550000;3.贵州省毕节市第一人民医院针灸科,贵州毕节 551700
脑梗死是神经系统常见的危重症之一,随着人口老龄化的加剧,脑梗死发病率逐年上升,致残、致死率也较高,严重威胁患者的生命健康[1]。众多研究表明颅内外动脉粥样硬化性狭窄(ICAS/EAS)是脑梗死患者最主要的病理基础[2-3],有效干预可降低发生脑血管疾病的风险。尿酸(UA)是机体嘌呤代谢产物,近年来随着人类饮食结构的改变,高UA 血症患者明显增多。有研究[4]显示,高UA 可促进机体氧化应激,引起血管内皮细胞损伤,进而导致动脉硬化的形成,但亦有研究[5]认为UA 可通过抗氧化作用而改善细胞活性,因此血清UA 水平与动脉硬化的关系尚存在争议。鉴于此,本研究分析血清UA 水平与脑梗死患者ICAS/EAS的关系,以期为脑梗死的早期预防、诊治提供帮助。
1 对象与方法
1.1 研究对象
选取2019 年1 月—2020 年1 月于贵州省骨科医院(以下简称“我院”)随诊的脑梗死患者216 例作为研究对象。纳入标准:①脑梗死的诊断符合《中国急性缺血性脑卒中诊治指南2014》[6]中的相关标准;②发病时间≤1 周;③临床资料完整,自愿进入本研究。排除标准:①近2 个月有服用影响血清UA 代谢的药物;②患有痛风、风湿免疫性疾病;③患有恶性肿瘤;④存在严重的心、肺、肝、肾等重要器官功能障碍;⑤患有感染性疾病;⑥患有血液系统疾病。患者均签署知情同意书,本研究经过我院医学伦理委员会审批同意。
1.2 方法
1.2.1 一般临床资料 收集入组患者基本临床资料,包括年龄、性别、吸烟史、饮酒史、体重指数(BMI)、高血压病史、糖尿病史、冠心病史、脑卒中家族史。
1.2.2 生化指标的检测 抽取入组对象清晨空腹静脉血10 mL,经3000 r/min 离心15 min,取上清置于-70℃冰箱中备用。使用全自动化生化分析仪检测UA、高密度脂蛋白(HDL)、三酰甘油(TG)、低密度脂蛋白(LDL)、总胆固醇(TC)、空腹血糖(FBG)、C 反应蛋白(CRP)、纤维蛋白原(FIB)、同型半胱氨酸(Hcy)。
1.2.3 ICAS/EAS 的评估 使用飞利浦彩色超声诊断仪(荷兰)评估患者颈内外动脉斑块形成及狭窄情况。患者取平卧位,头偏向检查对侧,超声探头沿着颈动脉走向,自下而上行连续性横、纵切面扫描患者双侧颈总、颈内、颈外动脉,分别于双侧颈总动脉远端分叉处1 cm、劲动脉窦部及颈内动脉起始段1 cm 处进行测量,并对斑块形成及狭窄进行分级[7]:无斑块形成为正常,单侧斑块≤3.0 mm×3.0 mm 为轻度,单侧斑块>3.0 mm×3.0 mm 或双侧均有斑块(至少一侧斑块≤3.0 mm×3.0 mm)为中度,双侧斑块均>3.0 mm×3.0 mm为重度。根据评估结果,得出脑梗死患者无ICAS/EAS 66 例(30.56%),ICAS/EAS 150 例(69.44%),其中轻度ICAS/EAS 57 例,中度ICAS/EAS 68 例,重度ICAS/EAS 25 例。
1.3 统计学方法
采用SPSS 23.0 软件对所得数据进行统计学分析。计量资料采用均数±标准差()表示,组间比较采用t 检验或采用LSD-t 检验。计数资料采用百分率表示,组间比较采用χ2检验或Fisher 确切概率法。使用Spearman 相关分析UA 与ICAS/EAS 严重程度的相关性,应用logistic 分析脑梗死患者ICAS/EAS 的影响因素。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组血清UA 及一般临床资料比较
狭窄组患者血清UA、年龄、BMI、TC、LDL,高血压病史比例均明显高于对照组,差异有统计学意义(P <0.05)。见表1。

表1 两组血清UA 及一般临床资料比较
2.2 不同严重程度的ICAS/EAS 患者血清UA 水平的表达情况比较
各组UA 水平比较,差异有统计学意义(P <0.05)。其中,重度、中度、轻度组UA 水平均高于对照组,重度、中度组UA 水平均高于轻度组,重度组UA 水平高于中度组,差异均有统计学意义(均P <0.05)。见表2。
表2 不同严重程度的ICAS/EAS 患者血清UA 水平的表达情况比较(μmol/L,)

表2 不同严重程度的ICAS/EAS 患者血清UA 水平的表达情况比较(μmol/L,)
注:与对照组比较,aP <0.05;与轻度组比较,bP <0.05;与中度组比较,cP <0.05。UA:尿酸;ICAS/EAS:颅内外动脉粥样硬化性狭窄
2.3 血清UA 水平与ICAS/EAS 严重程度的相关性
Spearman 相关性分析显示,血清UA 水平与ICAS/EAS严重程度呈显著正相关(rs=0.634,P <0.001)。见图1。
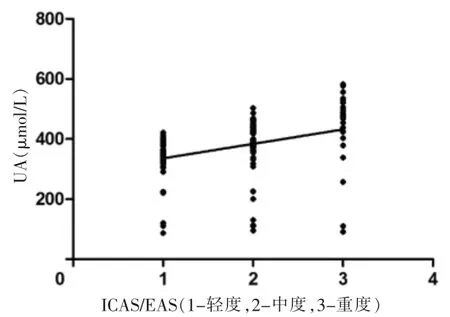
图1 血清UA 水平与ICAS/EAS 严重程度的相关性
2.4 脑梗死患者ICAS/EAS 的影响因素分析
logistic 回归分析显示,年龄、高血压、TC、LDL、UA均是脑梗死患者ICAS/EAS 的危险因素(均P <0.05)。见表3。赋值说明:因变量(无ICAS/EAS=0,ICAS/EAS=1),自变量(高血压:无=0,有=1)。

表3 脑梗死患者ICAS/EAS 的影响因素分析
3 讨论
脑梗死受多种因素影响,其中ICAS/EAS 是缺血性脑血管疾病的直接发病原因,因此其早期筛查及预防对降低脑梗死发病率至关重要。ICAS/EAS 在临床中较为常见,狭窄处粥样硬化斑块破裂引发的血栓形成和栓塞是最主要的病理过程。既往研究显示ICAS/EAS的严重每提高10%,患者的缺血性脑卒中风险可增大26%,是不良脑血管事件的重要危险信号[8]。目前,ICAS/EAS 的危险因素较多,包括年龄、血压、血脂等,临床治疗在一定程度上降低了ICAS/EAS 的发生率,但ICAS/EAS 引发的脑血管疾病仍呈现上升趋势[9],可能是ICAS/EAS 受多种因素的影响。
UA 随肾脏排泄进而保持血液稳定的UA 浓度,当机体UA 生成增多或排泄障碍时,均会导致血清UA 水平上升形成高尿酸血症[10]。高尿酸血症不仅会引发痛风,还参与了动脉粥样硬化、高血压、肥胖等过程[11]。相关研究[12-13]认为UA 可预防血管粥样硬化的发生,进而延缓心脑血管疾病的进展。但汤群英等[14]研究发现血清UA 水平随着老年脑梗死患者ICAS/EAS 程度的加重而逐渐升高,且血清UA 水平≥400 μmmol/L 是脑梗死患者ICAS/EAS 的独立危险因素。相关研究[15-16]证实绝经后伴血清UA 水平升高的女性发生不良心血管事件的概率明显高于常人,且UA 水平升高可增加脑梗死患者的死亡率和复发率。Pak 等[17]研究证实应用黄嘌呤氧化酶抑制剂降低血清UA 水平后,可以改善心血管内皮功能损害及氧化应激,还可以提升患者的左室射血分数。本研究结果显示,脑梗死并发ICAS/EAS 患者血清UA 水平明显升高,且其水平随着ICAS/EAS 的加重逐渐升高,相关性分析显示UA 与ICAS/EAS 严重程度具有较好的相关性,提示血清UA 水平可较好地反映脑梗死ICAS/EAS 的严重程度。进一步分析发现UA 水平的升高是脑梗死患者ICAS/EAS的独立危险因素,这再次证实UA 与ICAS/EAS 的发生具有较好的量化关系,是ICAS/EAS 的促发因素。UA导致动脉粥样硬化的机制较为复杂,通过本研究结果及既往报道,推测其机制如下:①高UA 水平可促进LDL 的氧化和脂质的过氧化,进而损伤血管内膜平滑肌功能,导致其增生、纤维化,最终促进动脉粥样硬化的发生[18];②高UA 水平可激活白细胞,促进其黏附、聚集,并且促进炎症因子的释放,引发血管炎性损伤[19];③高UA 水平易形成结晶沉积于血管内膜,可直接损伤血管壁、诱发炎症反应,加速动脉粥样硬化进程;④高UA 可异常激活血小板功能,造成凝血异常,进而促进血栓形成及斑块破裂[20-21]。因此,临床中应积极检测并控制患者血清UA 水平,以降低动脉粥样硬化及脑卒中的风险。
本研究结果发现脑梗死ICAS/EAS 患者的年龄、BMI、TC 水平、LDL 水平、高血压病比例明显高于对照组,而血清HDL 水平明显低于对照组,多因素分析亦显示年龄、高血压病、TC 水平、LDL 水平是患者发生ICAS/EAS 的危险因素,与既往研究结果一致[22-23]。高龄患者身体机能差,血管抗损伤及恢复能力均较弱,发生动脉粥样硬化的概率较高;高血压并引起的血压波动是引起血管内皮损伤的重要危险因素,其为脂质异常沉积提供了便利;TC、LDL 水平的升高是血脂异常的常见表现,二者为动脉粥样硬化的形成提供了原材料[24-25]。临床中对于此类患者也应注意防治动脉硬化的发生。
综上所述,血清UA 水平可较好地反映脑梗死患者ICAS/EAS 的严重程度,且是ICAS/EAS 的独立危险预测因子,临床中可据此及早评估颈动脉粥样硬化情况,以降低脑梗死的发生率。

