腐蚀气体与铁基化合物反应的热力学分析*
吴文亚,魏 博†,李光辉,陈丽娟,王建江,马金荣
(1.新疆大学 煤炭清洁转化与化工过程自治区重点实验室,新疆 乌鲁木齐830046;2.新疆新业能源化工有限责任公司,新疆 乌鲁木齐831300)
按照国家环保部门对锅炉氮氧化合物超低排放标准的要求,通常锅炉采用低过量空气系数燃烧或空气分级送入等[1]低氮燃烧方式,来降低NOx的排放.这种低氮燃烧方式会由于炉内的含氧浓度过低,很容易形成强还原性气氛.这些在还原性气氛下生成的气体将会与高温受热面表面的氧化膜(Fe2O3·Fe3O4)发生复杂的反应,引起锅炉受热面严重的高温腐蚀甚至发生爆管[2].影响锅炉高温腐蚀的一个重要因素是炉膛内的气氛,腐蚀过程中发生的反应也变得相应复杂.徐伟刚等[3]研究了锅炉受热面在含硫气氛下的高温腐蚀,表明锅炉受热面的腐蚀主要是在还原性气氛下生成大量的H2S气体与金属或金属氧化物发生反应以及单质硫的高温腐蚀.Mets¨ajoki J等[4]的研究则表明受热面在高温氯盐环境下会产生氯化腐蚀,主要是由于燃煤中含有NaCl等含氯化合物.当含氯燃煤在炉膛燃烧时,产生HCl气体,造成高温腐蚀.王健[5]研究了煤在缺氧燃烧时,CO气体扩散到水冷壁表面时,会破坏金属表面致密的氧化铁保护膜,使其疏松开裂.这些研究指出了高温腐蚀的反应机理以及相应的腐蚀形态,迄今鲜有从热力学角度来分析高温腐蚀中发生复杂反应的机理研究.
化学热力学软件HSC chemistry可以计算多种约束条件下的多元多相平衡条件,计算结果以图形或表格的形式输出,更加直观.目前,很多学者采用HSC Chemistry软件对不同物质在不同气氛下的分解过程以及生产工艺进行热力学计算,发现软件计算的结果与理论推导值相近,说明可以使用HSC Chemistry软件计算热力学过程,且计算更为方便[6,7].本文采用HSC chemistry软件模拟计算了不同的腐蚀性气体与铁基化合物发生主要反应的吉布斯自由能随温度的变化和复杂气氛在不同温度系统下化合物的物料组成.通过各反应进行的方向和反应条件得到复杂气氛下最终腐蚀产物以及中间产物对高温腐蚀的影响结果.试验结果能够给锅炉高温腐蚀的防治措施提供参考.
1 研究对象与方法
1.1 研究对象
锅炉在缺氧燃烧的条件下受热面管道附近区域会形成还原性气氛,其所处的服役环境中含有大量的腐蚀性气体(CO、H2S、HCl)[8],本文将这几种腐蚀性气体作为对象,来研究复杂气氛下的Fe基金属的高温腐蚀.
1.2 研究方法
HSC Chemistry是一种成熟的热力学计算软件,可以用来计算各种物质的化学反应平衡和热力学数据,并且可以根据计算结果模拟反应进程[9].首先用HSC软件的Reaction Equation模块计算CO气体、H2S气体、HCl气体与Fe的氧化物之间的反应以及吉布斯自由能随温度的变化,再通过比较各反应的吉布斯自由能数值ΔG的变化趋势(即ΔG<0时反应可自发向右进行,ΔG=0时反应达到平衡,ΔG>0时反应不能自发向右进行),得出各反应式进行的相对难易程度[10].反应的吉布斯自由能随温度的增加而上升,说明在低温下这些反应更容易向右进行,随着温度的升高,这些反应更容易向左进行.其次是用Equilibrium Compositions模块计算在复杂气氛体系中,不同温度平衡状态下化合物的物料组成.主要是依据了吉布斯自由能最小原理,考虑反应中存在的元素、组成所有可能的物质的分子式,从中选择出可能的反应物和生成物,设定好反应所处的压力和温度范围,对复杂的反应进行模拟[11].
1.3 计算工况
1.3.1 单一气体的高温腐蚀
根据相关研究,列出CO、H2S、HCl气体与Fe的氧化物之间的反应以及生成物之间的相互反应,考虑锅炉实际运行情况,选择计算的温度范围和压力分别为0~1 300℃、0.1 MPa,并将计算结果用Origin软件进行作图分析.
1.3.2 复杂气氛下的高温腐蚀
对于平衡反应产物组成的计算条件按以下设定:(1)计算的温度范围为10~1 300℃;(2)系统压力按常压计算,即为0.1 MPa;(3)涉及的气相物质主要有N2、O2、CO、CO2、H2S、HCl、H2O、SO2;固相物质有Fe、Fe2O3、Fe3O4、FeO、FeS、FeCl2、S;(4)根据锅炉烟气的计算方法和参考张知翔[12]等,表1给出了实际锅炉烟气在还原性气氛下的主要气氛成分以及含量.通过调整基体材料Fe含量的变化,直到Fe的含量不会对各物质的反应曲线趋势产生影响,从而确定Fe的含量为100 kmol.

表1 烟气成分含量Tab 1 Chemical composition of flue gas
2 结果与讨论
2.1 CO腐蚀的热力学计算
CO与铁基化合物反应过程的化学方程式见(1)~(6),采用HSC Chemistry软件计算了不同反应温度下吉布斯自由能的变化.计算结果如图1.
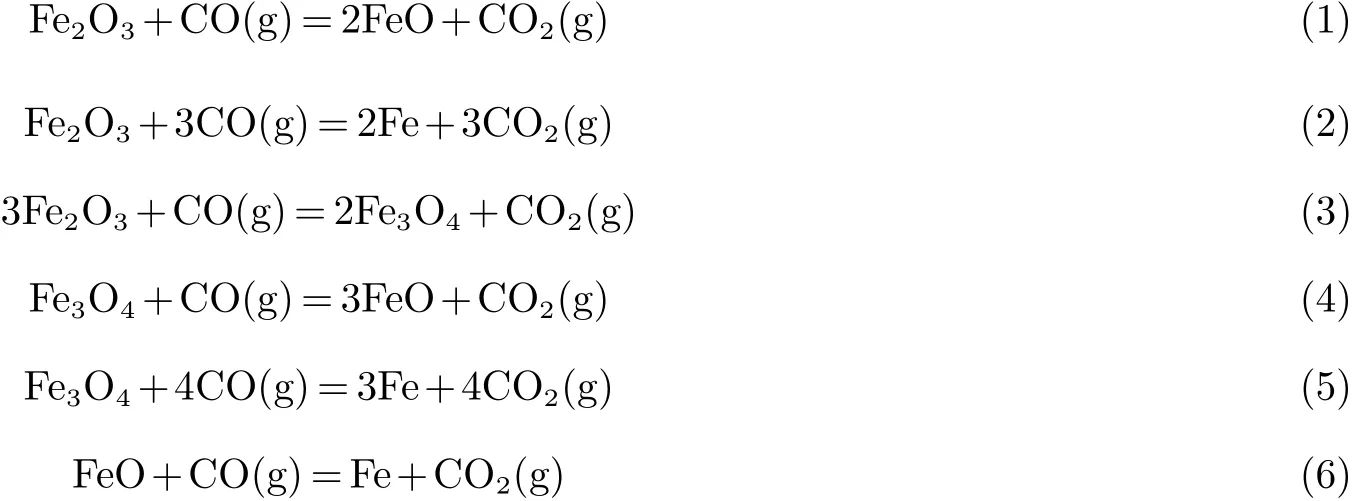
图1为6个反应的ΔG-T关系图.由图可得,在0~1 300℃的温度范围内,Fe2O3和CO反应的吉布斯自由能均为负值,说明反应(1)~(3)是自发进行的.但是由于Fe2O3和CO反应生成Fe3O4的吉布斯自由能最小.因此,从热力学趋势来讲,Fe2O3与CO反应生成Fe3O4的反应更容易发生.在较低温度下(0~580℃),金属表面生产的Fe3O4会被还原成金属Fe;当温度大于580℃时,Fe3O4开始被还原成结构疏松的FeO,且致密性差.由图1可以看出,只有当温度小于580℃时,FeO能够被还原成金属Fe.因此,在实际运行中,腐蚀产物FeO的还原难以发生,当锅炉停炉时,管壁温度发生较大变化,可能会发生FeO的还原,同时由于产物膜层产生较大的热应力,会造成金属管壁上腐蚀层的大面积剥落[13],进一步加速受热面的腐蚀.
图1 CO气体与铁基化合物反应的ΔG-T图Fig 1 ΔG-T diagram of CO reaction with Febased compounds
2.2 H2 S腐蚀的热力学计算
当炉膛内处于还原性气氛时,H2S与铁基化合物反应过程的化学方程式见(7)~(11).采用HSC Chemistry软件计算的ΔG随着温度的变化计算结果如图2(a)所示.当H2S在高温进入到氧化性气氛后,反应过程的方程式见(12)~(19),ΔG随着温度变化的计算结果如图2(b).



图2 H 2S气体与铁基化合物反应的ΔG-T图Fig 2 ΔG-T diagram of H2 S reaction with Fe-based compounds
图2(a)为H2S在还原性气氛下反应的ΔG-T关系图.从图中可知,当温度低于300℃时,H2S才会与Fe2O3或Fe3O4发生反应,生成FeS和单质S.而锅炉启动之后,炉膛燃烧区域温度已远远超过300℃,因此,反应式(8)~(9)在锅炉正常运作时不会自发向右进行.由反应式(10)~(11)的吉布斯自由能数值可知,H2S与金属Fe在0~1 300℃都可以发生反应.但是当温度超过770℃后,H2S与FeO生成FeS的反应不能自发向右进行,也就是说H2S与Fe生成FeS的反应更容易发生.邹磊等[14]对实际锅炉的受热面腐蚀产物进行成分分析,得到了当腐蚀介质以还原性气氛为主时,H2S气体将作为一种腐蚀性气体,主要与金属Fe发生反应生成FeS,生成的产物FeS热力学稳定性差,而且内应力比较大,会严重破坏金属管壁的氧化膜.
由图2(b)可得反应式(12)~(19)的吉布斯自由能都小于0,说明在0~1 300℃反应均可以自发进行.而且除了反应(14),其他反应的吉布斯自由能都随着温度的上升而增加,说明这些反应在较低温度下更容易发生.反应生成的硫单质其腐蚀性更强,它会穿透金属表面的腐蚀层到达金属基体表面,与金属发生硫化反应(反应(12)、反应(14)).由于反应(16)生成的吉布斯自由能最小,因此FeS被氧化成Fe3O4和SO2的可能性最大.徐力刚等[15]也提到当烟气中的氧化性气体达到一定分压时,FeS则会氧化成Fe3O4和SO2,所生成的SO2又可以提高原子硫的活性并加速硫酸盐型腐蚀,使腐蚀不断恶化.
2.3 HCl腐蚀的热力学计算
HCl与铁基化合物反应过程的化学方程式见(20)~(23),吉布斯自由能的计算结果如图3.

图3为反应(20)~(23)的ΔG-T关系图.由图3可以看出,反应式(20)~(23)的吉布斯自由能均随着温度的增加而上升,说明随着温度的升高,反应愈发难以进行.当温度低于500℃时,HCl在还原性气体CO存在的条件下与金属氧化膜Fe3O4反应生成FeCl2以及FeO(反应(22)),同时FeO又与HCl反应生成FeCl2(反应(20)).但是考虑实际情况,锅炉燃烧区域温度高于500℃,所以该反应难以发生.比较反应(21)和反应(23),HCl和Fe2O3反应的吉布斯自由能小于HCl和Fe反应的吉布斯自由能,所以从热力学角度来看HCl和Fe2O3反应生成FeCl2和FeO的反应更易发生.而反应生成的FeCl2熔点非常低,在高温炉膛里瞬间挥发,造成金属管壁表面产物层出现大量的孔洞和缝隙,为侵蚀性离子提供了反应通道,从而加剧了腐蚀.

图3 HCl气体与铁基化合物反应的ΔG-T图Fig 3 ΔG-T diagram of HCl reaction with Febased compounds
2.4 复杂气氛下的高温腐蚀
以上研究了单一气氛条件下腐蚀反应的热力学过程,而实际锅炉受热面附近为复杂气氛,对高温腐蚀有着严重的影响.图4为采用HSC软件中的平衡组分模块模拟复杂气氛下物料组成的变化趋势.
由图4(a)可以看出,在0~300℃,FeCl2和H2O反应可以生成HCl气体,且温度越高,反应越容易发生.但是在锅炉正常运行中,炉膛温度超过300℃,所以当温度大于300℃后,环境气氛主要以HCl为主,没有FeCl2的存在,在锅炉停炉以后或者在低温区域可能存在FeCl2.此外,反应刚开始温度较低,S元素全部以FeS的形式存在;随着温度的升高,FeS和H2O反应生成H2S;当温度进一步升高到700℃时,部分FeS被氧化成S单质;直到温度达到900℃左右,部分H2S气体也会氧化成S单质,所以这也从理论上解释了高温下炉膛会有H2S气体和S单质同时存在的原因.单质硫的腐蚀比H2S腐蚀更加严重,它会直接穿透金属表面的氧化膜到达金属表面,与内部金属发生硫化反应,同时使得氧化膜开裂脱落.
由图4(b)可以看出,FeO的含量会随着温度的增加而增加,所以FeO会一直附着在金属管壁上,造成金属减薄.在0~400℃左右,CO2会和FeO、FeCl2反应生成CO、HCl和Fe3O4,所以FeO的生成曲线趋势会变缓慢,反应(22)也能够证实此现象.当温度在500℃左右时,FeO的生成曲线趋势变快,而这时CO2的含量也在快速减少,CO含量在逐渐增加,这是由于CO2和Fe发生了反应生成了CO和FeO,反应式(5)和(6)的吉布斯自由能随温度的曲线变化趋势也证实了这一点(图1).
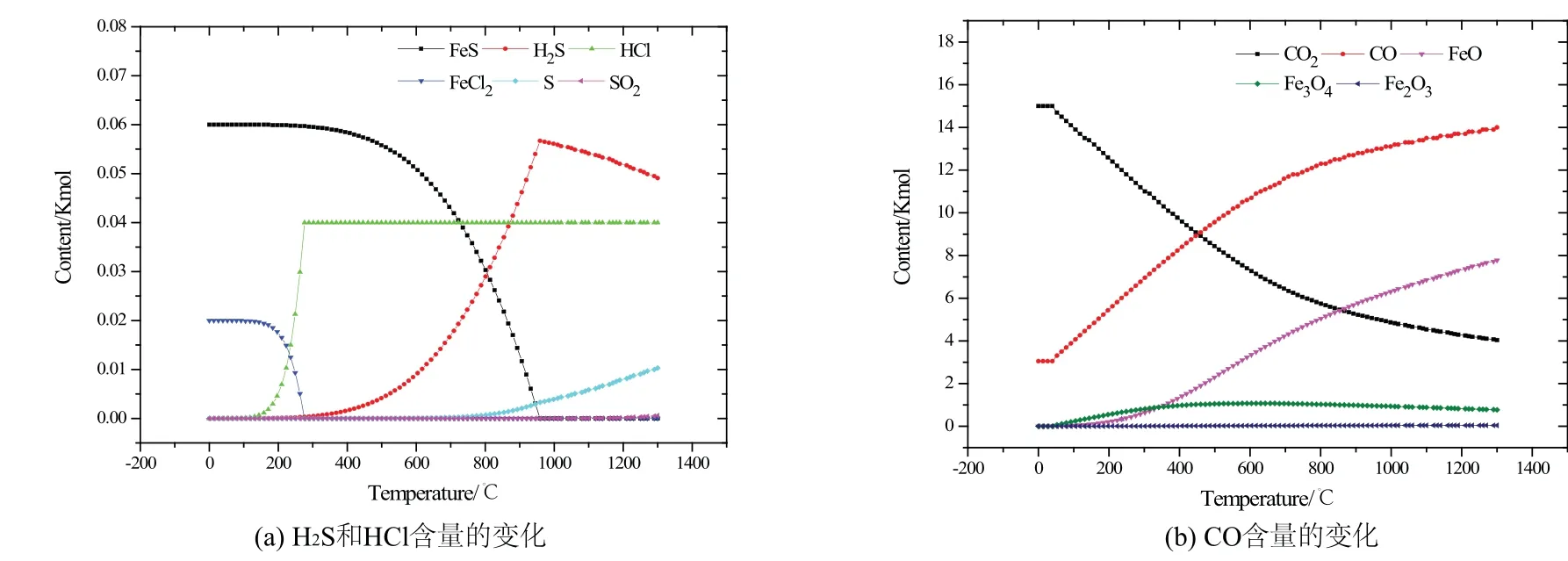
图4 复杂气氛下不同温度系统内化合物的物料组成Fig 4 Material composition of compounds in different temperature systems under complex atmosphere
3 结论
本文利用热力学软件HSC Chemistry中的Reaction Equation和Equilibrium Compositions两个模块分别计算了在还原性气氛下单一腐蚀性气体(H2S、HCl、CO)与Fe基化合物反应的吉布斯自由能随温度的变化规律以及在复杂气氛下不同温度系统内化合物的物料组成.通过上述计算结果,得出以下结论:
(1)当温度大于580℃时,Fe3O4开始被CO还原成结构疏松的FeO,氧化膜FeO不具有保护作用,导致腐蚀进一步加剧;
(2)当炉膛存在强还原性气体时,难以生成高价态的氧化物.主要的氧化产物是FeO,所以金属表面难以生成一层致密的氧化膜,而且当温度在700℃左右时,H2S腐蚀会和S腐蚀协同进行,对锅炉受热面造成严重腐蚀破坏;
(3)HCl腐蚀主要发生在300℃左右,锅炉正常运行期间受热面附近区域温度较高,一般不会发生此类型的高温腐蚀.

