用于口服固体制剂药效学研究的大鼠DMH/DSS炎症相关结直肠癌模型的建立
余玲,刘葭,郝逗逗,郭子右,刘玉娟,吴清(北京中医药大学中药学院,北京 102488)
结直肠癌(colorectal cancer,CRC)是当前全球最常见的癌症之一,其中溃疡性结肠炎是结直肠癌发展的重要风险因素,约20%的癌症是由于长期反复慢性炎症刺激引起的[1]。研究如何抑制结直肠炎的发生,阻断“炎-癌转化”,对结直肠癌的预防有重要作用。因此,建立稳定、可靠的炎症相关结直肠癌动物模型具有非常重要的研究意义。目前该类模型可大致分为三类:化学诱导类,基因工程类和自发类[2],其中化学诱导类应用最广泛。目前较为常见的用来建立炎症相关结直肠癌模型的造模诱导剂为 1,2- 二甲肼(1,2-dimethylhydrazine,DMH)、氧化偶氮甲烷(azoxymethane,AOM)联合葡聚糖硫酸钠(dextran sulfate sodium,DSS)。DMH/AOM 是构建炎症相关结直肠癌模型常用的化学致癌剂,可以诱导大鼠/小鼠产生组织学表现类似于人散发性结直肠癌的结直肠肿瘤[3],DSS 作为致炎剂的造模方法已经比较成熟与稳定,重复性好,在化学致癌剂与化学致炎剂的联合作用下,能够模拟炎症性肠病逐渐发展为结直肠癌的“炎-癌转化”过程[4]。
在结肠炎或炎症相关结直肠癌药物防治研究中,目前研究报道最多的是以微丸为代表的口服固体制剂,如美沙拉嗪肠溶缓释微丸等[5-8]。微丸是一种粒径小于2.5 mm 的球状或类球状口服固体剂型,具有比表面积大、生物利用度高、便于分剂量及适于组合、通过包衣方式实现不同释药性能、释药行为的重现性与一致性良好的特点[9]。然而在动物实验药效学研究方面,以微丸为代表的口服固体制剂存在给药困难的问题,如制剂不能以常规方法粉碎、混悬后给药,且实验动物需要长期灌胃固体制剂,研究中常用的小鼠模型在此并不合适。通过查阅文献发现,目前尚没有明确、统一的炎症相关结直肠癌大鼠模型的造模方案,不同造模方案中致癌剂的剂量、致炎剂的浓度、大鼠品系等并不一致,如DMH 多在10~40 mg·kg-1,DSS 多在0.5%~3%,实验大鼠品系包括SD 大鼠、Wistar 大鼠、F344 大鼠等[10-15]。
当归汤为中医治疗慢性结肠炎的经典方,首载于《外台秘要·卷第二十五·数十年痢方一十一首》,文中记载“当归汤,疗三十年下痢,止诸痛方,当归,生姜,大枣。上三味,以水四升,煮取一升半,分作三服,不瘥复作之”。前期研究并验证了当归超临界提取物、酚酸类、多糖类的癌症预防作用,并通过挤出-滚圆法制备当归有效组分微丸制剂[16-19],当归、生姜超临界提取物对2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的结肠炎模型具有治疗作用[20]。同时,Zhang 等[21]采用超速离心法制备生姜纳米粒,能够靶向于炎症损伤黏膜、阻断损伤因子促进愈合因子,对DSS诱导的溃疡性结肠炎和AOM/DSS 诱导的炎症相关结直肠癌均有治疗作用。大枣多糖可以改善TNBS 诱导的结肠炎程度,降低肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β和IL-6 表达,抑制炎性反应,增强肠屏障作用[22]。因此,当归汤提取物(挥发油类、姜辣素类、多糖类等)及其微丸制剂具有预防炎症相关结直肠癌的潜力。
因此,本研究设计DMH/DSS 复合法诱导Wistar 大鼠建立炎症相关结直肠癌模型的不同造模方案,通过对宏观指标的观察和组织病理学检查,判断不同造模方案的造模效果,确定最佳造模方案。并以实验室自制的当归汤提取物及其微丸制剂给药进行药效学评价,通过宏观指标、组织病理学检查、炎症因子指标等,验证造模方法的可行性,以期为口服固体制剂应用于炎症相关结直肠癌预防研究提供实验依据。
1 材料
1.1 仪器
Bio Tek Epoch 全波长酶标仪(美国Bio Tek公司);紫外可见分光光度计(北京普析通用仪器有限责任公司);PB-10 型pH 计、BSA224S型电子天平(北京赛多利斯科学仪器有限公司);TS2-S-SM 光学显微镜(日本尼康公司);ST 8R高速冷冻离心机(美国Thermo 公司)等。
1.2 试药
DMH(梯希爱上海化成工业发展有限公司);DSS(分子量36 000~50 000,美国MP 公司);当归汤提取物、当归汤提取物微丸(实验室自制,当归汤提取物中:藁本内酯含量为142.04 mg·g-1,6-姜辣素含量为81.89 mg·g-1,多糖含量为634.79 mg·g-1;当归汤提取物微丸中:藁本内酯含量为18.63 mg·g-1,6-姜辣素含量为12.62 mg·g-1,多糖含量为246.95 mg·g-1)。福尔马林固定液(北京博奥拓达科技有限公司);生理盐水(石家庄四药有限公司);CMC-Na(天津市福晨化学试剂厂);TNF-α、IL-1β的ELISA 试剂盒(杭州联科生物技术股份有限公司)。
1.3 动物
SPF 级雄性Wistar 大鼠(5~6 周龄),购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。
2 方法
2.1 大鼠DMH/DSS 炎症相关结直肠癌模型的建立
2.1.1 动物造模方法 将40 只雄性Wistar 大鼠在恒温恒湿环境下适应性喂养3 d,随机分为4组,每组10 只。分组及处理方法如下:
① 空白组:不进行DMH/DSS 造模处理,正常摄食饮水。② 模型组1:自第1 周第1日起,每7日腹腔注射40 mg·kg-1DMH(以生理盐水配制,NaHCO3调节pH 至6.5~7.0)一次,第1 周开始2% DSS 自由饮用7 d,蒸馏水自由饮水7 d,上述过程为一个循环(2 周),共重复4 个循环,共8 周。③ 模型组2:第1 周、第5 周、第9 周每周连续腹腔注射40 mg·kg-1DMH 3 次(第1、4、7日)。第2 周开始2% DSS 自由饮用7 d,然后蒸馏水自由饮水7 d,上述过程为一个循环(共2 周),共重复4 个循环,共8 周。④ 模型组3:在模型组1 的基础上将2% DSS 全部换成3%DSS,其他造模步骤相同。实验过程中观察各组大鼠毛发、体质量、大便、耗水、及死亡情况。各组别饲养到第12、13 及14 周时,每周分别处死2 只大鼠进行取材,通过观察结直肠组织病理结果判断取材时间,并于第14 周将所有剩余大鼠进行取材处理。大鼠DMH/DSS 炎症相关结直肠癌模型建立方法如图1所示。

图1 大鼠DMH/DSS 炎症相关结直肠癌模型建立方法Fig 1 Establishment of DMH/DSS inflammation-related colorectal cancer rat models
2.1.2 动物取材与指标观察 动物饲养过程中,每周称量大鼠体质量并记录。观察大鼠健康状况,肛门外观形状、大便、皮毛情况。实验前大鼠禁食24 h,自由饮水,水合氯醛麻醉,腹主动脉取血,剖开大鼠腹腔,取回盲窦处至肛门处的整段结直肠,拍照,径向剖开肠壁,用生理盐水清洗肠内壁粪便。测量长度后,统计肿瘤个数,于肿瘤病灶处剪取10~20 mm 结直肠组织标本,其中包括肿瘤组织及周边正常组织,置 10%中性福尔马林固定液中固定,置于干燥处保存,用于HE 染色实验。
2.1.3 HE 染色与组织病理学诊断 固定于10%中性福尔马林固定液的结直肠组织,经石蜡包埋,切片,HE 染色后,在显微镜下观察组织病理变化,使用光学显微镜观察大鼠结肠组织各项特征,包括黏膜完整性,杯状细胞排列情况,炎性浸润情况,隐窝结构改变,上皮内瘤变的程度及肿瘤的形成情况。根据WHO 消化系统肿瘤分类进行病理诊断,包括低级别上皮内瘤变、高级别上皮内瘤变和腺癌。
2.2 当归汤提取物及其微丸制剂药效学评价
2.2.1 模型建立与实验分组 大鼠适应性饲养后,随机分为4 组,每组6 只:对照组(control)、模型组(model)、当归汤提取物组(简称提取物组,extract)、当归汤提取物微丸组(简称微丸组,pellet)。除对照组外,参照“2.1”项下确定的造模方法,饲养到第14 周取材。对照组在相同时间腹腔注射生理盐水,实验期间自由饮用去离子水。
实验第1日,即第1 次腹腔注射DMH 当日开始灌胃给药,连续给药14 周。微丸组采用自制微丸灌胃装置给药,提取物组使用灌胃针给药。微丸灌胃方法如下:微丸倒入干燥的聚氯乙烯软管中,软管一段连接剪去针尖的注射器,另一端插入0.75% CMC-Na 溶液中,使用注射器吸取0.75% CMC-Na 溶液进入软管,反复推拉注射器活塞排气泡,使微丸均匀分散于0.75% CMCNa 溶液,将软管插入大鼠食道,推动注射器活塞完成灌胃。实验期间,每周监测大鼠体质量,日常观察大鼠精神状态、活动情况与毛发。
2.2.2 动物取材与指标观察 实验第14 周结束时取材,取材前大鼠禁食不禁水24 h,10%水合氯醛(3 mL·kg-1)腹腔注射麻醉后,腹主动脉取血,静置,以3000 r·min-1离心10 min,收集上层血清,-80℃冻存待测;取出肛门至盲肠末端的整个肠段,测量长度;沿纵轴剖开结直肠,冰生理盐水冲洗干净后,用滤纸吸干,对肿瘤个数进行统计,测量肿瘤的长和宽,计算肿瘤体积[23][肿瘤体积=(长×宽2)/2],称量整段结直肠质量;组织固定于10%中性福尔马林固定液中用于HE染色。计算结直肠重量/长度、肿瘤个数、肿瘤体积和肿瘤发生率。
2.2.3 HE 染色及组织病理学诊断 方法同“2.1.3”项下HE 染色及组织病理学诊断。
2.2.4 血清中促炎细胞因子的测定 按照ELISA试剂盒说明书检测血清中促炎细胞因子TNF-α和IL-1β水平。
2.2.5 血清中铁调素的测定 按照ELISA 试剂盒说明书检测血清中铁调素水平。
2.3 统计分析
实验数据表示为mean±SD,使用Graphpad 6.0进行绘图,采用one-way ANOVA 和Dunnetts 多重比较进行统计分析。P<0.05认为差异具有统计学意义。
3 结果
3.1 大鼠DMH/DSS 炎症相关结直肠癌模型的建立
3.1.1 大鼠体质量及一般生活状况 实验过程中,空白组大鼠饮食、饮水正常,毛色光亮,粪便正常,未出现便血、黏液便、萎靡不振、厌食等症状。其他3 组模型组大鼠均出现明显的肛门红肿、肉眼可见便血、毛发干枯、活力下降的情况,无大鼠死亡。其中DSS 给药时便血严重,停止给药后症状缓解。各组大鼠体质量变化曲线如图2。空白组大鼠体质量整体高于各模型组,各模型组之间无明显差异。

图2 各组大鼠体质量变化曲线图Fig 2 Rat mass change curves of each group
3.1.2 宏观指标分析 每组大鼠分别在第12 周取材2 只,空白组大鼠结直肠黏膜组织完整,模型组1 大鼠结肠表面有肉眼可见轻微凸起,无明显菜花状增生组织,黏膜轻微破坏,模型组2 肉眼可见凸起较为严重,黏膜部分破坏,模型组3 肉眼可见凸起、黏膜破坏均较为严重;在第13 周分别取材2 只,发现病理变化不明显,与第12 周相近;饲养至第14 周分别取材2 只发现模型组1、2、3 结肠凸起均明显,且以模型组3 最为严重,因此于14 周全部取材。14 周各组大鼠结直肠长度、肿瘤个数见图3,与空白组相比,各模型组结直肠长度及肿瘤个数差异均具有统计学意义(P<0.01)。
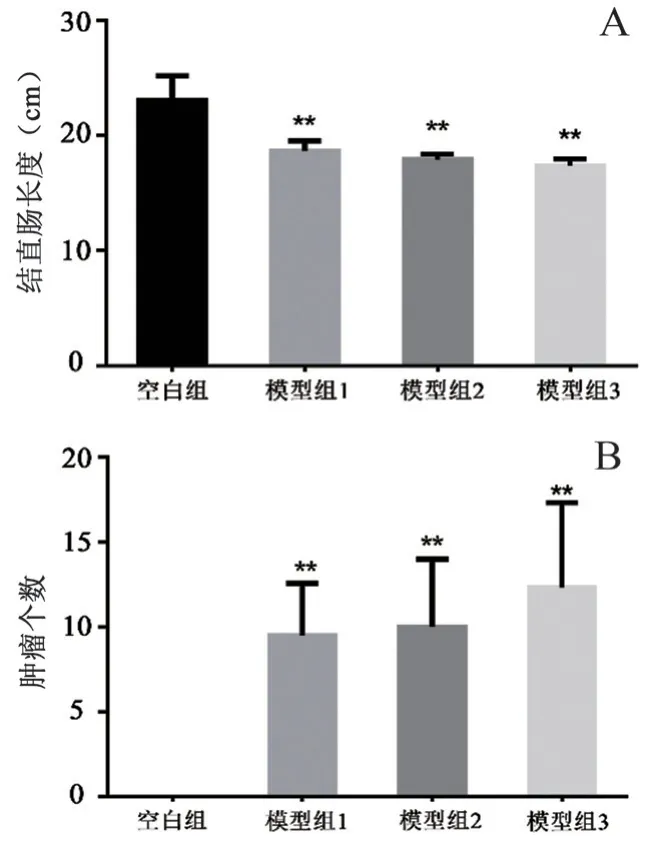
图3 各组大鼠结直肠长度(A)与肿瘤个数(B)(n =6)Fig 3 Rat colorectal length(A)and tumor number(B) of each group(n =6)
3.1.3 组织病理学分析 HE 染色结果显示,第12 周时,空白组黏膜完整,隐窝结构正常,杯状细胞排列整齐,间质内可见少量淋巴细胞浸润;模型组1 大部分黏膜完整,隐窝结构正常,排列整齐,间质内可见少量淋巴细胞和嗜酸性粒细胞浸润,血管充血。黏膜下层可见明显的淋巴滤泡。局灶表面上皮腺体结构不规则,排列紊乱,考虑为炎症反应性改变;模型组2 部分显示低级别上皮内瘤变,部分显示高级别上皮内瘤变,部分显示腺癌,侵至黏膜下层,靠近肠壁固有肌层;模型组3 部分显示高级别上皮内瘤变,部分显示腺癌,侵至黏膜下层。第14 周时,空白组黏膜结构完整,隐窝结构尚可,黏膜间质内可见局灶淋巴细胞浸润及淋巴滤泡形成;模型组1 可见低至中分化腺癌侵袭至浆膜层;模型组2、3 均已发展为腺癌,侵至固有肌层。各类型肿瘤的HE 染色如图4所示。模型组1 与模型组2 比较可知,每周注射一次与一周连续注射三次的方法其模型结果相似,但是实验过程中发现每周注射一次DMH,其大鼠活动状态等相关可视化指标更加稳定,因此,选择每周腹腔注射DMH 一次。大鼠饮用DSS 的浓度、周期与造模结果关系密切,模型组1 中使用2% DSS,于12 周时取材时大鼠的结直肠均处于炎症状态,而14 周时是早期腺癌,推测在12 周至14 周饲养过程中体现“炎-癌转化”的变化过程,模型组3 使用3% DSS,于12周时已经表现出腺癌,说明其在12 周之前已经发生癌前病变,从经济角度和实验周期综合考虑,确定模型组1 的造模方案为最佳造模方案。
3.2 当归汤提取物及其微丸药效学评价
3.2.1 大鼠体质量及一般生活状况 实验过程中,对照组大鼠饮食饮水正常,精神状态良好,活泼好动,毛发有光泽,粪便正常。在饮用2% DSS的第1、3、5、7 周,模型组与各给药组炎症反应明显,均可见不同程度的腹泻和肉眼血便,改为饮用去离子水后,腹泻与肉眼血便情况均得到缓解。如图5所示,各组大鼠体质量在实验周期内均呈上升趋势。模型组大鼠体质量增长最缓,各给药组大鼠体质量在实验结束时均高于模型组。
3.2.2 结直肠重量/长度 疾病状态下结直肠缩短和/或肿瘤生成均会引起结直肠重量/长度比值增大,一定程度上可以反映疾病的严重程度。各组大鼠结直肠重量/长度见图6。由图6可知,与对照组相比,模型组大鼠的结直肠重量/长度显著增加(P<0.01);各给药组大鼠的结直肠重量/长度与模型组相比显著降低(P<0.01),而与对照组之间差异无统计学意义,其中微丸组的结直肠重量/长度与对照组最接近。
3.2.3 肿瘤发生情况和组织病理学分析 各组大鼠结直肠宏观状态见图7,肿瘤个数和体积见图8,肿瘤发生率见表1。对照组大鼠结直肠黏膜完整光滑,没有肿瘤发生;模型组大鼠结直肠均肉眼可见肿瘤状突起,平均肿瘤数为(9.83±4.22)个,平均肿瘤体积为(199.49±97.28)mm3,肿瘤发生率为100%(6/6)。与模型组相比,提取物组和微丸组大鼠的肿瘤个数显著减少(P<0.01),肿瘤体积显著减小(P<0.01,P<0.0001),肿瘤发生率(均为66.7%)降低,且微丸组效果优于提取物组。

表1 各组大鼠肿瘤发生率(n =6,%)Tab 1 Tumor incidence rate of rats of each group (n =6,%)
结直肠组织HE 染色结果显示,对照组大鼠结直肠组织黏膜完整,隐窝结构正常,排列整齐,杯状细胞充足,有少量炎性细胞浸润,没有肿瘤发生。模型组与各给药组的肿瘤恶性程度有所差异,模型组均为腺癌,可见低至中分化腺癌侵袭至浆膜层;提取物组和微丸组肿瘤均截止至上皮内瘤变阶段,微丸组仅可见低级别上皮内瘤变,其肿瘤恶性程度改善效果最好。
3.2.4 大鼠血清炎症因子水平 各组大鼠血清中TNF-α和IL-1β水平见图9。与对照组相比,模型组大鼠血清中TNF-α和IL-1β水平显著升高(P<0.01)。与模型组相比,各给药组大鼠血清中两种炎症因子水平显著降低(P<0.01)。微丸组的两种炎症因子水平低于提取物组,且差异具有统计学意义(P<0.05)。
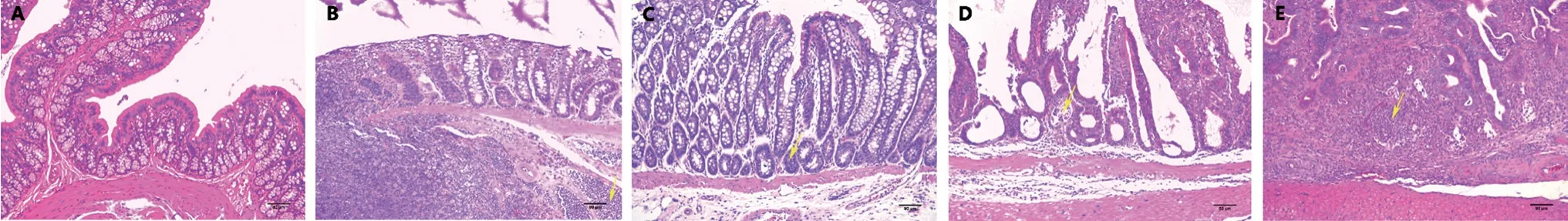
图4 各类型结直肠病理变化HE 染色切片图像(×100)Fig 4 Image of HE staining slices of pathological changes in colorectal tissue(×100)

图5 各组大鼠体质量变化曲线(n =6)Fig 5 Rat mass change curves of each group(n =6)

图6 各组大鼠结直肠重量/长度(n =6)Fig 6 Colorectal weight/length of rats of each group(n =6)

图7 各组大鼠结直肠宏观形态Fig 7 Colorectal macromorphology of rats of each group
3.2.5 大鼠血清铁调素水平 各组大鼠血清铁调素表达情况见图10。与对照组相比,模型组大鼠血清铁调素含量显著增加(P<0.01)。与模型组相比,提取物组与微丸组的铁调素水平均显著降低(P<0.01)。同时微丸组的铁调素水平低于提取物组,且差异具有统计学意义(P<0.05)。

图8 各组大鼠肿瘤个数(A)与肿瘤体积(B)(n =6)Fig 8 Tumor number(A)and tumor volume(B)of rats of each group(n =6)
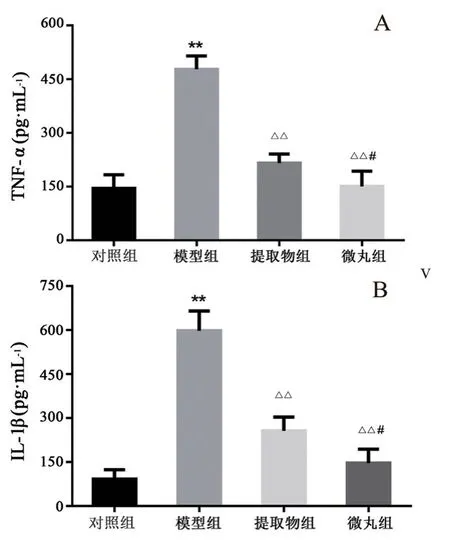
图9 各组大鼠血清炎症因子TNF-α(A)、IL-1β(B)(n =6)Fig 9 Inflammatory cytokines TNF-α(A)and IL-1β(B)in the serum of rats of each group(n =6)

图10 各组大鼠血清铁调素(n =6)Fig 10 Serum hepcidin of rats of each group(n =6)
4 讨论
近年来炎症相关的散发性结肠癌动物模型得到了很快的发展,以化学诱导类模型的应用最为普遍,DMH/AOM 联合DSS 是常用的化学诱导剂,此类模型具有简单易行,重现性好,具有与人类溃疡性结肠炎癌变相似的特点,是其发病机制研究及防治药物疗效评估的比较理想的实验动物模型[24-25],目前主要使用小鼠作为研究对象,然而小鼠模型应用于以微丸为代表的口服固体制剂的药效研究具有局限性,大鼠模型文献虽然有报道,但是造模方法差异大,因此探索大鼠炎症相关结直肠癌模型造模方法同样具有重要的研究意义。
在前期实验中参考课题组建立的小鼠模型造模方法[17,26]及文献报道的大鼠造模方法[15],使用SD 大鼠进行造模均未能成功复制模型,可能与SD 大鼠适应性及抗病能力较强有关[27]。通过相关文献研究,拟确定使用DMH/DSS 化学诱导法建立炎症相关结直肠癌Wistar 大鼠模型,并拟定不同的造模方案。通过预实验可以大致确定取材时间为12 周至15 周,因此从第12 周开始每周随机选取2 只大鼠进行取材判断造模效果,至明显病变周期时结束饲养。从空白组和各模型组大鼠实验结果可以看出,DMH/DSS 联合诱导能够建立炎症相关结直肠癌模型,40 mg·kg-1剂量的DMH 能够有效发挥致癌作用,且随着注射次数增加,致癌作用明显。同时在前期预实验中发现Wistar 大鼠、F344 大鼠均能建立较为稳定的炎症相关结直肠癌模型,而Wistar 大鼠更为经济,且同一周龄其体型比F344 大鼠大,更适合用于以微丸为代表的口服固体制剂研究,因此考虑以Wistar 大鼠作为造模对象。
基于所确定的DMH/DSS 诱导的大鼠炎症相关结直肠癌模型造模方法,通过实验室自制的当归汤提取物及其微丸制剂的药效学研究验证造模方法的可行性。结果显示,模型组平均肿瘤数、平均肿瘤体积、肿瘤发生率均高于其他组,肿瘤已发展至腺癌阶段,其中平均肿瘤数为(9.83±4.22)个。药物干预能够减少结直肠肿瘤个数和体积,降低肿瘤发生率,延缓癌症发展程度,其中微丸组对DMH/DSS 诱导的大鼠炎症相关结直肠癌发生发展的预防作用比提取物组效果更明显,肿瘤截止至低级别上皮内瘤变阶段。本文以TNF-α、IL-1β为指标,从抑制炎症反应角度探讨预防结直肠癌的作用机制。促炎细胞因子TNF-α与IL-1β是促进炎症相关结直肠癌发生发展的重要介质,即使结直肠癌已经发生,阻断TNF-α也可以抑制其进展,提示靶向于TNF-α的药物可能对溃疡性结肠炎引起的结直肠癌具有治疗作用[28]。中性粒细胞浸润是慢性结肠炎及相关结直肠癌的重要特征,浸润的中性粒细胞能够分泌大量的IL-1β,阻断IL-1β活性可以显著减少黏膜损伤及肿瘤形成[29]。本研究结果表明,DMH/DSS 诱导的炎症相关结直肠癌模型大鼠血清中TNF-α和IL-1β水平显著升高,经药物干预后,两者水平明显降低,其中微丸组的作用最明显。此外,铁代谢异常与肿瘤的发生发展密切相关。铁调素是铁代谢的关键调节因子,在多种类型癌症患者体内存在高表达,如乳腺癌、肾癌、肺癌、前列腺癌、胃癌和结直肠癌[30],因此本文以铁调素为指标,尝试从调节铁代谢角度探讨预防结直肠癌的作用机制。结果表明,DMH/DSS 诱导的炎症相关结直肠癌模型大鼠血清中铁调素水平显著升高,微丸组在改善铁调素表达方面的作用优于提取物组。
综上所述,本研究建立的炎症相关结直肠癌大鼠模型,其造模方法简单易行,重现性好,能够用于口服固体制剂的药效学研究,可以为炎症相关结直肠癌防治药物(尤其是口服固体制剂)的筛选与评价提供一定的实验数据支持与参考。

