装载雷公藤甲素的金属有机骨架材料ZIF-8的制备、表征及优化研究
唐子琰,曾亚文,倪健,2*,董晓旭*(.北京中医药大学中药学院,北京 02488;2.北京中医药大学中医药研究院,北京 00029)
雷公藤(Tripterygium wilfordiiHook.f.)是卫矛科雷公藤属植物,有清热解毒、祛风通路、消肿止痛之功,雷公藤甲素是从其中提取的一种环氧二萜内酯化合物,有显著的抗肿瘤活性[1-2]。但传统雷公藤甲素制剂水溶性较差、生物利用度低、给药后被机体迅速吸收并被快速消除导致了其急性毒性的产生[3-4]。近年来,各种纳米给药系统的出现为解决上述问题提供了新思路,如聚合物胶束、脂质体、纳米水凝胶以及固体脂质纳米粒等[5-6]。但以上载体通常载药量较低,只适于装载特定性质的药物,例如聚合物胶束和固体脂质纳米粒适合装载脂溶性药物。因此寻找适宜的载药系统,来实现药物的高效装载以及满足临床用药需求是有意义的。
金属有机骨架材料(MOFs)是一种配位聚合物材料,其由无机金属离子与有机配体构成,具有结构多样性、比表面积高、生物相容性好、不饱和金属配位点多等特点,在吸附[7]、催化[8]、载药[9]等方面有很大应用前景。沸石型咪唑酯骨架材料(ZIFs)是MOFs 的一种,由过渡金属原子与有机咪唑类及其衍生物自组装形成的拓扑结构纳米材料。其中ZIF-8 作为ZIFs 典型代表,其有很好的水热稳定性、化学稳定性,较大的比表面积,较高的pH敏感性,开放的金属位点,使其在药物储存和递送方面具有广阔的应用前景。周伟强等[10]的研究中,含硒高分子与ZIF-8 复合材料多级响应释放药物分子阿霉素,在低pH 值下阿霉素具有更好的选择性释放。曹鑫[11]研究表明,与SM-PGMA 相比,ZIF-8@SM-PGMA 的比表面积从34 m2·g-1提高到172 m2·g-1,平均孔径从14.24 nm 缩小为5.16 nm,在水溶液中对苯酚的吸附量从23 mg·g-1提高到53 mg·g-1,提高了药物吸附量,对拓展金属有机骨架复合材料有意义。刘策等[12]实验表明,DOX@ZIF-8 在酸性环境中释放效率明显快于在中性环境中的释放效率,呈现出优异的酸响应释放性能。
基于以上思路,本研究制备金属有机骨架药物载体ZIF-8,考察ZIF-8 的不同制备工艺(物理搅拌法,超声法及水热合成法),对制备材料的结构和形貌进行表征,并用其装载雷公藤甲素,确定最佳载药工艺。
1 仪器与试药
六水硝酸锌(纯度>99.99%)、二甲基咪唑(纯度>99%)(阿拉丁试剂上海有限公司);雷公藤甲素(纯度:98%,南通飞宇生物科技有限公司);甲醇、磷酸(分析纯,北京化工厂);Ultimate 3000 高效液相色谱仪(美国赛默飞世尔科技有限公司);SB-5200 DTD 超声波清洗机(宁波新芝生物科技股份有限公司);XP 26 型电子分析天平(梅特勒-托利多仪器有限公司);SHA-BA恒温水浴振荡器(常州市国旺仪器制造有限公司)。
2 方法与结果
2.1 ZIF-8 材料的合成
2.1.1 水热合成法制备ZIF-8 取Zn(NO3)2·6H2O(1 mmol)和二甲基咪唑(4 mmol),溶解于20 mL 甲醇中,转移至聚四氟乙烯内衬的高压反应釜中,单因素考察反应温度(130、150、170℃)对ZIF-8 合成的影响。反应结束后,冷却至室温,离心(10 000 r·min-1,10 min),用甲醇洗涤沉淀,真空干燥(110℃,24 h),即得,计算产率,产率=产品量/投药量×100%。
结果显示,130、150、170℃时ZIF-8 的产率(w%)分别为7.30%、5.50%、25.40%。在170℃时,产品颜色深,可能为原料在高温下碳化,在使用水热合成法时温度应控制在产品无异常颜色变化内。
2.1.2 超声合成法制备ZIF-8 精密称取Zn(NO3)2·6H2O(1 mmol)和二甲基咪唑(4 mmol),溶解于20 mL 甲醇中,单因素考察超声时间(0.5、1、2 h)对ZIF-8 合成的影响。室温下反应结束后,离心(10 000 r·min-1,10 min),用甲醇洗涤沉淀,真空干燥(110℃,24 h),即得,计算产率。
结果显示,超声时间为0.5、1、2 h 时ZIF-8 的产率(w%)分别为11.01%、10.98%、11.94%。结果表明,随着超声时间的延长,ZIF-8 产率变化不大,说明在超声0.5 h 时ZIF-8 就已经基本合成,在之后的时间里处于解体再合成的动态平衡中。
2.1.3 物理搅拌法制备ZIF-8 精密称取Zn(NO3)2·6H2O(1 mmol)和二甲基咪唑(4 mmol),溶解于20 mL 甲醇中,超声功率为250 W,置磁力搅拌器反应(600 r·min-1),单因素考察搅拌时间(12、24、48 h)对ZIF-8 合成的影响。室温下反应结束后,离心(10 000 r·min-1,10 min),用甲醇洗涤沉淀,真空干燥(110℃,24 h),即得,计算产率。
结果显示,搅拌12、24、48 h 时ZIF-8 的产率(w%)分别为10.66%、10.02%、13.04%,在48 h 时产率最高。可能随着搅拌时间的延长,增加了金属簇与有机配体接触的概率,ZIF-8 的产率增加,新生成的小粒子可以在晶体上继续叠加。
2.2 ZIF-8 材料的表征
2.2.1 X 射线衍射(XRD) 用粉末X 射线衍射测定ZIF-8 晶体的分散状态和晶体结构。在Cu-Kα(λ=1.541 nm),高压40 kV,管流40 mA,扫描速度2°·min-1,2θ=5~45°条件下进行X-ray 粉末衍射,得到衍射图谱。
3 种方法制备的ZIF-8 衍射峰均很强,说明材料具有较高的结晶度,由于物理搅拌法和超声法得到的材料产率较高且较稳定,且材料粉末烘干后无明显因高温而产生的焦化现象,故对搅拌法和超声法的材料进行XRD 表征。结果物理搅拌法搅拌12、24、48 h 时衍射峰无明显差异;超声法中超声30 min、1 h、2 h 衍射峰具有明显差异,且随着超声时间的延长,ZIF-8 特征峰越明显(见图1)。与此同时,不同制备方法合成的ZIF-8 的特征峰与模拟的ZIF-8 XRD 图谱一致,这表明ZIF-8 晶体均已成功合成。
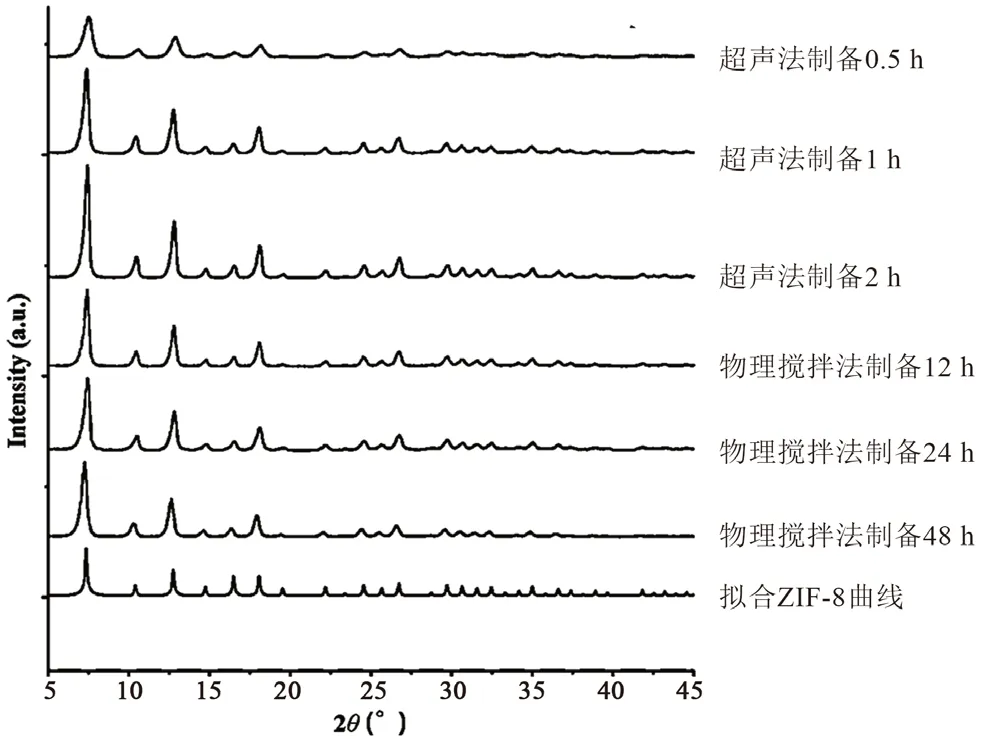
图1 不同方法合成ZIF-8 的XRD 图谱Fig 1 XRD patterns of the synthesis of ZIF-8 by different methods
2.2.2 扫描电子显微镜(SEM) 精密称取ZIF-8 材料,用双碳胶带固定,在样品表面喷碳25 min 后,扫描电子显微镜下观察材料形貌特征,记录SEM 图谱。
由图2~4 可知,水热合成法中随着反应温度的上升,ZIF-8 晶体逐渐致密。110 ℃时有大块状的晶体;130 ℃时,晶体为规则的立方体,表面平滑整洁。但随着温度的上升,在150、170 ℃在晶体表面出现了凹痕和塌陷。温度过高或者过低都会影响ZIF-8 晶体形貌,适宜的温度应为130 ℃。超声法中超声0.5、1、2 h 制备的ZIF-8 晶体均为立方体,但与水热合成法和物理搅拌法相比,晶体特征不明显,周围分散的尺寸也各异。物理搅拌法制备的ZIF-8 晶体最优,且随着搅拌时间的延长,晶体越来越立方化,且更加致密。

图2 水热合成法不同温度下合成的ZIF-8 晶体形貌Fig 2 ZIF-8 crystal by hydrothermal synthesis method at different temperature

图3 超声法超声不同时间合成的ZIF-8 晶体形貌Fig 3 ZIF-8 crystal synthesized by ultrasonic method in different time
2.2.3 比表面积仪(BET) 精密称取ZIF-8 样品30 mg,置于干燥的样品管和编号的橡胶塞。对样品预处理,抽真空、加热、冷却。预处理过的样品垂直插入装备液氮的比表面积仪,通过Gemini Ⅱ软件设置参数,测定比表面积。

图4 物理搅拌法搅拌不同时间合成的ZIF-8 晶体形貌Fig 4 ZIF-8 crystal synthesized by physical stirring method in different time
3 种制备方法制备ZIF-8 MOFs 的比表面积与孔体积有明显差异,见表1。其中,物理搅拌法制备的ZIF-8 比表面积最大,孔径适中,可能具备较优的载药性能,且耗能较低操作步骤较少,综合XRD 及SEM 的结果,后续研究均采用物理搅拌法制备的ZIF-8。
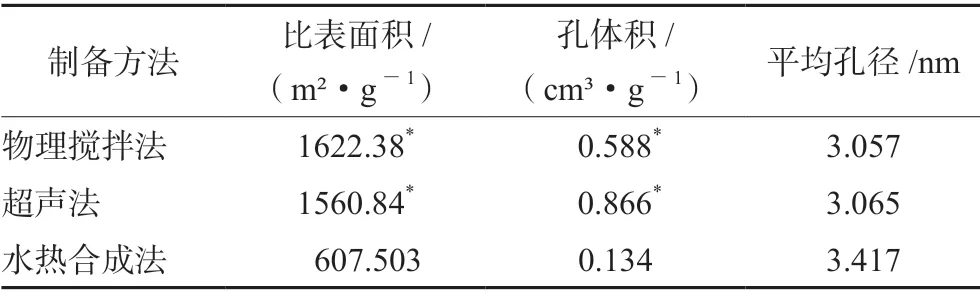
表1 3 种制备方法合成ZIF-8 的BET 参数Tab 1 BET parameters of ZIF-8 MOFs synthesized by 3 preparation methods
2.2.4 红外分光光度计(FTIR) 精密称取ZIF-8 样品2 mg,加溴化钾分散,干燥压片,在4000~500 cm-1范围内测定IR 光谱。
图5结果表明:在3130 cm-1和2930 cm-1的吸收振动峰是CH3基团中C-H 键的不对称吸收振动峰,500~1500 cm-1的吸收振动峰归属于咪唑环的面内弯曲振动吸收和伸缩振动吸收,其中1150 cm-1和991 cm-1处的吸收峰为咪唑环上的C-N 的伸缩振动峰,说明ZIF-8 材料保留着咪唑环的结构。1580 cm-1的吸收振动峰由C-N 键的伸缩振动引起的,420 cm-1处的振动峰是Zn-N键的伸缩振动造成的。

图5 物理搅拌法合成的ZIF-8 的FTIR 图谱Fig 5 FTIR diagram of ZIF-8 synthesized by physical stirring method in different time
2.3 ZIF-8 装载雷公藤甲素的研究
2.3.1 雷公藤甲素色谱条件 色谱柱:Agilent Eclipse Plus C18(4.6 mm×250 mm,5 μm);流动相:甲醇-水(50∶50),等度洗脱;检测波长:218 nm;流速:1.0 mL·min-1;柱温:25℃;进样量:10 μL。
2.3.2 雷公藤甲素线性考察 精密称取雷公藤甲素10.00 mg,置10 mL 量瓶中,加入甲醇定容至刻度,制得1.00 mg·mL-1的雷公藤甲素母液。另精密量取母液适量,加入甲醇稀释依次制备成质量浓度为0.5、0.25、0.2、0.1、0.05 mg·mL-1的雷公藤甲素工作溶液。按“2.3.1”项下色谱条件测定峰面积,以对照品质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。
雷公藤甲素对照品HPLC 图谱见图6。雷公藤甲素的回归方程为y=316.18x+0.0727(R2=0.9997),表明雷公藤甲素质量浓度在0.05~1.00 mg·mL-1与峰面积线性关系良好。经方法学验证,仪器精密度、方法重复性、准确度和样品稳定性均符合含量测定要求。
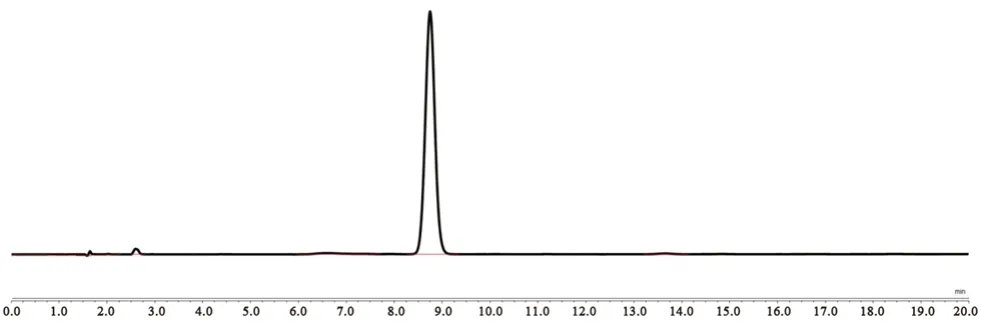
图6 雷公藤甲素对照品色谱图Fig 6 HPLC chromatogram of triptolide
2.3.3 正交优选最佳载药工艺 称取适量的ZIF-8 与不同质量浓度的雷公藤甲素溶液,加入甲醇中搅拌反应(600 r·min-1)不同时间,离心(4800 r·min-1,10 min),用甲醇洗涤沉淀2 次,收集上清液进样检测雷公藤甲素含量。以载药量与包封率为指标,筛选最佳载药工艺。分别考察影响载药量的三个因素:载药时间、药物质量浓度、药载比,各因素设三个水平,采用L9(3)4试验设计,因素水平表见表2。载药量=(投药量-上清量)/ZIF-8 总量×100%,包封率=(投药量-上清量)/投药量×100%。
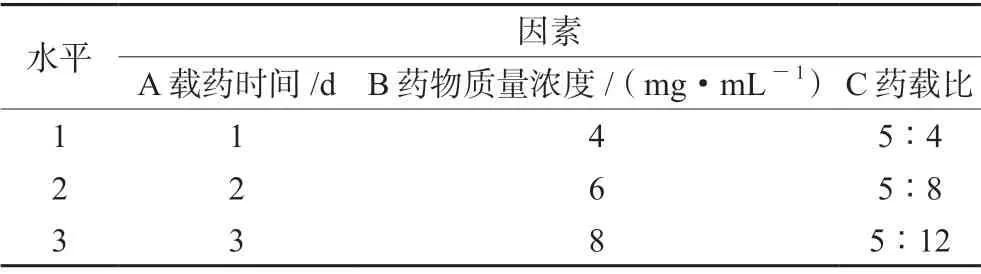
表2 因素水平表Tab 2 Factor level table
表3结果显示,ZIF-8 载雷公藤甲素最佳工艺为A3B2C3,即载药时间3 d,药物浓度6 mg·mL-1,药载比为5∶12 时,载药量最高。表4结果表明,载药量影响因素为C(药载比)>B(药物浓度)>A(载药时间),其中药载比对载药工艺有显著影响(P<0.05)。
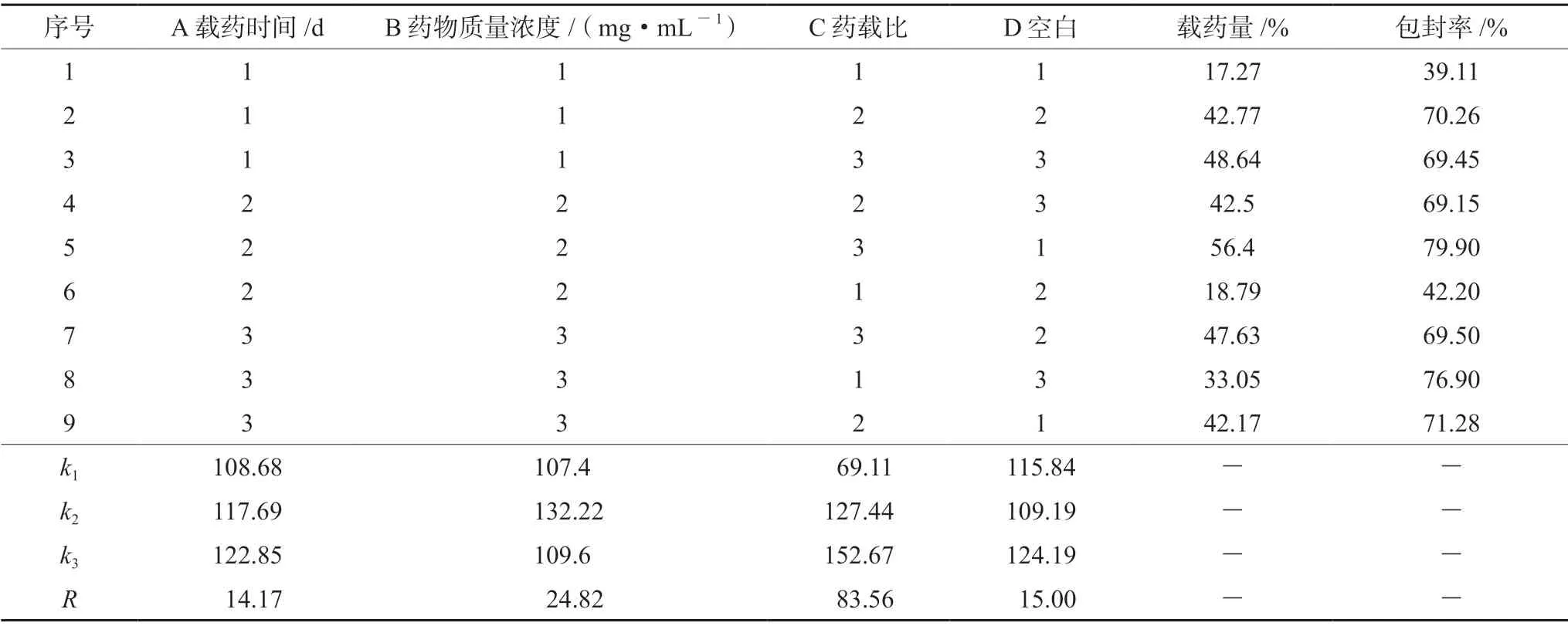
表3 雷公藤甲素载药工艺直观分析表Tab 3 Orthogonal intuitive analysis of triptolide loading process
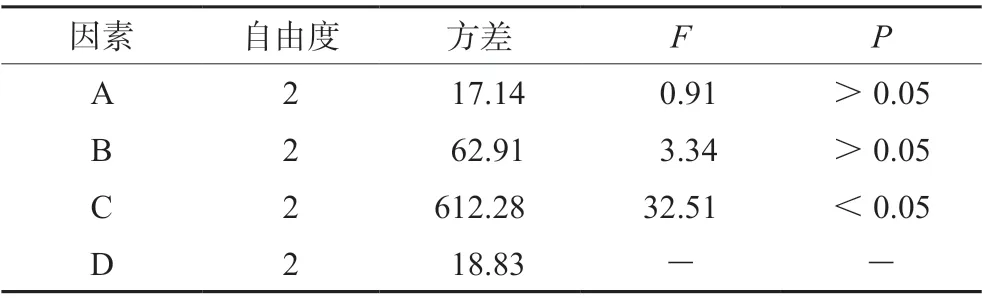
表4 载药工艺方差分析表Tab 4 Variance analysis table of loading process
按优选条件进行3 批样品验证,3 批样品载药量分别为50.33%、49.16%、50.13%,均值为(49.87±1.26)%,包封率分别为71.31%、69.64%、71.02%,均值为(70.66±1.26)%。表明正交优化的ZIF-8 载雷公藤甲素工艺稳定可行。
3 讨论
课题组前期研究发现,当金属离子(六水合硝酸锌)与有机配体(2-甲基咪唑)为4∶1 时,以甲醇为溶剂制备ZIF-8 晶体形貌较好,且孔径较大。3 种方法均可成功制备ZIF-8,但超声法、水热合成法制备的晶体形貌不稳定,易受温度的影响,并伴随较高的能耗。物理搅拌法制备的ZIF-8 晶体形貌较优且稳定,比表面积最大,利于后续药物的高效装载,因此选用物理搅拌法制备ZIF-8 来进行后续载药研究。
载药工艺研究中,通过预试验发现药载比、药物浓度和载药时间为影响载药量的主要影响因素,因此本文以此为考察对象,设计正交试验优化最优载药工艺。结果显示,最优载药工艺的载药量达到(49.87±1.26)%,包封率为(70.66±1.26)%,且载药工艺稳定可行。

