龙生蛭胶囊中“黄芪-当归-刺五加”药组治疗PSCI的动物实验研究及其作用机制的整合药理学发掘与预测
王珊,刘亚倩,侯敏娜,王青,刘艳红,陈衍斌,彭修娟,许海燕*(.陕西国际商贸学院,陕西 咸阳 7046;.陕西步长制药有限公司,西安 70075)
脑卒中后PSCI(post-stroke cognitive impairment,PSCI)泛指在卒中后6 个月内出现认知障碍表现的一系列综合征,其会影响患者的记忆力、执行力,增加致残率、病死率、卒中再发率,严重影响患者的日常生活,降低患者生活质量,严重者可发展为阿尔茨海默症(AD),给患者家庭和社会带来巨大的经济负担[1]。中医将PSCI 归于呆病范畴,认为其病位在脑,关乎肝、肾、心、脾,肾亏为本,五脏相关;以精亏为本,以痰瘀为标;以肾精亏虚、气血亏虚、痰浊阻窍、瘀血阻络为临床常见证型[2]。中医治疗以补肾填精、活血化瘀、开窍化痰为主[1]。龙生蛭胶囊是由黄芪、水蛭、川芎、当归、红花、地龙、刺五加等12 味中药组成的中成药制剂,具有补气活血、逐瘀通络的功效,临床主要应用于动脉粥样硬化性脑梗死的恢复期,中医辨证为气虚血瘀型中风经络者的治疗[3]。龙生蛭胶囊自上市后在治疗脑卒中及防止、减轻PSCI 方面疗效确切,安全性高,临床反应良好,尤其是对气虚血瘀型血管性痴呆患者认知功能改善方面效果极佳[4-6]。但是目前有关龙生蛭胶囊治疗PSCI 的作用机制研究甚少。根据中医理论可将龙生蛭胶囊方中各药分为活血化瘀药(水蛭、川芎、红花、桃仁),补虚药(黄芪、当归、刺五加),清热药(赤芍),其他药(木香、石菖蒲、地龙、桑寄生)。结合PSCI 发病机制其以虚证为本的中医病机,本文推测龙生蛭胶囊具有防治PSCI 的作用机制可能与方中补虚药组有紧密的相关性。因此本研究尝试通过拆方的形式,以方剂中补虚药组—— “黄芪-当归-刺五加”为研究对象,通过动物实验结合网络预测的形式来揭示龙生蛭胶囊治疗PSCI 的作用机制,为龙生蛭胶囊的进一步开发利用提供理论依据。
1 材料与方法
1.1 “黄芪-当归-刺五加”药组治疗PSCI 的实验研究
1.1.1 材料 “黄芪-当归-刺五加”药组(黄芪、当归、刺五加3 味药的剂量同方剂中的剂量,由陕西步长制药提供,经陕西国际商贸学院雷国莲教授鉴定)。尼莫地平片(天津市中央药业有限公司,批号: 170618);丙二醛(MDA,批号:20160901)、超氧化物歧化酶(SOD,批号:20160919)试剂盒(南京建成生物工程研究所);Morris 水迷宫视频跟踪系统(成都泰盟)。
1.1.2 动物分组、造模期药物干预 60 只健康雄性SPF 级SD 大鼠[西安交通大学医学院实验动物中心,动物许可证号 SYXK-R(陕)2012-003],体质量(220±23)g,动物实验经陕西国际商贸学院实验动物伦理委员会批准。大鼠适应性饲养1周后按照体质量随机分组,分为模型组,假手术组,尼莫地平组,龙生蛭胶囊高、中、低剂量组。采用血管内拴线阻断法永久性阻断左侧大鼠大脑中动脉,制成大鼠脑缺血性中风模型[7-8]。假手术组大鼠进行相同操作,但不夹闭血管,不插入栓线。手术后出现对侧的前爪无法充分伸展活动、出现向外侧转圏、无法正常行走或行走时向对侧倾倒的大鼠认为造模成功,并进行下一步的实验研究。
模型组灌胃给予10 mL·kg-1的生理盐水;尼莫地平组灌胃给予1.2 g·L-1的尼莫地平混悬液;“黄芪-当归-刺五加”药组给药量根据临床常用剂量,按照人和动物间体表面积折算的等效剂量比值进行换算,分别得到“黄芪-当归-刺五加”药组低剂量 0.24 g·kg-1、中剂量0.48 g·kg-1、高剂量 0.96 g·kg-1。每日灌胃1 次,共灌胃12 d,从给药第 10日起按照学习记忆训练的方法进行训练,连续训练3 d;于给药第 12日进行水迷宫检测实验。
1.1.3 Morris 水迷宫实验 实验分为定位航行实验和空间探索实验两部分,实验前先进行训练3 d。大鼠每日训练一次,分别从4 个不同入水点面壁入水。定位航行实验:每只大鼠从任意一个入水点入水,记录大鼠120 s 内找到平台所需的时间(即潜伏期),若120 s 内没有找到平台,逃避潜伏期计为120 s。空间搜索实验:定位航行实验 3 h 后撤出平台,由任意一个入水点将大鼠面向池壁放入水中。记录大鼠120 s 内穿过原平台位置的次数和在原平台象限游泳时间占总时间(120 s)的百分比。
1.1.4 血清SOD 活性和MDA 含量检测 实验结束后,麻醉大鼠,腹主动脉取血,离心取血清,按照试剂盒方法测定SOD 活性和MDA 含量。
1.2 基于TCMIP V2.0 分析“黄芪-当归-刺五加”药组治疗PSCI 的作用机制
1.2.1 化学成分来源 在TCMIP V2.0 平台(www.tcmip.cn)的中药材数据中搜索“黄芪”“当归”和“刺五加”,收集3 种中药材的化学成分及所对应的靶标,建立龙生蛭胶囊中“黄芪-当归-刺五加”药组的化学成分数据库。
1.2.2 候选靶标来源 在TCMIP V2.0 平台的疾病分子相关数据库中,以“post-stroke cognitive impairment”作为疾病关键词进行搜索,收集PSCI 的所有靶标,作为候选疾病靶标。在中药靶标预测功能模块中通过化学成分二维结构(.mol或.sdf)相似性与美国食品药品管理局(FDA)上市药物进行比对,以Tanimoto 系数定义的相似度计量方法进行相似性打分,选择相似性分数≥0.8的药物所对应的靶标为“黄芪-当归-刺五加”药组潜在候选靶标。
1.2.3 网络构建和关键网络靶标基因功能挖掘分析 通过TCMIP V2.0 平台中的中医药关联网络挖掘工具,基于目标疾病基因(PSCI)和中药(黄芪-当归-刺五加)候选靶标之间的相互作用信息,可构建“疾病基因-药物靶标分子网络”。该平台通过计算网络节点的连接度(Degree)、介度(Betweenness)和紧密度(Closeness),筛选网络中的核心节点基因,并实现核心节点网络的可视化。根据中药材-中药成分-核心靶标-通路-疾病之间的关联性,任意选择不同类型的节点,构建多维关联网络图并对其进行分析挖掘得到“黄芪-当归-刺五加”干预PSCI 的可能有效成分、靶标及通路。
2 结果
2.1 “黄芪-当归-刺五加”药组治疗PSCI 的实验研究
2.1.1 对脑卒中大鼠行为学的影响 在定位航行实验中,与假手术组相比,模型组大鼠的逃避潜伏期显著延长、寻台次数均明显减少;与模型组相比,尼莫地平组、“黄芪-当归-刺五加”药组各剂量组的逃避潜伏期显著缩短,尼莫地平组和“黄芪-当归-刺五加”药组中剂量组寻台次数均明显增加。在空间探索实验中,与假手术组比较,模型组穿越原平台次数、原平台象限游泳时间占总游泳时间百分比均显著减少;与模型组比较,尼莫地平组和“黄芪-当归-刺五加”药组中剂量组穿越原平台次数均明显增加,尼莫地平组和“黄芪-当归-刺五加”药组各剂量原平台象限游泳时间占总游泳时间百分比均明显增加,结果见表1。
表1 “黄芪-当归-刺五加”药组对大鼠水迷宫实验的影响(±s,n =10)Tab 1 Effect of Astragalus-Angelica sinensis-Schisandra chinensis drug group on Morris water maze test in rats (±s,n =10)
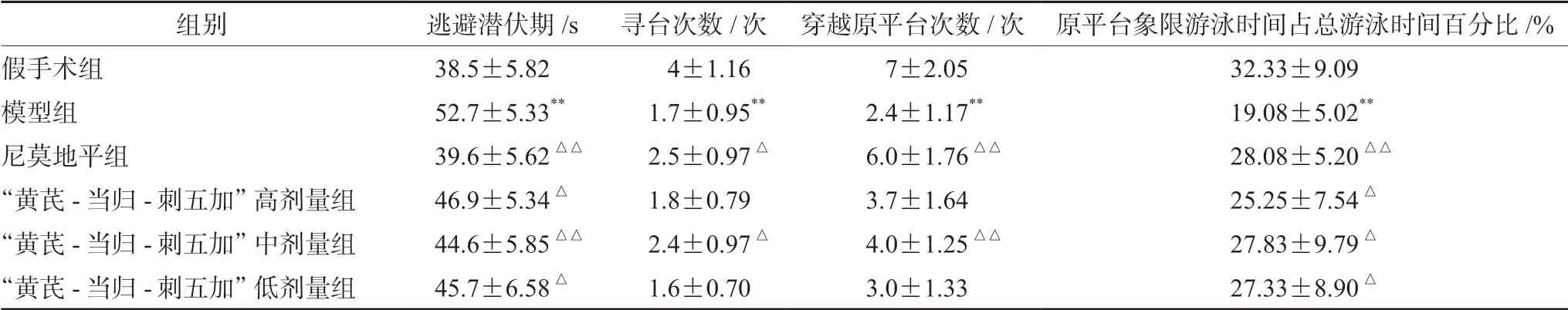
表1 “黄芪-当归-刺五加”药组对大鼠水迷宫实验的影响(±s,n =10)Tab 1 Effect of Astragalus-Angelica sinensis-Schisandra chinensis drug group on Morris water maze test in rats (±s,n =10)
注:与假手术组比较,**P <0.01;与模型组比较,△P <0.05,△△P <0.01。Note:Compared with the sham group,**P <0.01;compared with the model group,△P <0.05,△△P <0.01.
组别 逃避潜伏期/s 寻台次数/次 穿越原平台次数/次 原平台象限游泳时间占总游泳时间百分比/%假手术组 38.5±5.82 4±1.16 7±2.05 32.33±9.09模型组 52.7±5.33** 1.7±0.95** 2.4±1.17** 19.08±5.02**尼莫地平组 39.6±5.62△△ 2.5±0.97△ 6.0±1.76△△ 28.08±5.20△△“黄芪-当归-刺五加”高剂量组 46.9±5.34△ 1.8±0.79 3.7±1.64 25.25±7.54△“黄芪-当归-刺五加”中剂量组 44.6±5.85△△ 2.4±0.97△ 4.0±1.25△△ 27.83±9.79△“黄芪-当归-刺五加”低剂量组 45.7±6.58△ 1.6±0.70 3.0±1.33 27.33±8.90△
2.1.2 对脑卒中大鼠血清生化学的影响 与假手术组相比,模型组SOD 活性显著降低、MDA 含量显著升高;与模型组比较,尼莫地平组、“黄芪-当归-刺五加”各剂量组能明显提高SOD 活性和降低MDA 含量,结果见表2。
表2 “黄芪-当归-刺五加”药组对大鼠血清中SOD、MDA 水平的影响(±s,n =10)Tab 2 Effect of Astragalus-Angelica sinensis-Schisandra chinensis drug group on SOD and MDA of rats serum(±s,n =10)
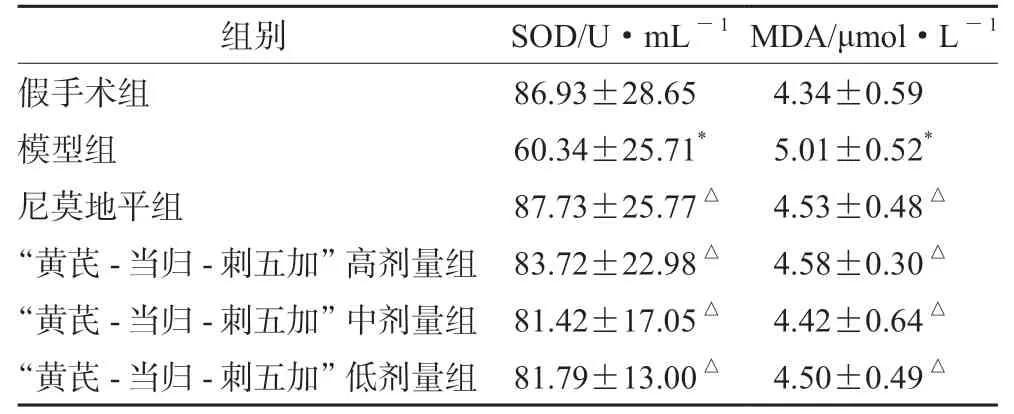
表2 “黄芪-当归-刺五加”药组对大鼠血清中SOD、MDA 水平的影响(±s,n =10)Tab 2 Effect of Astragalus-Angelica sinensis-Schisandra chinensis drug group on SOD and MDA of rats serum(±s,n =10)
注:与假手术组比较,*P <0.05;与模型组比较,△P <0.05。Note:Compared with the sham group,*P <0.05;compared with the model group,△P <0.05.
组别 SOD/U·mL-1MDA/μmol·L-1假手术组 86.93±28.65 4.34±0.59模型组 60.34±25.71* 5.01±0.52*尼莫地平组 87.73±25.77△ 4.53±0.48△“黄芪-当归-刺五加”高剂量组 83.72±22.98△ 4.58±0.30△“黄芪-当归-刺五加”中剂量组 81.42±17.05△ 4.42±0.64△“黄芪-当归-刺五加”低剂量组 81.79±13.00△ 4.50±0.49△
2.2 龙生蛭胶囊中“黄芪-当归-刺五加”药组治疗PSCI 作用机制的整合药理学分析
2.2.1 “黄芪-当归-刺五加”药组治疗PSCI 的“药物靶标-疾病靶标”核心网络分析 共得到166 个与认知障碍以及药物相关核心网络靶标,其中药物相关靶标48 个,与疾病相关靶标118 个。同时利用 PPI 模块构建核心网络靶标图(见图1),平台设定同时满足大于节点“连接度”“介度”“紧密度”的中位数为卡值,得到关键核心靶标75个,药物与疾病的共有靶标11 个(AKT1、TP53、SDHA、SDHC、SDHB、SDHD、CHRM3、ATP1A3、SCN8A、GNAS、UQCRC2)。
2.2.2 “黄芪-当归-刺五加”药组治疗PSCI 的“中药-靶标-通路-疾病”网络可视化图分析运用整合药理学平台获得了“黄芪-当归-刺五加”药组干预PSCI 的关键核心靶标,推测“黄芪-当归-刺五加”药组可能是通过作用于药物与疾病共有靶标来发挥对PSCI 的干预作用进而发挥药效,并利用核心靶标及其与中药成分和疾病之间的关系绘制 “中药-成分-关键药靶-通路”网络可视化图(见图2),干预PSCI 的关键靶标75 个,主要与27 个化学成分有关,其中刺五加21 个,分别为刺五加苷A、B、C1、D1、D2、I、K、L、苍耳苷、丁香酸、齐墩果酸、桦木酸、熊果酸等;当归4 个,分别为棕榈酸、肉豆蔻酸、二十四酸、豆甾醇-β-D-葡糖苷;黄芪3 个,分别为黄芪甲苷Ⅲ、华良姜素、棕榈酸。
核心靶标基因功能涉及蛋白质去泛素化、G2/M 过渡有丝分裂细胞周期、自噬调节、线粒体电子传输、质子跨膜转运、睫状基体-质膜对接、电子传输链、凋亡过程、核苷酸切除修复等。作用靶点主要参与核受体转录途径、SLC2A4(GLUT4)向质膜的转运、TP53 调控DNA 修复基因的转录、基底体与质膜的锚定、细胞核向有丝分裂中心体的募集、磷酸化对TP53 活性的调节、IKKs 复合物激活NF-κB 等。
3 讨论
近年来随着现代社会人口老龄化,脑卒中患者数量日益增多,PSCI 逐渐成为当前国内外卒中领域研究与干预的热点。中医中药在防治PSCI 方面发挥多靶点、多层面、标本兼顾的作用,多项研究表明中医中药具有改善卒中后神经功能缺损和PSCI 的作用[9-11]。在对中医治疗PSCI 用药规律分析中发现,补虚药使用频数最多,其中黄芪和当归排在前十位,黄芪为补虚药中的补气药,其补气治本,可补气行血,补气以通痹;当归为补虚药中的补血药,其可补血活血,且其活血而不伤血;刺五加为补虚药中的补气药,能补益心脾之气,益肺补肾[12]。结合PSCI 的发病机制这也说明该药组治疗PSCI 的可靠性及龙生蛭胶囊组方的合理性。
3.1 “黄芪-当归-刺五加”药组治疗PSCI 的实验研究
Morris 水迷宫实验是用于评估啮齿动物空间学习和记忆能力最常用的方法之一。大量研究已证实学习记忆和海马关系密切,纹状体边缘区与前额叶皮质也参与学习记忆过程。在评价海马依赖性的空间学习和记忆功能时,Morris 水迷宫实验结果可靠[13-14]。因此本研究采用Morris 水迷宫实验来评价该药组对脑卒中大鼠行为学的影响具有合理性。
研究发现,氧化应激是缺血性脑卒中的重要病理生理变化之一[15]。MDA 是多不饱和脂肪酸氧化的副产物,被用作氧化应激的标志,当其超过机体内最主要的抗氧化物酶 SOD 的清除能力,会使自由基异常堆积,造成神经元细胞凋亡或坏死[16]。因此本实验对模型组和给药组大鼠血清中的SOD 和MDA 进行测定,从而评价“黄芪-当归-刺五加”药组对大鼠血清生化学的影响。
研究结果显示,“黄芪-当归-刺五加”药组对PSCI 大鼠的空间记忆能力和学习能力具有良好的改善作用;同时药组还能显著降低模型脑卒中大鼠血清中MDA 的含量,提高SOD 的活性。孙晓丽等[8]研究发现,龙生蛭胶囊能够改善大鼠的神经功能缺陷,提高大鼠的肌力和自主运动能力,其对脑组织的保护作用可能与抗氧化,抑制NF-κB 以及Caspase-3 的表达有关。本实验研究结果与其基本一致,提示龙生蛭胶囊发挥改善PSCI 作用可能与“黄芪-当归-刺五加”药组抗PSCI 作用有关。
3.2 “黄芪-当归-刺五加”药组治疗PSCI 的作用机制研究
在对“药物靶标-疾病靶标”分析中得到AKT1 等多个核心靶标。有研究发现,AKT1 能介导癌症和心血管疾病,促进血管内皮生长因子(VEGF)分泌并介导内皮细胞一氧化氮合酶(eNOS)磷酸化过程,AKT1 可能在许多心血管病理过程中均发挥重要作用[17]。李剑虹等[18]探讨脑源性神经营养因子(BDNF)信号传导通路中AKT1 基因多态性与抑郁障碍及认知功能的关系中发现,AKT1基因SNPrs3001371 多态性与重性抑郁障碍的认知功能损伤存在关联性,研究发现,PI3K/Akt 通路失衡会产生严重的学习记忆障碍,Akt1 缺乏小鼠表现为空间记忆受影响[19]。阎卉芳[20]研究发现黄芪当归配伍对血管内皮受损后内膜增生具有抑制作用,其作用与抑制血管内皮受损后血管平滑肌细胞(VSMCs)的表型转化和增殖有关,其作用机制可能是通过抑制PI3K/Akt 信号通路活化,从而抑制VSMCs 增殖。
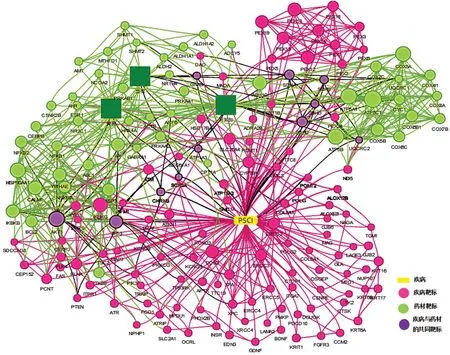
图1 核心靶点网络Fig 1 Network for key targets
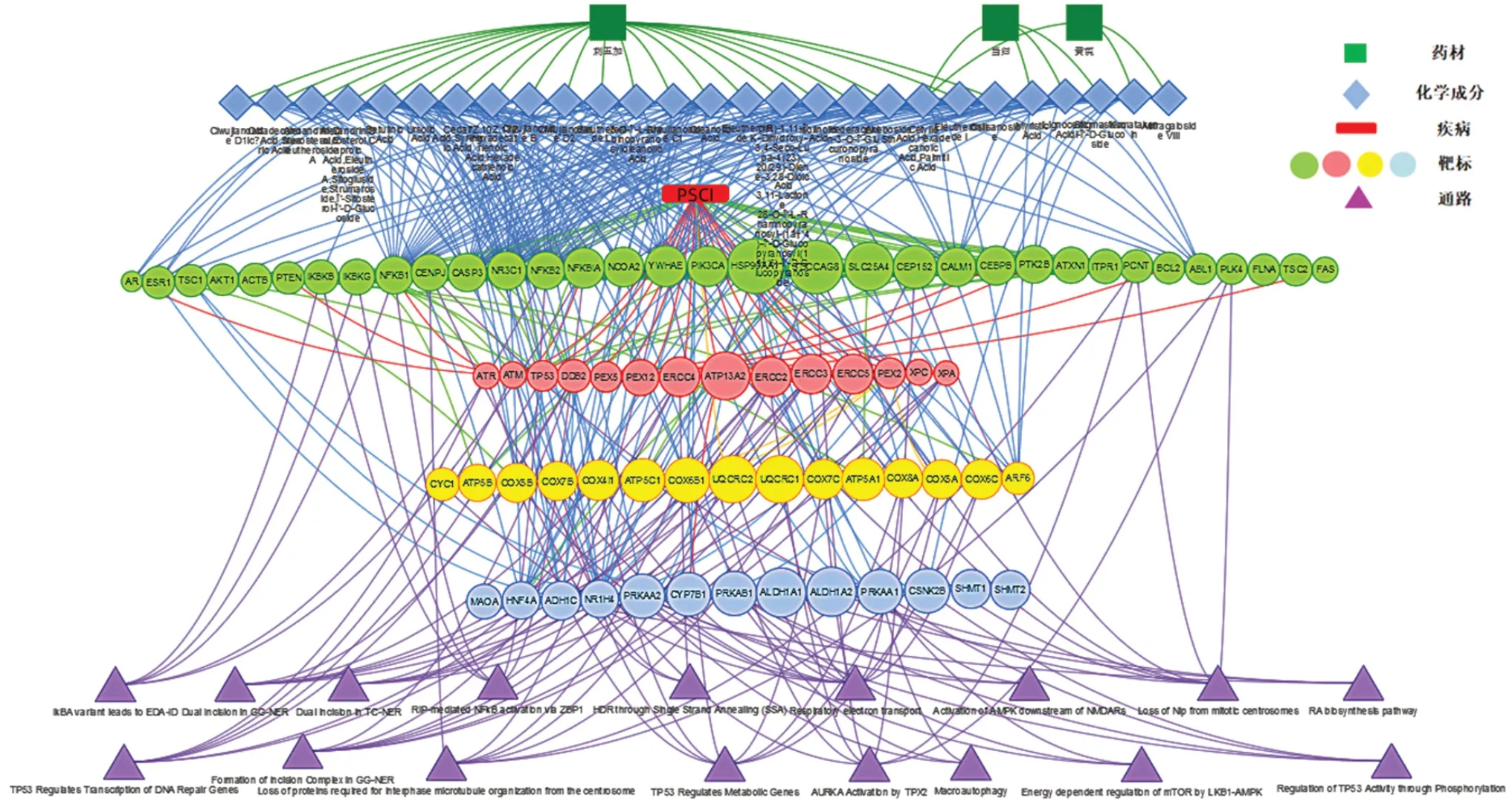
图2 “中药-成分-关键靶标-通路”多维关联网络Fig 2 Multi-dimensional network of Chinese materia medica-component-key target-pathway
在活性成分方面的研究显示,药组治疗PSCI可能与黄芪甲苷、刺五加皂苷、有机酸等有关。有研究发现黄芪甲苷对脑损伤引发的神经损伤也有一定的保护作用[21]。晏燕[22]研究发现,黄芪甲苷能够改善Aβ25-35诱导AD 模型大鼠的学习和记忆能力,能够显著减轻Aβ诱导的神经元损伤,黄芪甲苷能够显著增加抗氧化酶GSH-Px 和SOD 的活性,降低海马组织MDA 的含量,且能改善AD大鼠学习记忆功能和海马区神经元损伤,其作用机制可能与其抗氧化应激有关。黄芪注射液具有改善慢性脑缺血患者认知功能,机制可能与其改善脑血流和血液流变学等作用有关[23]。当归提取物可剂量依赖性地减弱Aβ1-42诱导的神经毒性和tau 蛋白磷酸化,同时,其能增加Akt 的丝氨酸磷酸化水平,并下调GSK-3β活性,说明当归提取物保护神经细胞的作用与PI3K/Akt/GSK-3β信号通路有关[24]。研究发现,刺五加皂苷能活化海马神经元胆碱乙酰化酶(ChAc),增强海马胆碱能神经功能;调节NOS 活性,偶联神经活动与脑血流量,促进递质释放;激活Na+-K+-ATP 酶,促进与学习记忆有关的神经递质释放,调节神经元的兴奋性,改善大脑活动的质量;增强SOD 活性,加速氧自由基的清除,减轻海马神经元损伤,保护海马神经元,维系胆碱能神经的可塑性;抑制血清单胺氧化酶(MAO)活性,减少儿茶酚胺的代谢,改善脑功能活动[25],因此其能提高学习记忆能力及改善脑组织生化学的改变,较好地改善PSCI 的临床症状[26-28]。
在对核心靶标基因功能分析中,发现其与自噬调节、线粒体电子传输等多个基因功能有关。研究发现线粒体功能障碍是PSCI 的早期特征,其受损可导致大脑功能受损,并会导致AD 患者中的神经元变性[29]。线粒体自噬可以清除损伤的线粒体,线粒体自噬的发生依赖线粒体自噬受体的调控[30]。其分子通路涉及核受体转录途径、磷酸化对TP53 活性的调节等。核受体是一类配体诱导的转录因子超家族,核受体可参与调节包括脂质生物活性在内的各种细胞内生物学过程[31]。研究发现,核受体编码基因变异导致胆固醇产生过量及输出障碍,致病性Aβ肽过量产生,会产生PSCI,且最终导致AD[32]。研究发现,海马tau 蛋白的异常磷酸化可能在神经细胞调亡和认知功能损伤中起到了重要的作用[33]。已经有大量基础研究和部分临床研究发现tau 蛋白显著的磷酸化会同时伴有认知功能的损伤[34]。现代医学发现这些靶标功能和分子通路多与神经系统、循环系统、内分泌系统、免疫系统有关。现代医学发现神经-内分泌-免疫网络系统调节功能的表达异常,导致神经系统、内分泌系统、免疫系统功能表达异常,从而导致脑部疾病的发生[35]。
综上所述,本研究采用实验研究与整合药理学相结合的技术和方法,综合评价“黄芪-当归-刺五加”药组对PSCI 的影响及作用机制。本研究发现 “黄芪-当归-刺五加”药组能较好地改善PSCI 大鼠的行为和学习记忆力,同时也通过TCMIP V2.0 网络大数据对药组治疗PSCI 的作用机制进行了预测,发现“黄芪-当归-刺五加”药组治疗PSCI 可能通过多分子、多靶点、多通路相协同作用,但还需要进一步的实验验证。

