胰岛素样生长因子水平监测在重组人生长激素治疗生长激素缺乏症中的临床意义
祝三娟,张春霞,程浩骏,周文玉
生长激素缺乏症(GHD)是指由于下丘脑或腺垂体功能减低,造成生长激素(GH)分泌不足而引起的生长障碍及身材矮小,其可分为特发性生长激素缺乏症、遗传性生长激素缺乏症、继发性生长激素缺乏症及暂时性生长激素缺乏症等类型[1]。目前,国内外很多研究证明,重组人生长激素(rhGH)治疗GHD不仅可以加快其生长速度,改善患者身高,对儿童发育进程的影响却极小。其机制是通过rhGH 刺激机体产生胰岛素样生长因子1(IGF-1),并主要与胰岛素样生长因子结合蛋白3(IGF-BP3)结合来达到改善身高的目的。rhGH 在临床治疗中,不同剂量在不同个体中有不同的疗效。故而明确其量效关系并进行筛选有效的剂量方案有重要意义。临床研究表明,儿童IGF-1 作为生长类因子,其血清水平不仅能够提高诊断效率,对于治疗效果也有十分重要的指导作用[2]。本研究主要参照GHD 患儿血清IGF-1 水平高低来调整rhGH 的用药剂量,观察不同血清IGF-1 水平对患儿身高的影响,为临床治疗GHD 提供参考,现报道如下。
1 资料与方法
1.1 一般资料 收集2016 年1 月至2018 年1 月浙江省江山市妇幼保健院收治并确诊的原发性GHD 儿童42 例,纳入标准:(1)在同年龄、同性别的前提下,身高低于正常儿童的第3 百分位(或-2 SD)以下;(2)既往生长速率(GV)<5cm/年;(3)骨龄与实际年龄相比落后2年以上;(4)精氨酸联合左旋多巴激发试验GH 峰值<10 ng/ml;(5)入组前未接受过rhGH 治疗;(6)治疗前IGF-I 水平均<同年龄同性别平均值的-1SD。排除遗传代谢性疾病、甲状腺功能低下、染色体畸变、营养性疾病及其他慢性疾病的患儿。将42 例患儿随机分成对照组和观察组,各21 例,对照组男13 例,女8 例;观察组男11 例,女10 例。两组一般资料差异无统计学意义(均>0.05)。
1.2 方法 两组患儿rhGH起始剂量均为0.1 IU·kg-1·d-1,睡前半小时皮下注射。治疗1 个月后查血清IGF-1 水平,之后每3 个月复查一次,根据血清IGF-1 水平调整rhGH 剂量,使对照组IGF-1 水平维持在平均值≤IGF-1≤+1 SD,观察组IGF-1 水平维持在平均值+1 SD≤IGF-1≤+2 SD。两组rhGH 治疗时间均为2 年。
1.3 观察指标 治疗后每3 个月随访一次,每次由同一个人、同一时间段、同一把尺子测量身高,计算GV 和身高标准差积分(HtSDS),HtSDS=(实测身高值-同龄儿童身高均值)/同龄儿童身高的标准差。每12 个月拍摄1 次骨龄(BA)。比较两组治疗前、治疗1 年和治疗2 年时的身高、GV、HtSDS 和BA 的变化,治疗期间观察患儿的不良反应,出现血糖增高、甲状腺功能低下等情况及时停药观察或给与一般对症处理。
1.4 统计方法 采用SPSS 19.0 统计软件进行分析,计量资料以均数±标准差表示,采用 检验;计数资料采用2检验。<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后各指标变化情况两组治疗前身高、GV、HtSDS 和BA 差异均无统计学意义(≤0.22,均>0.05),两组治疗1 年各指标均较治疗前升高(≥2.28,均<0.05),而GV 水平在治疗2 年时均较治疗1 年时下降(≥3.61,<0.05)。观察组治疗1 年和2 年后HtSDS、GV 及身高均高于对照组(≥2.23<0.05),两组治疗1 年和2 年时BA 差异均无统计学意义(≤0.42,均>0.05)。见表1。
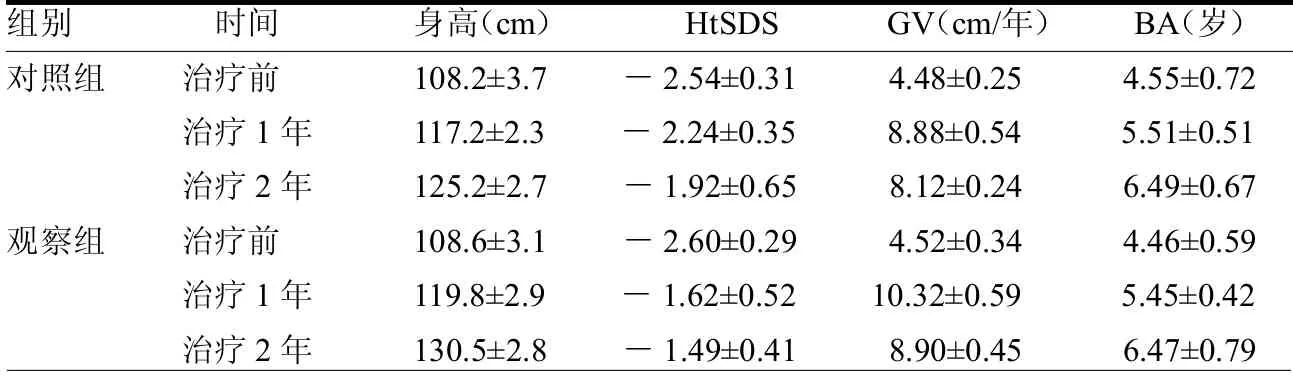
表1 两组治疗前后各指标变化情况
2.2 两组治疗期间不良反应情况 两组不良反应发生率差异无统计学意义(2=0.171>0.05)。见表2。
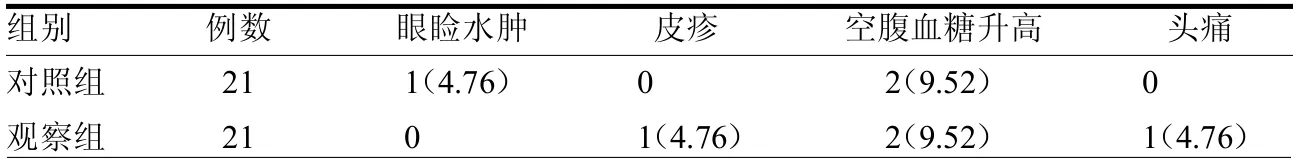
表2 两组治疗期间不良反应情况 例(%)
3 讨论
随着我国经济水平及生活水平的提高,越来越多的人开始重视儿童身高发育,并希望对矮身材进行干预治疗。而矮小症儿童如果不能早期诊断和治疗,就容易错过最佳治疗时期而影响终身高。GHD是儿童身材矮小、生长迟缓的主要原因之一[3]。从1985 年美国FDA 批准rhGH 治疗GHD 之后,rhGH 就得到了广泛应用。
GH 是影响身高的重要因素之一,它可以通过刺激肝脏等脏器合成IGF-1,IGF-1 是一种与胰岛素结构和功能相似的促细胞生长多肽,是介导GH 促生长作用的主要物质。IGF-1 在血液中的浓度随GH 的改变而变化,而IGF-1 负反馈调节GH 的分泌,是GH 的生理性调节因子[4]。GH 呈脉冲式分泌,昼夜节律明显,且GH 激发试验受多种因素的影响,存在一定的假阳性和假阴性率,而IGF-1 在体内浓度表现稳定,并且能较好地反映GH 水平,故而成为了生长激素治疗GHD的过程中重要的监测指标。
本研究依据患儿血清IGF-1 水平来调整rhGH 剂量,使IGF-1 维持在规定范围内,比较不同血清IGF-1 水平对GHD 患儿的身高、HtSDS、GV 和BA 的影响。本文结果显示,治疗1 年和2 年时两组身高、HtSDS、GV 和BA 均比治疗前有显著升高,这提示rhGH 治疗GHD 患儿有较好的疗效。除骨龄外观察组各项指标的增加幅度明显较对照组大,这说明高血清IGF-1 水平较低血清IGF-1 水平对GHD 身高的增长更有利。治疗第2 年时的身高、HtSDS 均较治疗前显著上升,但增长幅度较第1 年降低;而GV在治疗2 年时较治疗1 年时显著下降;但两组差异均无统计学意义(均>0.05)。这说明不论何种剂量,患儿在第1 年追赶生长的程度更为明显,第2年时已显著变慢。两组骨龄在治疗第2年和第1 年进展幅度差异均无统计学意义(均>0.05),这说明两组骨龄增长均未出现加速,血清IGF-1 水平高低对骨龄增长快慢没有显著的影响。
在药物不良反应方面,本研究中两组眼睑水肿、局部过敏反应症状都比较轻微,不影响疗效,未予特殊处理。两组在治疗过程中各有2 例出现空腹血糖升高,指导其减少含糖食物的摄入及停药一段时间后复查3 例血糖都恢复正常,1 例反复增高患儿在行OGTT 排除II 型糖尿病后继续使用生长激素后未再出现血糖增高现象;1例患儿出现头痛,自行停药后再用药未再出现头痛症状,考虑良性颅内高压引起。由此可以看出rhGH在治疗GHD患儿的过程中具有比较可靠的安全性。
综上所述,以GHD 患儿血清IGF-1水平高低为参考来调整rhGH 的用药剂量,高血清IGF-1 水平较低血清IGF-1水平可以获得更好的身高改善,且血清IGF-1 水平控制在平均值的+2 SD 以内未发生明显的不良反应。较高的血清IGF-1 水平不会导致骨龄的加速增长,且并没有增加药物不良反应的发生率,但因为本研究样本量较小,故还需更进一步获取更多的临床数据来进行更好的验证。

