BRCA1/2基因突变卵巢癌患者的疗效预后生存分析
丁洁 安煜致
【摘要】 目的:評估BRCA1/2基因突变状态对晚期浆液性卵巢癌患者预后的影响。方法:选择2017年10月-2020年3月在锦州医科大学附属第一医院初诊的60例晚期浆液性卵巢癌患者作为研究对象,其中30例接受BRCA1/2基因检测,根据检测结果分为BRCA1/2突变组和BRCA1/2野生组,余30例为BRCA1/2基因未知组。比较三组临床病理特征、初始治疗方式、一线铂类药物的敏感性、中位生存时间;亚组分析影响BRCA1/2基因检测患者预后的相关因素。结果:BRCA1/2突变组与BRCA1/2野生组、BRCA1/2基因未知组家族史比较,差异均有统计学意义(P<0.05)。BRCA1/2突变组与BRCA1/2野生组复发情况比较,差异有统计学意义(P<0.05)。BRCA1/2突变组中位生存时间均长于BRCA1/2野生组、BRCA1/2基因未知组,差异均有统计学意义(P<0.05)。多因素Cox分析确定BRCA1/2基因突变为预后的有利因素(P<0.05)。结论:有家族史的患者更有可能接受BRCA基因检测,经检测后具有BRCA1/2基因突变患者对铂类化疗药物敏感性好,短期预后较好。
【关键词】 浆液性卵巢癌 BRCA1/2 基因突变 预后
Efficacy, Prognosis and Survival Analysis of Patients with BRCA1/2 Gene Mutation Ovarian Cancer/DING Jie, AN Yuzhi. //Medical Innovation of China, 2021, 18(24): 0-076
[Abstract] Objective: To evaluate the effect of BRCA1/2 gene mutation status on the prognosis of patients with advanced serous ovarian cancer. Method: A total of 60 patients with advanced serous ovarian cancer initially diagnosed in the First Affiliated Hospital of Jinzhou Medical University from October 2017 to March 2020 were selected as the research objects, 30 cases accepted the BRCA1/2 genetic testing, according to test results they were divided into BRCA1/2 mutation group and BRCA1/2 wild group, the remaining 30 cases were selected as BRCA1/2 gene unknown group, the remaining 30 patients for not testing group. The clinicopathological features, initial treatment and sensitivity of first-line platinum drugs and median survival time were compared among three groups, subgroup analysis of related factors affecting the prognosis of patients with BRCA1/2 gene detection. Result: There were significant differences in family history between BRCA1/2 mutation group, BRCA1/2 wild group and BRCA1/2 gene unknown group (P<0.05). There was significant difference in recurrence between BRCA1/2 mutation group and BRCA1/2 wild group (P<0.05). The median survival time of BRCA1/2 mutation group was longer than that of BRCA1/2 wild group and BRCA1/2 gene unknown group (P<0.05). Multivariate Cox analysis confirmed that BRCA1/2 gene mutation was a favorable factor for prognosis (P<0.05). Conclusion: Patients with a family history are more likely to receive BRCA gene testing, patients with BRCA1/2 gene mutation are more sensitive to platinum chemotherapy drugs and have a better short-term prognosis.
[Key words] Serous ovarian cancer BRCA1/2 Genetic mutations Prognosis
First-author’s address: The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China
doi:10.3969/j.issn.1674-4985.2021.24.018
卵巢癌是女性生殖系统三大恶性肿瘤之一,其80%~90%为上皮性卵巢癌(ECO),而浆液性肿瘤是上皮性卵巢癌最普遍的亚型。浆液性卵巢癌好发于50~70岁女性,发病率为45%[1],位居妇科恶性肿瘤第3位。由于癌变早期临床症状不典型,且不易诊断,初诊时约70%的患者已属晚期,延误了最佳治疗时期,5年生存率不足50%,被称为最致命的妇科恶性肿瘤,严重威胁着女性的健康[2]。目前浆液性卵巢癌的病因尚不明确,普遍认为可能与基因突变、年龄、体内激素的变化、生育、环境等多因素有关。目前研究发现,乳腺癌-卵巢癌易感基因Ⅰ/Ⅱ(BRCA1/2)是与卵巢癌发生发展最相关的肿瘤基因[3]。BRCA1/2是重要的抑癌基因,在DNA的损伤修复、基因的转录调节等过程中扮演重要角色。若BRCA1/2基因产生突变则可能导致卵巢恶性肿瘤的发生[4-5]。目前对于BRCA突变与浆液性卵巢癌预后间的关系,国外学者们未能达成一致意见。学者普遍认为相比野生型患者,BRCA突变的卵巢癌患者预后较好,无进展生存期较长。而国内研究多集中于BRCA1/2与上皮卵巢癌突变位点及药物治疗,而关于BRCA1/2基因与浆液性卵巢癌预后的研究并不多见。因此本研究进一步论证行BRCA基因检测的意义,并探究晚期浆液性卵巢癌患者BRCA1/2突变状况与预后的关系,为晚期浆液性卵巢癌的治疗提供精准化、个体化方案。现报道如下。
1 资料与方法
1.1 一般资料 选取2017年10月-2020年3月在锦州医科大学附属第一医院初诊的60例上皮性卵巢癌患者作为研究对象,年龄39~73岁,中位年龄54岁。(1)纳入标准:①病理组织学类型为浆液性癌;②国际妇产科联盟(FIGO 2010)标准分期为Ⅲ、Ⅳ期卵巢癌;③初始治疗接受了满意的卵巢细胞减灭术(PDS)或新辅助化疗(NAC)联合中间性肿瘤细胞减灭术(IDS),且两种治疗方式的入组患者均接受一线铂类药物化疗,化疗疗程共6~8周期,经上述治疗结束后疗效评价为完全缓解(CR)或部分缓解(PR);④均未接受任何PARP抑制剂治疗(注:截止2020年前PARP抑制剂未进入本院医保系统,入组卵巢癌患者未接受PARP抑制剂治疗)。(2)排除标准:①存在其他重大器官疾病;②一线治疗期间,同步接受其他肿瘤放疗。该研究已经伦理学委员会批准,患者知情同意并签署知情同意书。
1.2 方法 详细询问并记录所有研究对象的家族史(一级或二级亲属中有无卵巢癌或乳腺癌病史)、临床信息、病理报告、手术记录。中位生存时间即当累积生存率为0.5时所对应的生存时间。从临床确诊之日起,追踪患者的疾病进展情况,通过血清CA125水平、影像资料、临床症状及电话随访评价疾病进展状况。在一线治疗期间或治疗结束后6个月内肿瘤复发即铂耐药,一线治疗结束后大于6个月肿瘤复发即铂敏感。
1.3 BRCA基因突变检测 入组60例患者,30例自愿接受BRCA1/2基因检测,签署书面知情同意书后,提供血液标本或咽拭子,送检至符合国家标准的检测公司,使用NGS二代测序法进行基因检测,根据检测结果将患者分为BRCA1/2突变组和BRCA1/2野生组。未进行BRCA1/2基因检测的30例患者作为BRCA1/2基因未知组。
1.4 統计学处理 采用SPSS 26.0软件对所得数据进行统计分析,计数资料以率(%)表示,比较采用字2检验和Fisher精确检验;采用Kaplan-Meier法绘制生存曲线,生存曲线的组间比较采用对数秩检验。生存分析使用Cox比例风险回归模型。所有统计检验均为双面检验,以P<0.05为差异有统计学意义。
2 结果
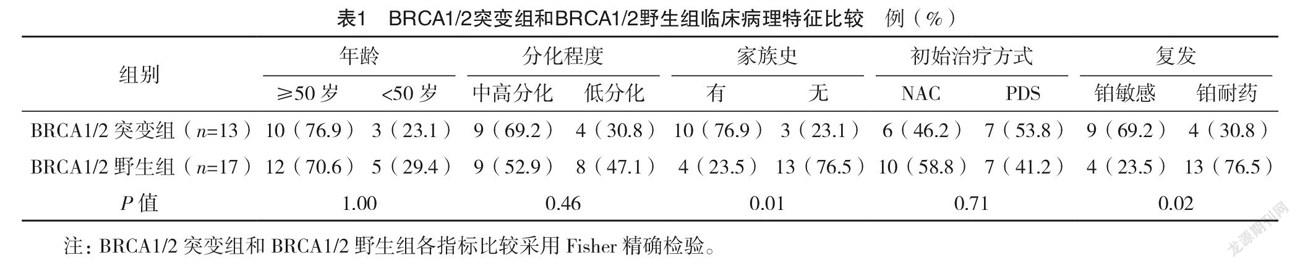
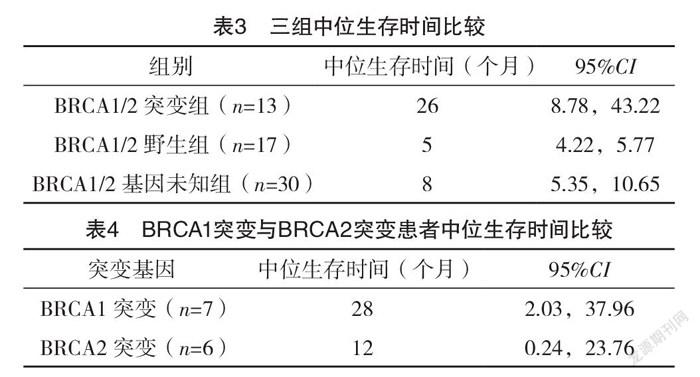
2.1 入组患者临床病理特征比较 BRCA1/2突变组和BRCA1/2野生组家族史、复发情况比较,差异均有统计学意义(P<0.05);两组其他指标比较,差异均无统计学意义(P>0.05)。BRCA1/2突变组和BRCA1/2基因未知组家族史比较,差异有统计学意义(P<0.05);两组其他指标比较,差异均无统计学意义(P>0.05)。见表1、2。
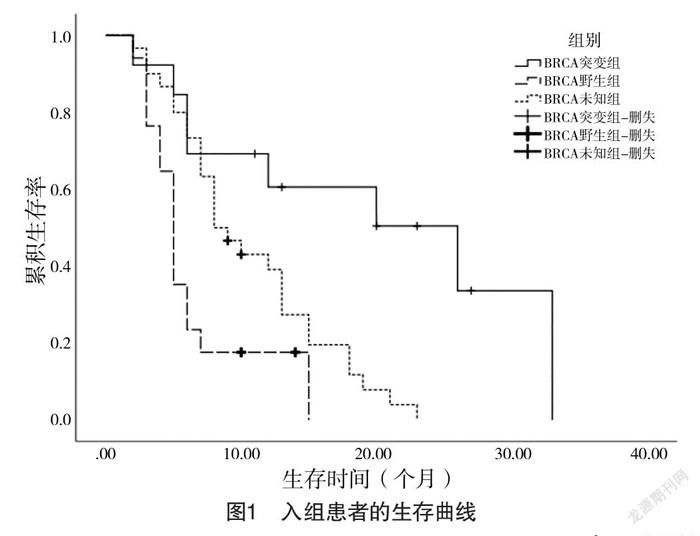
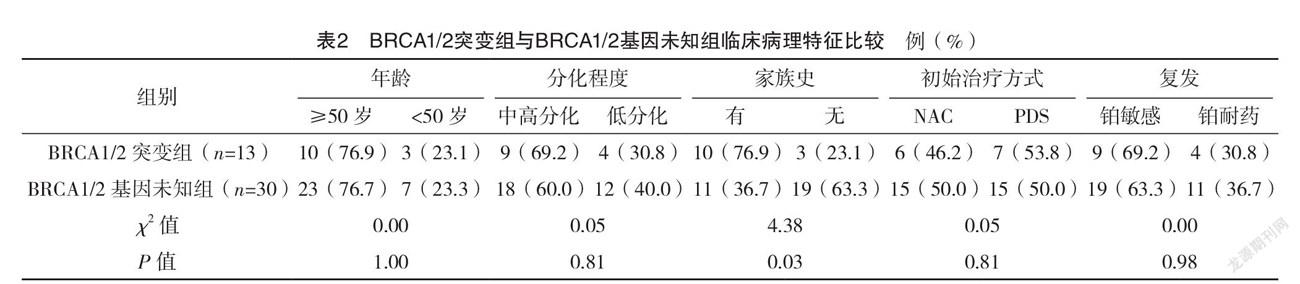
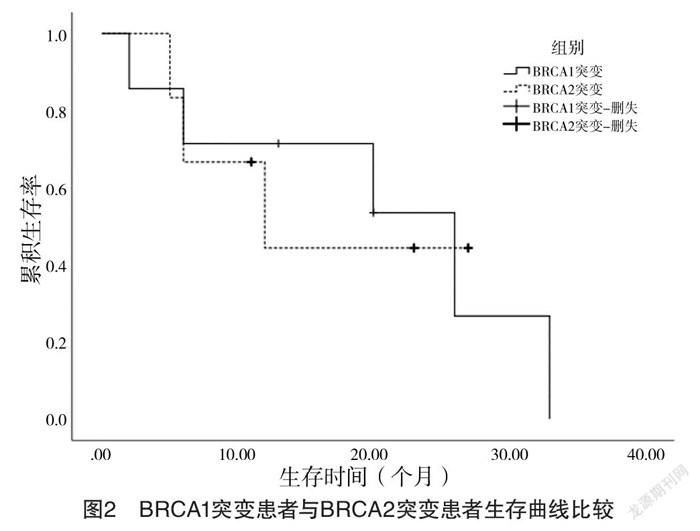
2.2 生存结果比较 log-rank分析,与BRCA1/2野生组相比,BRCA1/2突变组中位生存时间更长,差异有统计学意义(字2=9.48,P=0.002);与BRCA1/2基因未知组相比,BRCA1/2突变组中位生存时间更长,差异有统计学意义(字2=6.44,P=0.004)。就特定的BRCA基因类型而言,BRCA1突变患者中位生存时间与BRCA2突变患者比较,差异无统计学意义(字2=0.005,P=0.940)。见表3、4和图1、2。
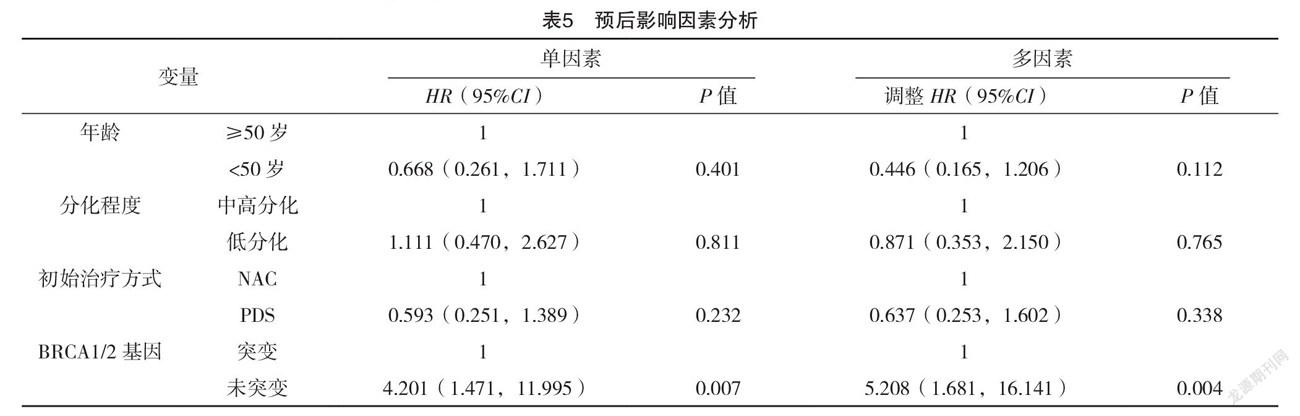
2.3 预后影响因素分析 将所有变量引入Cox比例风险模型,单因素Cox回归分析显示:BRCA1/2基因突变为预后影响因素(P<0.01)。多因素Cox回归分析显示:BRCA1/2基因突变为预后的因素(P<0.01)。BRCA1/2基因突变患者比BRCA1/2野生型患者具有更低的死亡风险(P<0.01)。见表5。
3 讨论
卵巢癌被称为是最致命的妇科恶性肿瘤,每年在全球范围内导致226 000例新病例和158 000例患者的死亡[6]。在卵巢癌的各种高危因素中,遗传因素被认为是与卵巢癌发生密切相关的重要因素之一。研究表明,在浆液性卵巢癌中20%~25%发生与遗传因素相关[7]。在遗传性卵巢癌中,90%的病例主要由卵巢癌-乳腺癌易感基因Ⅰ/Ⅱ(BRCA1/2)胚系突变引起。研究发现,BRCA1和BRCA2基因突变的携带者罹患卵巢癌的风险分别为35%~60%和12%~25%[8],而在普通人群中,卵巢癌风险为1.3%。当然,在具有家族性卵巢癌的女性群体中,这种患病风险将更高。研究显示,BRCA1突变携带者罹患卵巢癌的概率达63%,BRCA2突变携带者罹患卵巢癌的概率达27%[9]。本研究结果显示,BRCA1/2突变组具有家族史的比例为76.9%,而BRCA1/2野生组和BRCA1/2基因未知组的比例分别为23.5%和36.7%。这表示具有家族史的患者更有可能接受BRCA检测。结合实际临床工作中,对具有卵巢癌家族史的女性,积极推广BRCA1/2基因的筛查,评估发生卵巢癌的风险,做到“预防为主,防治结合”,这对浆液性卵巢癌早期的预防、诊断及晚期预后治疗都具有重要意义。
针对BRCA1/2基因在卵巢癌患者中的突变状况,国内首次由Wu等[10]主导的一项全国大样本多中心的卵巢癌BRCA突变流行病学研究显示,在826名非选择的上皮性卵巢癌患者中,BRCA突变率为28.5%,其中BRCA1突变率为20.82%,BRCA2突变率为7.63%。在本研究中,晚期浆液性卵巢癌患者BRCA总体突变率为43.3%(13/30),BRCA1突变率为23.3%(7/30),BRCA2突变率为20.0%(6/30),高于国内的文献报道,其原因可能在于入组病例中有家族史的卵巢癌患者更容易接受BRCA1/2基因检测。
众所周知,年龄是影响卵巢癌患者预后的重要因素之一。文献[11-13]报道,BRCA突变型卵巢癌患者的平均诊断年龄为45~48岁,BRCA野生型卵巢癌患者的平均诊断年龄为58~61岁,显示出未突变患者比突变患者的平均诊断年龄要大。同样在Weiderpass等[14]研究也表明相比未突变患者,BRCA基因突变患者通常诊断年龄更小,且种族不同突变率也不同。本研究结果显示,BRCA1/2突变组和BRCA1/2野生组确诊年龄比较,差异无统计学意义(P>0.05)。这与报道文献差异较大,可能与选取样本量数量有关,有待进一步研究。
近年来,BRCA基因突变状况与浆液性卵巢癌的预后关系一直是广大学者们关注的热点。但迄今为止,尚未确定BRCA基因突变对卵巢癌的确切影响。一些研究报道,BRCA基因突变的卵巢癌患者预后较好,可能是对铂类化学治疗有较高的敏感性。Cass等[15]的研究表明BRCA突变患者对一线铂类化疗药物反应性显著增强,并且此类患者的PFS也相应延长。Gorodnova等[16]研究中,通过铂类药物新辅助化疗的BRCA突变携带者中有34%发生了完全的临床反应,而非携带者中仅有4%(P<0.05)。BRCA基因突变者对铂类药物的高敏感性,原因在于BRCA蛋白失能时,铂类药物对DNA双链结构的破坏性增强[17]。即BRCA1/2基因是肿瘤抑癌基因,其编码的蛋白在通过同源重组(HR)方式修复DNA双链断裂中发挥重要作用[18]。当BRCA缺失突变时,浆液性卵巢癌的基因组不稳定,无法进行HR修復,这会导致对破坏DNA的化学治疗剂(铂类药物)的敏感性增加,这被称为合成杀伤力[19]。本研究结果显示,BRCA1/2突变组69.2%的患者为铂敏感复发,而BRCA1/2野生组仅占23.5%,两组比较差异有统计学意义(P<0.01)。本研究使用log-rank分析方法比较BRCA突变组与BRCA野生组的生存曲线,相比BRCA野生组,BRCA突变组中位生存时间更长(P<0.01)。文献[20-21]研究观察到BRCA突变患者具有短期生存优势,但没有长期生存率优势,因此在诊断为卵巢癌后,BRCA基因突变状态所赋予的暂时死亡率降低的优势,随着时间进展将会逐渐减退,与本研究结果一致。Kotsopoulos等[22]的一项长达10年的随访研究中显示对于首次根治性切除手术无残留病灶的卵巢癌患者,非携带者的死亡率为43%,BRCA1、BRCA2突变携带者的死亡率分别为57%和69%,他们认为具有BRCA突变的患者初始生存优势可能反映出BRCA携带者对化疗的更高初始敏感性,但是这种短暂优势不能预测其长期生存良好。由于观察时间较短,未能评估BRCA基因突变与入组患者总生存期(OS)之间的关系,后续将继续完善本研究。
研究发现,41%~50%的上皮性卵巢癌患者存HRD,HRD发生病因即同源重组修复(HRR)有关的基因发生突变[23]。其中BRCA1/2胚系或体系突变是导致HRD的主要原因,但其他HRR相关基因,如PALB2、CDK12、RAD51、CHEK2、ATM等发生
突变或BRCA1基因启动子发生甲基化以及其他暂未明确的原因都会引起HRD,导致基因组不稳定。具有上述HRR修复的相关其他基因的改变,通常表现出与BRCA突变卵巢癌相似的临床特征以及对PARP抑制剂敏感时,这部分患者被称为“BRCAness”。HRD是上皮性卵巢癌中重要的治疗靶点,这种具有HRD的卵巢癌患者对铂类药物敏感,后续也将从PARP抑制剂的使用中获益,预后较好。推荐卵巢癌患者行HRD基因检测,这对上皮性卵巢癌的精准靶向治疗具有重要意义。
综上所述,BRCA1/2基因突变卵巢癌患者对铂类化疗药敏感,PFS更长,预后较好。具有家族史的卵巢癌患者更有可能接受BRCA检测,积极推行对有卵巢癌-乳腺癌家族史人群的BRCA1/2基因突变检测,这对卵巢癌的早期预测和治疗具有重要意义。同时积极向卵巢癌患者推行HRD基因检测,以个体化、精准化的治疗方式造福于更多卵巢癌患者。
参考文献
[1]杨正勤.上皮卵巢癌患者BRCA1/2和KRAS基因突变与预后的相关性[J].中国妇幼保健,2018,33(7):1460-1463.
[2] Gamarra-Luques C D,Goyeneche A A,Hapon M B,et al.
Mifepristone prevents repopulation of ovarian cancer cells escaping cisplatin-paclitaxel therapy[J].BMC Cancer,2012,12(1):1-16.
[3]刘伟玲.血清CA125联合BRCA在卵巢癌患者中的预后分析[D].郑州:郑州大学,2018.
[4] Aust S,Bachmayrheyda A,Auer K,et al.Abstract A78:Serummetabolomics,cytokine measurements,and tumor RNA-seqidenti-fied phospholipids correlated with a molecular subclass as strong predictor for outcome in high-grade serous ovarian cancer[J].Clin Cancer Res,2016,22(4):56-58.
[5]李秀琴,王欣彦.上皮性卵巢癌精准治疗研究进展[J].中国实用妇科与产科杂志,2016,32(8):810-813.
[6] Fitzmaurice C,Dicker D,Pain A,et al.The global burden of Cancer 2013[J].JAMA Oncol,2015,1(4):505-527.
[7]杨筱凤,郭艳平.重视与遗传相关的卵巢癌[J].西安交通大学学报(医学版),2017,38(5):625-632.
[8]朱珏,张可,潘璐,等.遗传性卵巢癌综合征相关易感基因的研究进展[J].国际妇产科学杂志,2014,41(6):584-587.
[9]王瑶,唐慧莉,朱小青.卵巢上皮性癌患者BRCA1/2和KRAS基因突变与预后的相关性研究[J].解放军医药杂志,2017,29(4):1-4.
[10] Wu X,Wu L,Kong B,et al.The First Nationwide Multicenter Prevalence Study of Germline BRCA1 and BRCA2 Mutations in Chinese Ovarian Cancer Patients[J].International Journal of Gynecological Cancer,2017,27(8):1650.
[11] D’Andrea A D.BRCA1:a missing link in the Fanconi anemia/BRCA pathway[J].Cancer Discov,2013,3(4):376-378.
[12] Ouhtit A,Gupta I,Shaikh Z.BRIP1,a potential candidate gene in development of non-BRCA1/2 breast cancer[J].Front Biosci(Elite Ed),2016,8(1):289-298.
[13] Zhang F,Ma J,Wu J,et al.PALB2 links BRCA1 and BRCA2 in the DNA-damage response[J].Curr Biol,2009,19(6):524-529.
[14] Weiderpass E,Tyczynski J E.Epidemiology of Patients with Ovarian Cancer with and Without a BRCA1/2 Mutation[J].Mol Diagn Ther,2015,19(6):351-364.
[15] Cass I,Baldwin R L,Varkey T,et al.Improved survival in women with BRCA-associated ovarian carcinoma[J].Cancer,2003,97:2127-2129.
[16] Gorodnova T V,Sokolenko A P,Ivantsov A O,et al.High response rates to neoadjuvant platinum-based therapy in ovarian cancer patients carrying germ-line BRCA mutation[J].Cancer Lett,2015,369:363-367.
[17] Ang J E,Gourley C,Powell C B,et al.Efficacy of chemotherapy in BRCA1/2 mutation carrier ovarian cancer in the setting of PARP inhibitor resistance:a multi-in-stitutional study[J].Clin Cancer Res,2013,19(19):5485-5493.
[18] Gudmundsdottir K,Ashworth A.The roles of BRCA1 and BRCA2 and associated proteins in the maintenance of genomic stability[J].Oncogene,2006,25(43):5864-5874.
[19] Konecny G E,Kristeleit R S.PARP inhibitors for BRCA1/2-mutated and sporadic ovarian cancer:current practice and future directions[J].Br J Cancer,2016,115(10):1157-1173.
[20] Mclaughlin J R,Rosen B,Moody J.Long-term ovarian cancer survival associated with mutation in BRCA1 or BRCA2[J].J Natl Cancer Inst,2013,105(2):141-148.
[21] Candido-dos-Reis F J,Song H,Goode E L,et al.Germline mutation in BRCA1 or BRCA2 and ten-year survival for women diagnosed with epithelial ovarian cancer[J].Clin Cancer Res,2015,21(3):652-657.
[22] Kotsopoulos J,Rosen B,Fan I,et al.Ten-year survival after epithelial ovarian cancer is not associated with BRCA mutation status[J].Gynecol Oncol,2016,140:42-47.
[23] Diz M D P E,Fogace R N,Miranda V C,et al.Homologous recombination deficiency in ovarian cancer:a review of its epidemiology and management[J].Clinics(Sao Paulo),2018,73(1):450.
(收稿日期:2020-11-13) (本文編辑:程旭然)

