浆细胞肿瘤的临床病理分析
武 慧,汪 锋
(内蒙古自治区人民医院 病理科,内蒙古 呼和浩特010017)
浆细胞肿瘤临床上通常分为多发性骨髓瘤(MM)、骨的孤立性浆细胞瘤(SPB)和髓外浆细胞瘤(EMP),其中MM最常见。浆细胞性肿瘤临床症状复杂多样,发病部位广泛。现报道5例浆细胞肿瘤(2例MM,3例EMP)的临床及病理学特征,深入探讨其诊断要点及鉴别诊断,从而提高病理医师对该病的认识,减少不必要的误诊。
1 材料与方法
1.1 材料收集2015年1月至2020年10月间内蒙古自治区人民医院手术切除及穿刺病理诊断为浆细胞肿瘤病例5例,复习其临床及病理资料,对所有病例重新阅片并确诊。
1.2 方法组织标本经10%甲醛固定,石蜡包埋,4-5 μm厚切片,常规HE染色,光镜观察。免疫组化染色采用Envision两步法,DAB显色,所选用的抗体CD38、CD138、Mum-1、CD56、CD20、CD79a、CK、CD3、PAX-5、CD5、Ki-67、κ、λ及试剂盒均购自福州迈新生物技术开发有限公司。
2 结果
2.1 临床资料本组5例患者,其中男性2例,女性3例,年龄50-88(平均67.2)岁,因发病部位不同从而临床表现各异(表1)。例1尿本周蛋白阳性,血清免疫固定电泳呈IgG-LAM型M蛋白血症,骨髓涂片示浆细胞系统异常增生,幼浆约占34.5%;例2尿本周蛋白阳性,血清免疫固定电泳呈IgD-LAM型M蛋白血症,其余3例经实验室检查无明显阳性发现,尿本周蛋白阴性,血清免疫固定电泳未见单克隆免疫球蛋白区带,全身骨扫描未见明显异常,骨髓穿刺组织检查正常(浆细胞比例<0.05)。
2.2 病理检查除例3为穿刺标本外,余4例送检均为破碎灰红暗红组织,部分似鱼肉样,质软。镜下肿瘤细胞弥漫增生(图1),细胞黏附性差,局灶可侵犯周围组织(图2),根据细胞分化程度分为三级[1-2]:其中1级为低级别,共3例,肿瘤细胞类似正常浆细胞,可见核旁空晕,核偏位,染色质呈车辐状,偶见核分裂象;2级为中级别,共2例,细胞质丰富,嗜碱性,50%的肿瘤细胞核增大深染,车辐状结构不明显,而核仁明显,核分裂象易见;3级为高级别,细胞质稀少,核周空晕不明显,肿瘤细胞似浆母细胞,细胞核巨大,可见明显中位核仁,核分裂象活跃,并见病理性核分裂象,本组无高级别病例。
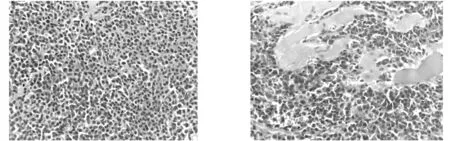
图1 肿瘤细胞弥漫性分布 HE×400 图2 肿瘤细胞局灶侵犯横纹肌 HE×400
2.3 免疫表型本组5例均表达CD38(图3)、CD138(图4),其中例5 CD38表达较弱,2例表达CD79a,2例表达Mum-1,3例表达CD56。轻链κ、λ的具体表达情况为:单一表达κ者3例,单一表达λ者2例。CK、CD20、CD3、PAX-5、CD5均为阴性,Ki-67阳性率5%-40%。

图3 肿瘤细胞CD38阳性EnVision×400 图4 肿瘤细胞CD138阳性EnVision×400

表1 5例浆细胞肿瘤患者的临床特征
3 讨论
3.1 临床特点MM是原发于骨髓的多灶性浆细胞肿瘤,多数病例骨髓广泛受侵犯,其他器官可继发受累,临床表现从无症状到高度侵袭性,有的症状是由异常免疫球蛋白链在组织中沉积所致,诊断MM需结合临床、形态、免疫学以及影像学的发现。MM好发于老年人,中位发病年龄70岁,儿童几乎从不发病。典型临床症状常有骨骼疼痛、贫血、乏力、肾功能损害[3]和感染等,少数病例也可因神经病变、髓外占位及其他髓外浸润等原因就诊,此外,还有部分患者诊断时并无明显症状,这就造成患者诊断过程比较曲折,甚至容易漏诊或误诊,从而影响后期治疗效果[4]。本研究中,例1由于左胸背部电击样疼痛,当地医院以带状疱疹治疗,效果不佳,例1和例2均就诊于神经外科,影像学检查提示椎管占位而进行手术切除,术后病理光镜形态和免疫组织化学支持浆细胞瘤诊断,化验血、尿本周蛋白均为阳性,临床结合骨髓活检和免疫学检查最终均诊断MM。
EMP是一类以不同分化阶段浆细胞单克隆增生为特征的罕见恶性肿瘤,约占所有浆细胞肿瘤的3%-5%,成年人多发,文献报道90%的EMP好发于头颈部特别是呼吸道如鼻腔、鼻窦、口咽部、喉部、唾液腺,少见情况也可发生于胃肠道、膀胱、中枢神经、乳腺和皮肤等其他部位[5]。本组3例EMP分别发生于颈后方、胸壁和头部,并无呼吸道病例,可能与本研究病例数偏少有关。本病起病缓慢,患者可无任何症状,也可出现局部浸润压迫症状。EMP的诊断条件包括[6]:1)经病理证实的由浆细胞单克隆性增殖造成的髓外肿块;2)骨髓活检和涂片检查正常;3)骨骼检查排除MM 和SPB;4)不存在因浆细胞病造成的贫血、高血钙或肾功能衰竭;5)血清或尿液中单克隆免疫球蛋白缺乏或水平低下。病理诊断EMP主要依靠光镜下HE形态和免疫组织化学辅助检查。
3.2 免疫表型浆细胞肿瘤不表达全B细胞抗原(CD19、CD20),但常表达CD38、CD138、Mum-1、CD56、CD79a,单克隆表达κ或λ轻链球蛋白,本组5例均表达CD38、CD138(仅一例CD38弱表达),部分表达Mum-1、CD56、CD79a,轻链球蛋白呈单克隆表达(仅表达κ者3例,仅表达λ者2例)。Ki-67阳性率文献报道差异性很大,傅思莹[7]等研究报道Ki-67阳性率5%-90%,本组Ki-67阳性率5%-40%,相对较低,可能与本组中缺乏高级别病例有关。
3.3 诊断与鉴别诊断病理HE形态和免疫组织化学检查高度提示浆细胞肿瘤时,需通过检测血常规、电解质、肾功、血清免疫球蛋白、血清免疫固定电泳、骨髓穿刺以及影像学检查等明确究竟是MM还是SPB或EMP。此外,在诊断时还需与下列病变相鉴别。(1)反应性浆细胞增生:在炎性病变中可见多量分化成熟的浆细胞,同时常伴随淋巴细胞、嗜中性粒细胞等其他炎细胞浸润,但轻链呈非限制性表达。(2)浆细胞型Castleman病:淋巴滤泡间有弥漫的浆细胞增生,可伴有较多的Russell小体,滤泡中心常可见无定型的嗜酸性物质沉积,有时也可表现为轻链限制性表达,故鉴别时需综合分析,不能单纯依赖免疫组化。(3)淋巴浆细胞淋巴瘤:是成熟小B淋巴细胞肿瘤并伴不同程度的浆细胞分化,形成由小淋巴细胞、浆样淋巴细胞和浆细胞组成的谱系,常累及骨髓,多数分泌IgM型M蛋白,肿瘤细胞表达表面Ig及B细胞相关抗原(CD19、CD20、CD22、CD79a),CD5、CD10、CD102和CD23常为阳性,CD38、CD138常为阴性[8]。淋巴浆细胞淋巴瘤与低级别的浆细胞瘤鉴别较为困难,鉴别需依赖免疫组织化学,后者CD38和CD138常为阳性。本组第3例患者第一次穿刺检查时就误诊为B细胞来源非霍奇金淋巴瘤,治疗效果不佳后第二次穿刺才得以明确诊断。(4)低分化癌:高级别浆细胞瘤肿瘤细胞似浆母细胞样分化,细胞核巨大,可见明显中位核仁,核分裂象活跃,并见病理性核分裂象,形态与低分化癌相像,但后者CK阳性,浆细胞标记阴性。(5)粒细胞肉瘤:瘤细胞形态单一,常呈列兵样或弥漫性分布,免疫组化表达MPO及CD117等髓系标记,CD38、CD138阴性。(6)大细胞淋巴瘤:弥漫大B细胞淋巴瘤瘤细胞以弥漫方式增殖,可伴有坏死,表达CD20、CD79a等B细胞标记;间变大细胞淋巴瘤瘤细胞弥漫增生,常呈黏附性生长和窦性浸润,表达CD30、ALK,不同程度表达细胞毒性蛋白,二者均不表达CD38、CD138。(7)恶性黑色素瘤:瘤细胞大小不一,胞质丰富,细胞形态多样,呈多种排列方式,部分肿瘤细胞内可见黑色素颗粒,瘤细胞表达S-100、HMB-45、Melan-A,不表达CD38、CD138。(8)Ewing肉瘤:好发于青年人,镜下见小圆细胞呈紧密成片或小叶状分布,细胞胞质稀少或呈不规则小空泡状,PAS染色阳性,10%-20%的病例可见菊形团样结构。
3.4 治疗及预后MM临床表现复杂,极易复发,目前最有效的治疗方法为化疗,常规化疗药物包括长春新碱、环磷酰胺、地塞米松等,近年来,硼替佐米和一些生物调节剂也应用于MM的治疗。本组例1、例2两位患者确诊MM后均采用硼替佐米+地塞米松+来那度胺的化疗方案,分别随访4个月及6个月,目前例1疗效较好,但例2患者疗效欠佳,临床建议骨髓移植。MM复发率极高,还需进一步长期随访。EMP的治疗多选择放射治疗或手术切除,EMP预后较好,10年生存率达50%-100%[9]。本组例4、例5手术后各随访14及69个月,均未复发,例3经两次穿刺诊断后,因肿物体积较大,患者拒绝手术,目前采用单纯放疗4个月,肿物体积未见明显变化。大约15%的EMP患者会进展为MM,因此坚持长期随访是非常有必要的[10]。
综上所述,浆细胞肿瘤是少见的恶性肿瘤,发病部位多见,临床症状复杂多变,镜下形态极易与多种疾病混淆,尽早明确诊断是治疗的关键,因此在日常诊断工作中,需要结合临床实验室检查和影像学检查,不断积累经验,不断提高诊断及鉴别诊断水平,从而更好地避免误诊或漏诊。

