NtCycB2 基因表达对烟草抗旱性的影响
关扬扬,郑淑心,刘向阳,王召军,张洪映,崔 红,闫筱筱
河南农业大学烟草学院,郑州市文化路95 号 450002
干旱是农作物种植过程中常发生的非生物胁迫之一。干旱胁迫会导致植物生长缓慢、光合色素降解、细胞膜受损、活性氧(ROS)量增加以及细胞含水率下降等,使植物生长发育受到显著抑制[1]。烟草作为一种特殊的叶用经济作物,维持其正常生长就需要在整个大田种植期保持50%以上的土壤相对含水率[2]。尤其在我国北方一些缺乏灌溉条件的烟叶产区,每年烟株生长发育受阻的现象频繁发生。干旱可降低烟叶产量和品质,是烟草生产的主要限制因素之一。因此提高烟草自身的抗旱能力至关重要[3]。
近年来,植物腺毛在抵御病虫害、抵抗逆境胁迫和次生代谢产物的合成等方面发挥着重要作用。叶面腺毛能够减少叶面蒸腾,有效抵抗干旱等[4]非生物胁迫。在番茄的抗旱试验中,表皮毛尤其是非腺体毛数量丰富的品种,其储水能力更强,抗旱效果更好[5]。烟田土壤水分的丰缺也会影响烟草腺毛类型、密度、分泌物成分等[6]。张华等[7]试验表明,烟草腺毛内部的超微结构会因水分丰缺而有较大改变,严重缺水会导致叶片中腺头细胞的细胞质和细胞器急剧减少,甚至会造成腺头细胞内部成分降解。齐永杰等[8]研究发现,轻度干旱会延长烟草成熟期,且烟叶表面的腺毛会因干旱而密度有所增加。孟盈等[9]试验提出,烟草K326 中NtCycB2基因过表达会造成烟草分泌型和非分泌型腺毛数量显著减少,叶片存留少量的短柄分泌型腺毛,而该基因敲除会使腺毛密度显著增加,尤其是长柄分泌型腺毛。本课题组前期通过RT-PCR 分析发现,NtCycB2对干旱、低温、盐害等逆境胁迫具有应答反应[9]。NtCycB2敲除后烟草叶面化学成分合成和分泌能力提高,并且烤后烟叶的香气成分总量增加,这在提高烟叶品质方面有着积极作用[10]。但目前关于NtCycB2敲除的多腺毛株系和NtCycB2过表达的少腺毛株系对逆境胁迫的研究还鲜见报道。为此,以K326 为对照,设置NtCycB2参与调控不同腺毛密度的转基因株系对干旱胁迫的反应试验,旨在为烟草耐旱新品种的选育提供依据。
1 材料与方法
1.1 试验材料
以栽培烟草品种K326 为对照,以及K326 为材料的NtCycB2敲除株系ko(NtCycB2-ko)和NtCycB2过表达株系oe[9]。
1.2 试验方法
采用漂浮育苗,待烟苗生长至5 叶1 心时,从苗盘中选取长势一致的oe、ko 和K326 株系幼苗进行干旱胁迫处理。首先,在流水下漂去根系上的泥土,再用蒸馏水冲洗3 次后将烟苗放入装有质量体积分数为0、5%、10%和15%PEG-6000 的Hoagland 营养液的试管中,分别处理0、3、6 和9 h时,观察并记录烟苗的形态变化,并取烟草相同部位叶片测定气孔开度,重复3 次。同时在漂浮育苗盘中进行干旱胁迫试验,干旱7 d 后复水1 d。烟苗干旱处理7 d 后取烟草相同部位叶片分别测定生物量、叶绿素含量(质量分数)、死细胞数量和活性氧状况、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、丙二醛(MDA)含量、脯氨酸(Pro)含量、离体叶片失水率和烟草抗旱相关基因表达量,并采集和保存0 d 和7 d 的烟草叶片于-80 ℃冰箱中备用。重复3 次。
1.3 测定项目与方法
用质量体积分数1%碘-碘化钾溶液染色并利用生物显微镜(N-117M,中国宁波永新公司)观察叶片气孔开度[11]。随机观测3 个视野,每个视野下随机选择10 个气孔进行测定。随后用ImageJ软件测量气孔的长轴和短轴,并计算气孔开度[12]。
采用烘干法测定生物量[13]。参照邹琦[14]的方法,使用质量分数为80%丙酮浸提测定叶绿素含量(质量分数)。采用台盼蓝(Trypan Blue)和硝基四氮唑蓝(NBT)染色,并置于超景深显微镜(VHR-5000,日本基恩士公司)下观察死细胞数量和活性氧状况[15-16]。采用氮蓝四唑法测定SOD 活性[17],愈创木酚比色法测定POD 活性[17],硫代巴比妥酸法测定MDA 含量[17],酸性茚三酮法测定Pro 含量[17]。参照徐志文[18]的方法计算离体叶片失水率。
采用Trizol 法提取烟草样品RNA,再使用试剂盒(M-MLV Reverse Transcriptase,美国Invitrogen 公司)合成cDNA 第一链。烟草抗旱相关基因的引物序列见表1,RT-PCR 反应体系和程序均参照孟盈等[9]的方法,最后采用2-ΔΔCT法计算基因表达量。
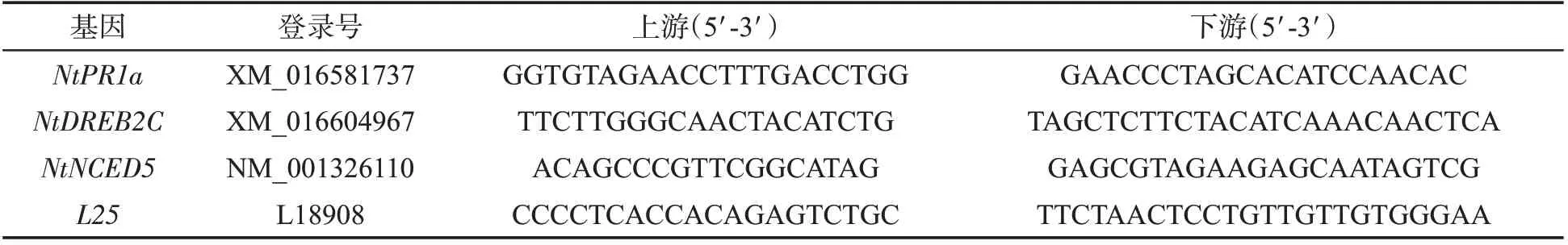
表1 相关基因的引物序列Tab.1 Sequences of primers for related genes
1.4 数据处理
通过EXCEL 和SigmaPlot 10.0 软件进行数据整理,用SPSS 20.0 软件采用单因素方差分析(One-way ANOVA)法进行数据处理、最小显著差数(LSD)法进行数据间差异的显著性检验。
2 结果与分析
2.1 不同浓度PEG-6000 处理对转基因株系形态的影响
从图1 可以看出,随着PEG-6000 浓度的增加和处理时间的延长,烟苗受干旱胁迫的程度越来越大。在PEG-6000 处理3 h 时,10%和15%PEG-6000处理的oe 株系叶片均开始出现萎蔫,而此时ko 和K326 株系叶片并未出现明显变化。PEG-6000 处理6 h 时,10%和15%PEG-6000 处理的oe 株系叶片萎蔫程度进一步加重,K326 株系叶片也开始出现萎蔫,而ko 株系叶片状态依然良好。在PEG-6000处理9 h 时,5%PEG-6000 处理的oe 和K326 株系叶片均开始出现萎蔫,ko 叶片无明显变化,此时10%和15%PEG-6000 处理oe 株系叶片呈现重度萎蔫的枯死状态,K326 株系叶片也表现出严重的失水情况,而ko 株系失水程度则较轻,其萎蔫程度低于K326。这表明oe 株系的抗旱能力低于K326,而ko株系对干旱的抗性最强。

图1 不同浓度PEG-6000 处理oe、ko 和K326 株系的烟苗形态比较Fig.1 Morphological comparison among oe,ko and K326 treated with PEG-6000 of different concentrations
2.2 不同浓度PEG-6000 处理对转基因株系气孔开度的影响
从图2 可以看出,各株系叶片的气孔开度随着PEG-6000 浓度的递增呈现降低趋势。在不同浓度PEG-6000 胁迫下,oe、ko 和K326 株系表现不同,气孔开度也存在差异。正常生长条件下各株系的气孔开度大小一致,随着PEG-6000 处理浓度的升高,oe 株系的气孔开度高于K326,而ko 株系的气孔开度始终低于K326。10% PEG-6000 处理的ko 株系气孔开度为0.29,显著低于K326,15%PEG-6000 处理的ko 株系气孔开度也显著低于K326。这表明ko 株系能够通过降低气孔开度来抵御干旱胁迫。
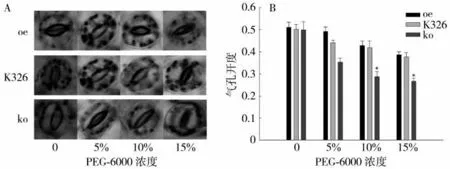
图2 不同浓度PEG-6000 处理9 h 时oe、ko 和K326 株系的气孔开度比较Fig.2 Comparison of stomatal aperture among oe,ko and K326 after treatment with PEG-6000 of different concentrations
2.3 干旱胁迫对转基因株系生长状况的影响
图3 结果表明,干旱胁迫7 d 后(图3B),oe、ko和K326 株系烟苗表现出明显的形态差异。ko 株系烟苗生长势良好,只有底部老叶片萎蔫,上部叶片仍保持挺立,萎蔫程度较轻。而oe 和K326 株系的叶片严重卷曲变黄,其中oe 株系萎蔫程度最大,整株呈现严重的缺水症状。复水后(图3C),ko 株系烟苗能快速恢复正常生长,叶片挺直,而oe 和K326 株系烟苗仍呈萎蔫状态。 这与PEG-6000 处理的试验结果一致。表明ko 株系的耐旱能力高于K326,而oe 株系的耐旱能力较差。
生物量测定结果(图3D)表明,正常生长条件下oe、ko 和K326 株系的烟苗生物量无明显差异。干旱胁迫处理7 d 后,各株系的烟苗生物量均低于正常供水,其中ko 株系的烟苗生物量是K326 的1.43 倍,显著高于K326,说明在干旱胁迫条件下ko 株系烟苗生长发育状况明显优于K326。
干旱胁迫各株系叶绿素含量变化见图3E。干旱胁迫处理7 d 后,各株系叶绿素含量均降低,其中ko 株系叶绿素含量显著高于K326,为K326 的1.27 倍。表明ko 株系能维持较高的叶绿素含量以降低干旱胁迫对光合作用的影响。
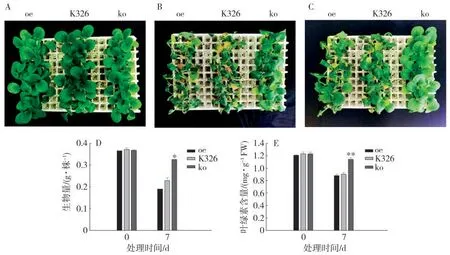
图3 干旱胁迫处理oe、ko 和K326 株系的生长情况比较Fig.3 Comparison of growing situation among oe,ko and K326 under drought stress
2.4 干旱胁迫对转基因株系死细胞和活性氧的影响
对干旱处理后oe、ko 和K326 株系的叶片进行Trypan Blue 染色,见图4。从图中可以看出,oe 株系的染色颜色深于K326,而ko 株系的染色颜色较浅,说明ko 株系细胞受损伤的程度最轻,其死细胞含量最少,而oe 株系细胞受损伤的程度较重,产生的死细胞数量最多。干旱胁迫还能诱导植株产生大量的活性氧(ROS),可引起不同程度的氧化损伤。干旱处理后对oe、ko 和K326 株系的叶片进行NBT 染色,见图4。从图中看出,oe 株系染色程度比K326 更深,而ko 株系的染色颜色比K326浅,这说明oe 株系在干旱胁迫下产生大量的ROS,而ko 株系产生的ROS 较少,氧化损伤程度较低,因此表现出较强的抗旱性。
图4 干旱胁迫处理7 d oe、ko 和K326 株系的Trypan Blue 和NBT 染色比较Fig.4 Comparison of staining among oe,ko and K326 under drought stress by trypan blue and NBT
2.5 干旱胁迫对转基因株系抗氧化酶活性的影响
由图5 可知,正常生长条件下各株系的SOD和POD 活性基本一致。干旱胁迫处理后各株系SOD 和POD 抗氧化酶活性均升高,其中oe 株系SOD 和POD 活 性 均 显 著 低 于K326,而ko 株 系SOD 活 性 是K326 的1.12 倍,POD 活 性 是K326 的1.33 倍。这表明ko 株系能够通过提高酶促防御能力而响应干旱胁迫。
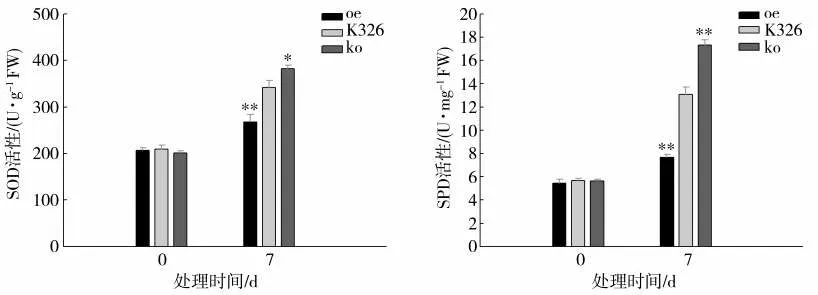
图5 干旱胁迫处理oe、ko 和K326 株系的SOD 与POD 活性比较Fig.5 Comparison of SOD and POD activities among oe,ko and K326 under drought stress
2.6 干旱胁迫对转基因株系MDA 与Pro 含量的影响
由图6 可见,正常生长时各株系的MDA 和Pro含量无明显差异。干旱处理后各株系MDA 和Pro含量均有所增加,其中oe 株系MDA 含量是K326的1.28 倍,而ko 株系MDA 含量极显著低于K326,说明ko 株系膜质受损程度轻于K326。此外,oe 株系中Pro 含量极显著低于K326,而ko 株系Pro 含量较高,是K326 的1.29 倍,表明ko 株系叶片细胞能维持较好的细胞渗透平衡。
2.7 干旱胁迫对转基因株系离体叶片失水率的影响
oe、ko 和K326 株系的离体叶片失水率计算结果(图7)表明,随干旱时间的增加,烟草幼苗叶片失水率不断增大。干旱2 h 时,oe 株系失水率为21.81%,显著高于K326。在干旱处理6~24 h 期间,oe 株系失水率变化幅度最大,其中干旱处理24 h 时的失水率达47.26%,是K326 的1.21 倍。而ko 株系的失水率始终低于K326,干旱处理2~24 h 期间,ko 株系失水率处于较平缓状态,其中干旱处理24 h 时失水率为25.32%,极显著低于K326,表明ko 株系离体叶片的保水能力较强,而oe 株系离体叶片的保水能力较差。
2.8 干旱胁迫对相关基因表达量的影响
oe、ko 和K326 株系中抗旱相关基因NtPR1a、NtDREB2C和NtNCED5表达量见图8。干旱胁迫7 d 时NtPR1a、NtDREB2C和NtNCED5基因表达量均升高,其中,oe 株系的3 个基因表达量均显著低于K326,而ko 株系中NtPR1a、NtDREB2C和NtNCED5基因表达量均极显著高于K326,分别提高4.59、1.43 和1.30 倍。这表明NtCycB2基因敲除后的烟草株系能够通过提高抗旱相关基因的表达量而响应干旱胁迫。
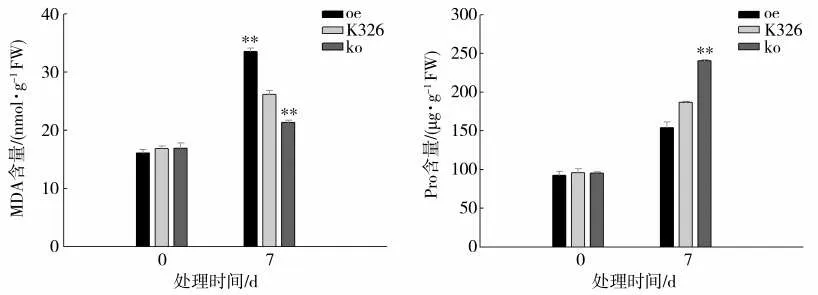
图6 干旱胁迫处理oe、ko 和K326 株系MDA 与Pro 含量比较Fig.6 Comparison of MDA and Pro contents among oe,ko and K326 under drought stress
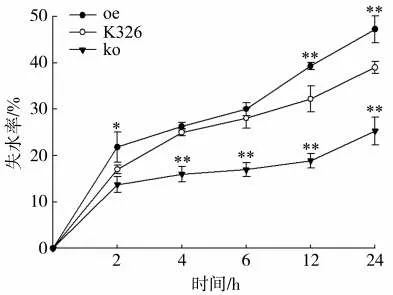
图7 oe、ko 和K326 株系离体叶片的失水率变化Fig.7 Dehydration rate of detached leaves of oe,ko and K326
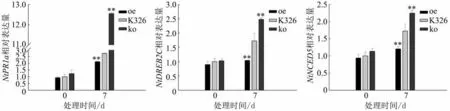
图8 干旱胁迫处理oe、ko 和K326 株系抗旱相关基因表达模式分析Fig.8 Expression patterns of drought-resistant genes in oe,ko and K326 under drought stress
3 讨论
干旱对植物造成伤害的主要方式为渗透胁迫和氧化损伤[19]。使用PEG-6000 处理可造成渗透胁迫,降低水势而导致植物缺水[20]。在本研究中,利用不同浓度的PEG-6000 处理转基因株系(oe 和ko),与K326 相比,随着PEG-6000 浓度的增加和胁迫时间的延长,各株系表现出不同程度的萎蔫状况,其中,多腺毛ko 株系生长状况较好,抗旱性较强,其气孔开度明显低于K326,这与姚静远等[21]和李波等[22]的研究结果相似,即较高的腺毛密度和较小的气孔开度可促进植物更好地适应干旱环境。ko 株系的生物量和叶绿素含量在干旱胁迫下都能保持较高水平,这与Jimenez 等[23]和霍勇锦等[24]的研究结果一致,即抗旱性较强的品种能够维持较高的生物量和叶绿素含量。
另外,干旱胁迫下植物细胞内ROS 产生与清除之间的平衡受到破坏,ROS 大量产生与积累会诱导氧化应激反应,也可导致细胞死亡[25-27]。本研究中使用Trypan Blue 和NBT 染色分别对死细胞和活性氧进行定性观察,发现ko 株系的染色颜色均较浅。有研究表明多种抗氧化酶等物质含量可反映出干旱胁迫后细胞脂质氧化程度,其中,MDA 作为一种脂质过氧化产物,其含量高低代表着膜受损程度[28],而Pro 作为一种渗透调节物质,也对细胞的渗透调节起着关键作用[29]。本研究中发现,ko 株系中死细胞数量较少且活性氧积累水平较低,其抗氧化酶活性和Pro 含量较高,而MDA含量较低,表明ko 株系具有较强的ROS 清除能力和产生抗性小分子物质等维持细胞渗透平衡,这与丁丹阳等[30]的研究结果一致,即抗旱性较强的品种氧化损伤相对较小。此外,植物表皮毛对叶面蒸腾作用具有一定调节作用,并改变叶片的含水率[22]。本研究中发现,ko 株系离体叶片的失水速率较为平缓,失水率低于K326,这与宋海慧[5]的研究结果一致,证实了高密度腺毛叶片具有较强的保水能力。
本研究中对相关抗旱基因的表达分析发现,NtPR1a转录会诱导其他抗性相关基因大量表达,从而有利于提高烟草的抗性[31]。DREB 类转录因子与DRE 顺式作用元件相结合,能够调节抗旱相关功能基因的表达,使植株的抗旱能力显著提高[32]。NCED通常作为脱落酸(ABA)生物合成的重要指标[33],能够参与植物响应多种非生物胁迫的应答反应。RT-PCR 结果表明,NtCycB2敲除后均能显著提高NtPR1a、NtDREB2C和NtNCED5的表达量,与李涵哲等[34]的研究结果相似,这表明NtCycB2可通过负调控相关抗性基因的表达来提高烟株抗旱性。本研究中仅在幼苗期进行试验,而其整个生育期的实际抗旱性能仍需要进一步验证。此外,对于NtCycB2敲除株系的其他抗性以及性状表现是否优良尚不清楚,还有待进一步研究。
4 结论
NtCycB2具有负调控烟草抗旱性的生物学功能。NtCycB2敲除后的多腺毛株系ko 的抗旱性增强,ko 株系能较好地维持生长状态,其生物量和叶绿素含量均较高,相关抗氧化酶活性较强,且该株系在受到干旱胁迫后能显著降低气孔开度,多个抗性相关基因的表达量也显著提高。因此NtCycB2可通过影响烟草株系的一系列生理生化反应及相关基因表达来提高烟草的抗旱能力。

