RseA基因影响耻垢分枝杆菌药物敏感性的生物信息学分析与初步验证
熊雨菡,李智颖,卢 楠,陈俊伊,唐佳玲,徐 蕾,杨 春,何永林
全球每年约有1 000万新发结核病例,其中有150万人死于结核病(Tuberculosis,TB)[1]。而结核分枝杆菌多药耐药(MDR)和广泛耐药(XDR)突变株的出现和传播将阻碍结核病的治疗[2]。2018年,全球预计有484 000人患上了利福平(结核病最有效的一线药物)耐药结核病(RR-TB),其中78%患有多药耐药结核(MDR-TB)[1],而结核分枝杆菌变得对药物治疗不敏感可能是由于其进入了非复制状态[3]。有研究表明,在大多数个体中,最初的感染转变为无症状的潜伏状态,结核分枝杆菌以无复制的持续状态存在于宿主肉芽肿中,且代谢活性低[4-5]。导致这种生理状态建立的不利环境因素包括低氧、营养不良、pH低以及宿主免疫反应产生的氧化和亚硝化应激[5]。这种适应主要归因于RNA聚合酶参与的能够调节其复杂基因组表达的转录调控网络[6]。σ因子与RNA聚合酶全酶结合,提供其对特定启动子的特异性,并在调节基因表达和适应原核生物的压力中起关键作用[7]。结核分枝杆菌基因组编码13个σ因子,辅助σ因子σE是结核分枝杆菌中最典型的σ因子之一,它对于在不同压力环境下(包括表面和氧化应激条件)的生存至关重要[8]。我们前期研究发现,σE可通过促进耻垢分枝杆菌进入持留状态影响抗结核药物的敏感性[9]。
近来,抑制σ因子功能的抗σ因子也受到越来越多的关注。结核分枝杆菌的抗σE因子RseA由Rv1222基因编码。耻垢分枝杆菌是一种在安全性、生长特性和遗传易感性方面用于分枝杆菌研究的模式生物,已被广泛用于抗生素的作用和耐药性研究[10]。耻垢分枝杆菌的RseA由基因MSMEG_5071编码。RseA编码基因紧邻下游σE,已被证明是可直接调控σE的特异性抗σE因子[11],而至今针对RseA在抗结核药物敏感性的机制研究较少。因此,本实验构建了重组耻垢分枝杆菌pMV261-MSMEG-5071/MS,通过转录组测序技术和生物信息学方法筛选出差异表达基因(differentially expression genes,DEGs),并对其进行了基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析,构建了蛋白-蛋白相互作用(protein-protein interaction,PPI)网络,通过MCODE插件筛选出可能受RseA调控的基因及其可能的分子机制并进行初步验证,为耐药结核病的治疗提供新思路。
1 材料与方法
1.1实验材料 质粒pMV261、E.coliDH5α和耻垢分枝杆菌(Mycobacteriumsegmatismc2155,MS)和RpfE蛋白由实验室保存。HindⅢ、BamH Ⅰ和T4连接酶(Thermo Fisher Scientific),DAB显色试剂盒(康为世纪),卡那霉素(Genview),胶回收试剂盒、质粒提取试剂盒、蛋白Marker(Takara),小鼠抗组氨酸单克隆抗体(Bioworld Technology),HRP标记的羊抗兔IgG(美国Signalway Antibody),SDS-PAGE凝胶配置试剂盒(EpiZye),异烟肼、利福平、乙胺丁醇、左氧氟沙星、环丙沙星、链霉素(北京睿博兴科)。
1.2方 法
1.2.1重组耻垢分枝杆菌的构建 根据NCBI GenBank(基因序列号NC_008596.1)中耻垢分枝杆菌MSMEG_5071的基因序列设计引物。以MS基因组为模板进行PCR扩增,将PCR产物和质粒pMV261分别经BamHⅠ/HindⅢ酶切并用T4连接酶连接后,转化至E.coliDH5α感受态细胞中,涂布在含有卡那霉素的LB固体培养基上,长出单菌落后,挑取单菌落培养并测序验证。将构建成功的pMV261-MSMEG_5071重组质粒经2.5 KV、4 ms电转至耻垢分枝杆菌感受态中,涂布在含有卡那霉素的7H10固体培养基上,长出单菌落后,挑取单菌落培养以获得重组耻垢分枝杆菌pMV261-MSMEG_5071/MS。
1.2.2Western blot验证蛋白RseA的表达 将构建成功的重组耻垢分枝杆菌pMV261-MSMEG_5071/MS接种于含有卡拉霉素的7H9培养基中,37 ℃培养至OD600为0.6~0.8,分别于40 ℃、42 ℃、44 ℃和46 ℃热诱导3 h后,37 ℃,160 r/min培养4 h,离心收集菌体后,于-80 ℃反复冻融3次,加入无菌PBS混匀,超声碎菌,离心后分别收集上清与沉淀。将样品经金属浴100 ℃ 10 min变性,通过Western blot验证。
1.2.3样本准备及转录组测序 将重组菌接种于含有卡那霉素的7H9培养基中,培养至OD600为0.8,42 ℃热诱导3 h,加入10 μg /mL EMB,37 ℃,180 r/min培养48 h,离心收集菌体后,PBS洗涤3次,置于液氮盒中,送至上海美吉生物医药科技有限公司进行转录组学测序和生物信息学分析。
1.2.4测序数据质控 通过Illumina Hiseq 测序获得的原始图像经base calling转换为序列数据,即原始数据raw data。使用Sickle和SeqPrep质控软件除去reads中的adapter序列、5′端含有非A、G、C、T的碱基和含N的比例达到10%的reads,修剪测序质量较低的reads末端 (测序质量值小于Q20),弃置经去adapter及质量修剪后长度小于25 bp的小片段,得到高质量reads,即clean data,并对数据进行质量评估。通过Diamond分析软件进行核糖体RNA污染率评估,若rRNA含量低于15%,则可进行后续分析。
1.2.5DEGs分析 使用Bowtie2软件计算出每组中各个基因的表达量,通过DEGseq分析RseA基因过表达耻垢分枝杆菌组及空质粒对照组的DEGs。筛选差异倍数(fold change)≥2且P≤0.001的基因为显著DEGs。
1.2.6GO功能富集和KEGG信号通路分析 GO是一个在生物信息学领域中广泛使用的本体,是实现统一基因相关数据、进行数据转换和开展数据挖掘的基础,包括分子功能(molecular function,MF)、细胞组分(cellular components,CC)和生物学过程(biological process,BP)。KEGG是从分子水平信息了解高级功能和生物系统的实用程序数据库资源。本实验通过DAVID6.8对DEGs进行GO分析及KEGG分析。P<0.05为功能和通路具有统计学意义。
1.2.7PPI网络的构建 STRING(https://string-db.org/)是可用于PPI网络功能富集分析的在线数据库之一。在STRING中输入DEGs,以得到其PPI关系(sore>0.9),通过Cytoscape 3.7.2软件构建PPI网络。通过复杂分子检测(molecular complex detection,MCODE)插件筛选出最重要模块,对模块进行GO功能富集分析和KEGG信号通路分析,P<0.05差异具有统计学意义。并筛选出模块中连接度最高的前8个hub基因。
1.2.8复苏指数的测定 将重组菌培养至生长对数期,调节OD600至0.5,用含有卡那霉素的7H9液体培养基洗涤2次,离心后分别用含有100 μg /mL异烟肼(isoniazid,INH)、25 μg /mL利福平(rifampin,RIF)、10 μg /mL乙胺丁醇(ethambutol,EMB)、10 μg /mL左氧氟沙星(levofloxacin,LVFX)、10 μg /mL环丙沙星和6.4 μg /mL链霉素(streptomycin,STRE)的7H9培养基重悬,37 ℃,180 r/min培养48 h。离心弃上清,用7H9培养基重悬后分为2组。一组等倍梯度稀释至106,所有浓度的菌液各吸取10 μL加至7H9固体培养基上,37 ℃培养3 d,计数;另一组用含有 20 ng/mL RpfE(可以促进非复制的持留菌复苏生长[12])的7H9液体培养基等倍梯度稀释至106,每浓度菌液吸取200 μL加至96孔板,并设置复孔,96孔板四周用200 μL 7H9液体培养基封板,于37 ℃培养2周后,观察并记录阳性细菌孔,查表得到最大可能数(Most probable number,MPN)。通过log10(MPN)-log10(CFU)计算得出的复苏指数(Resuscitation Index,RI)来表示其复苏能力[13]。
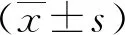
2 结 果
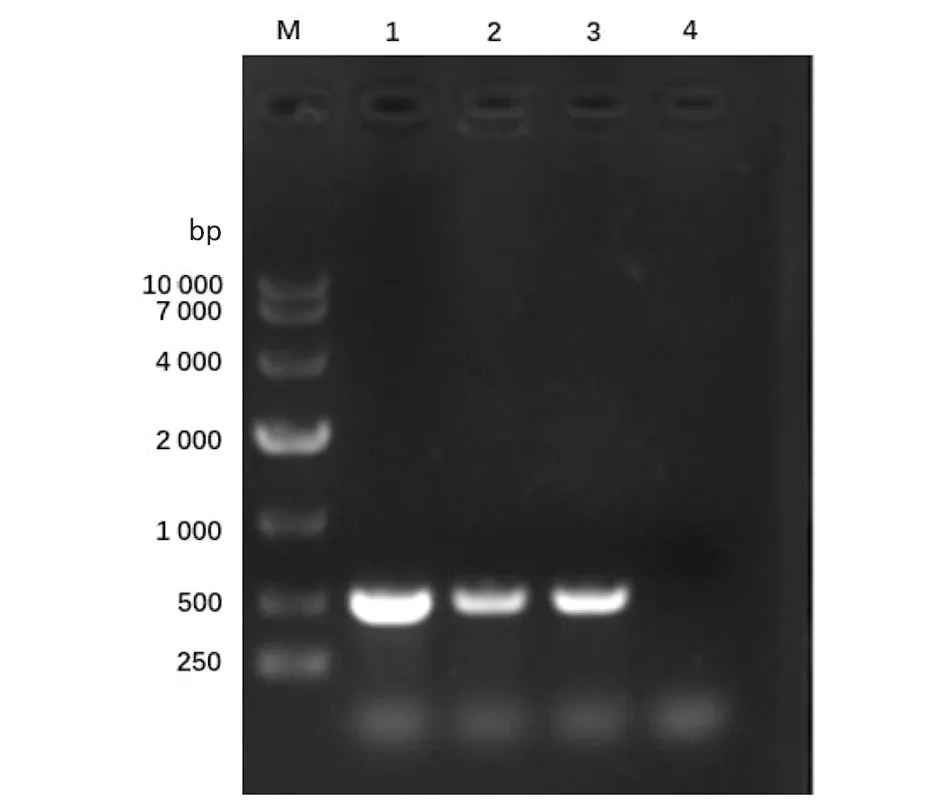
2.1重组耻垢分枝杆菌pMV261-MSMEG_5071/MS的构建及验证 以MS基因组为模板,扩增得到的PCR产物大小约为400 bp,与预期大小一致(见图1)。将构建成功的重组质粒pMV261-MSMEG_5071经BamHⅠ/HindⅢ酶切后,酶切片段大小与预期一致(图2)。将重组质粒pMV261-MSMEG_5071电转入耻垢分枝杆菌,40 ℃、42 ℃、44 ℃和46 ℃诱导表达,超声碎菌处理,离心后,收集上清与沉淀,经Western blot验证,获得分子量为17 kD左右的条带,与预期大小一致(图3)。
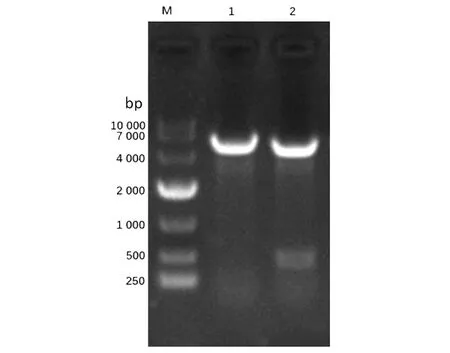
2.2两组间DEGs分析结果 转录组测序结果显示,两组间共筛选出2 403个DEGs,其中2 335个上调基因,68个下调基因。将2 403个DEGs绘制成火山图,其中红色代表上调基因,绿色代表下调基因(图4)。
M.DNA marker;1-3.MSMEG-5071;PCR product is about 400bp;4.H2O as a control.
M.DNA Marker;1.pMV261-MSMEG-5071;2.Double digestion

M.Marker;1-8.supernatant and precipitation of pMV261-MSMEG-5071 lysate induced at 40 ℃,42 ℃,44 ℃,46 ℃;9.No-load strain induced at 42 ℃ for 3 h.
图4 DEGs火山图
2.3GO功能富集和KEGG信号通路分析 将筛选出的DEGs进行GO分析,发现DEGs共参与了155个生物学过程(P<0.05),其中MF主要富集在转录因子活性,序列特异性DNA结合、核酸结合转录因子活性和核酸结合;CC主要富集在细胞内,转移酶复合物,转移含磷基团;BP主要富集在氮化合物代谢过程的调控、RNA代谢过程的调控和细胞代谢过程的调控等过程。GO富集的部分生物学过程见图5。KEGG分析显示,DEGs参与了8个KEGG信号通路(P<0.05),主要富集在萜类骨架的生物合成、果糖和甘露糖代谢和同源重组等通路(表1)。
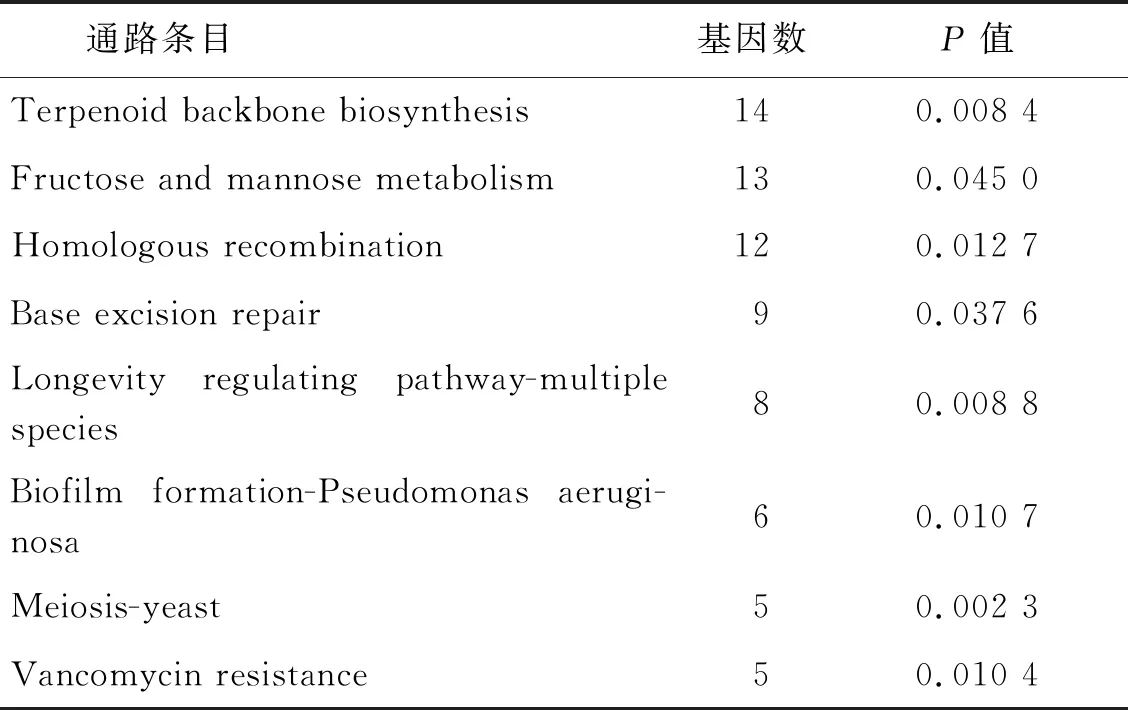
表1 DEGs的KEGG通路分析
2.4PPI网络 通过STRING在线分析软件获得DEGs的PPI关系,构建PPI网络。结果显示,共有1 136条边缘数和594个hub基因(图6)。使用插件MCODE分析出的最重要模块含有16个hub基因和119条边缘数(图7)。对这16个hub基因进行GO分析和KEGG分析。GO分析结果显示,这16个hub基因主要富集在翻译、核糖体的结构成分和核糖体等功能(表2)。KEGG分析结果表明,其主要富集在核糖体通路(表3)。
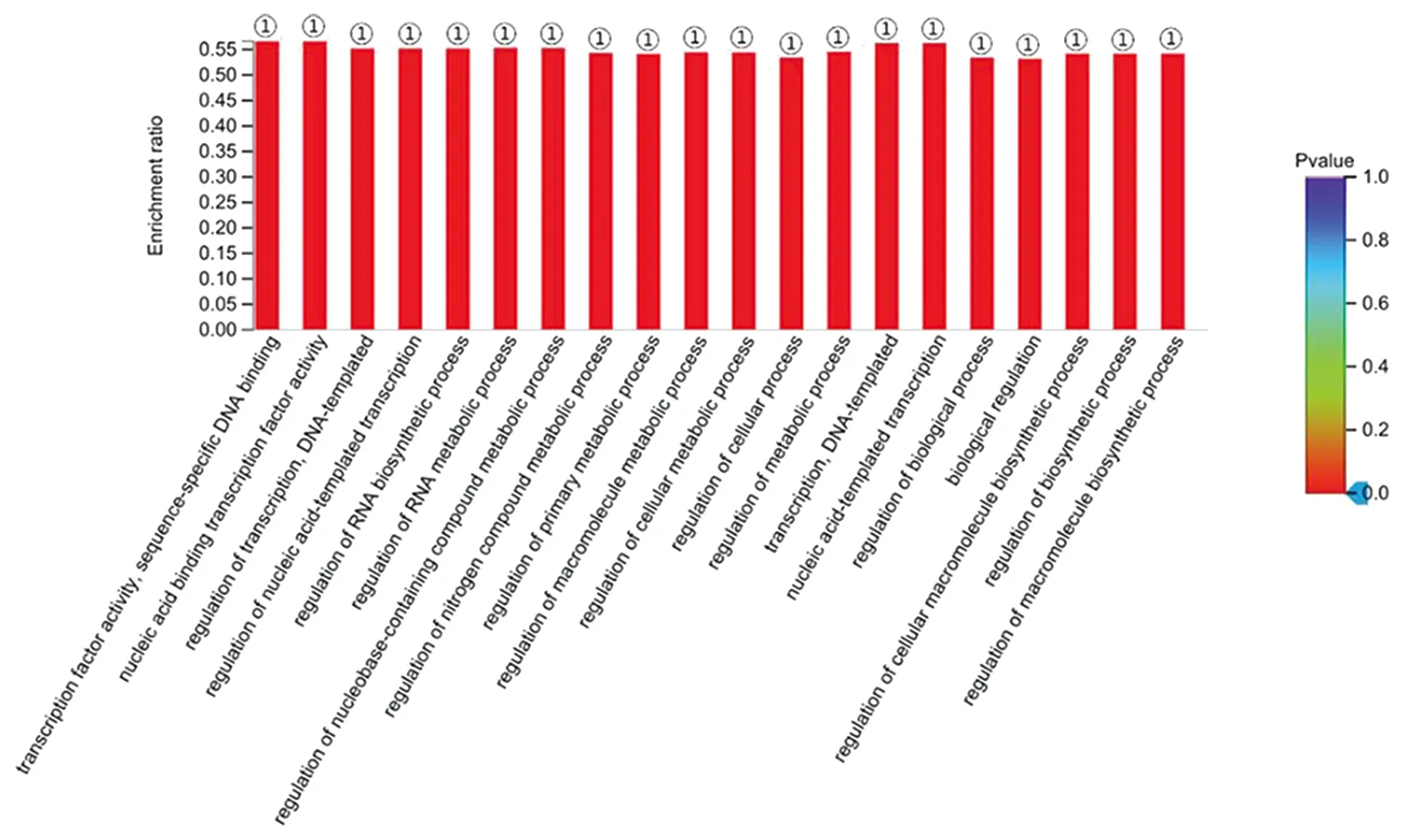
①:P<0.001

表2 模块内基因的GO富集分析

表3 模块内基因的KEGG通路分析
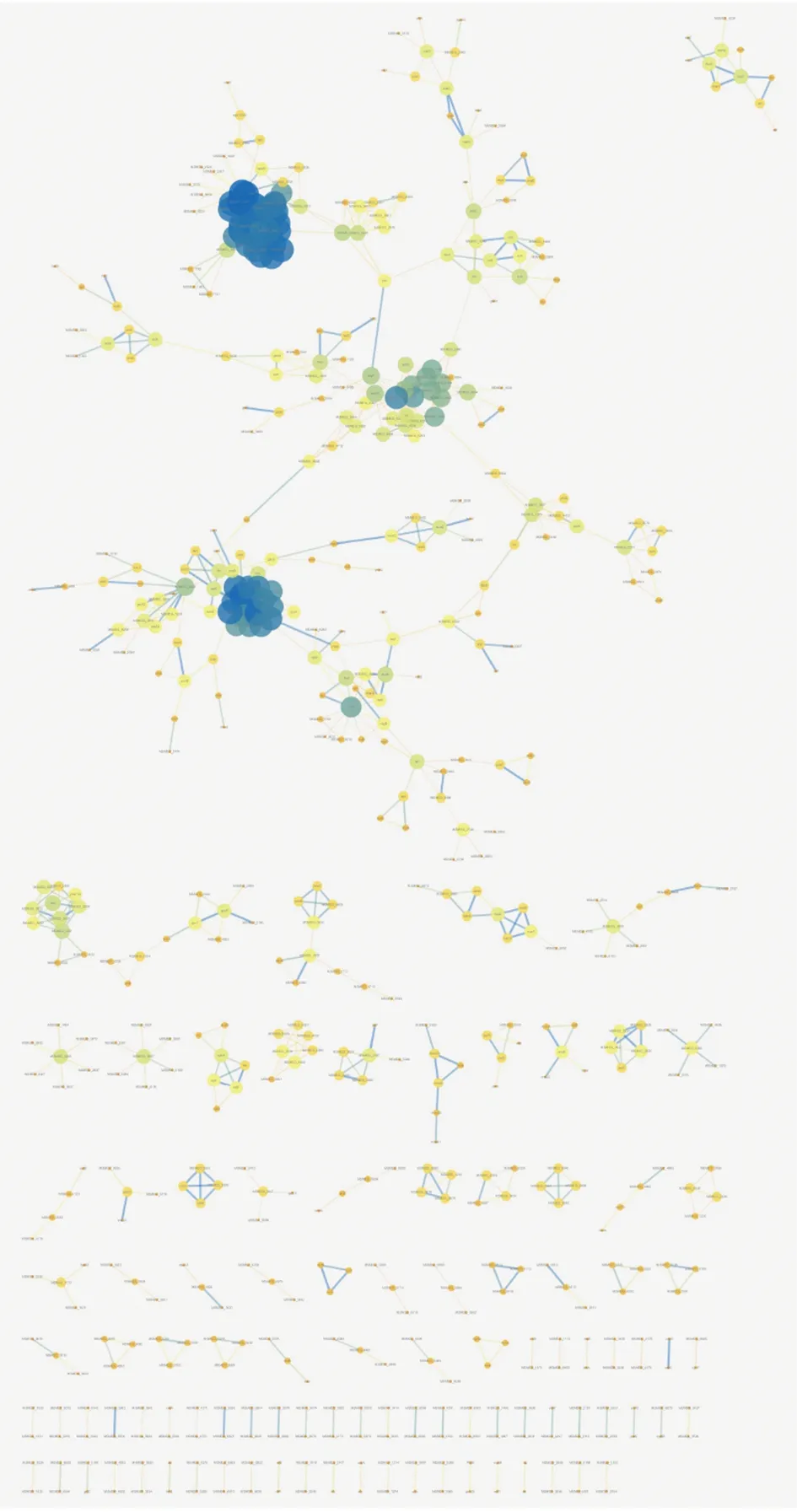
图6 PPI网络图
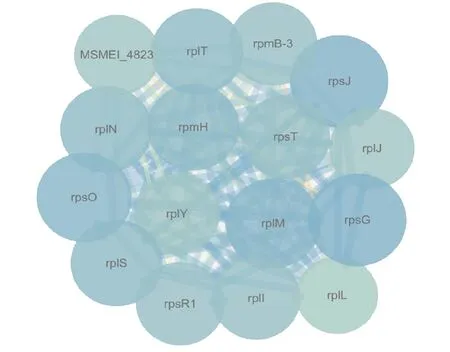
图7 PPI中MCODE分析得到的最高分子模块
2.5RseA过表达对药物诱导的持留菌复苏情况的影响 分别用高浓度药物INH、RIF、EMB、LVFX、CPFX和STRE处理细菌48 h,诱导细菌处于非复制状态,用含有20 ng/mL RpfE蛋白的7H9促进持留菌复苏,观察两组菌复苏情况。INH、RIF、EMB、LVFX和CPFX 5种药物处理后,MSMEG_5071过表达组复苏指数明显低于对照组(图8),差异有统计学意义(tINH=4.37,tRIF=7.26,tEMB=6.75,tLVF=11.13,tCPFX=8.24,tSTRE=0.02;P<0.05,PINH=0.011 966,PRIF=0.001 912,PEMB=0.002 512,PLVF=0.000 371,PCPFX=0.001 185,PSTRE=0.987)。
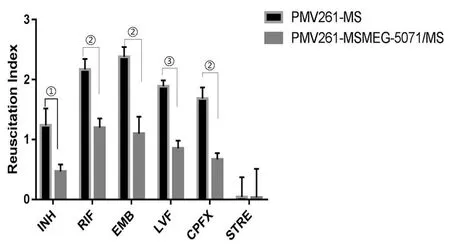
①P<0.05,②P<0.01,③P<0.001
3 讨 论
本研究通过生物信息学分析,比较了pMV261-MSMEG_5071和含有空质粒pMV261的耻垢分枝杆菌的转录组测序结果,共筛选出2 403个DEGs,其中上调基因2 335个,下调基因68个。同时,分析了这些基因的PPI关系,构建了PPI网络并通过MCODE插件分析,筛选了RseA影响耻垢分枝杆菌药物敏感性的关键靶向基因。其中,筛选出的前8个基因,rpsG、rplM、rpsO、rpsT、rpmH、rplS、rpsJ、rplT可能在RseA影响耻垢分枝杆菌药物敏感性过程中具有重要作用。
rpsG编码核糖体蛋白S7,该蛋白位于核糖体小亚基(30S)头部,是唯一与mRNA交联的显著靶标,也是通过翻译反馈机制控制核糖体蛋白合成的主要调控元件之一,对于30S亚基的组装至关重要[14-16]。rplM编码核糖体蛋白L13,是核糖体大亚基(50S)组装中的必需蛋白[16]。有研究发现,耻垢分枝杆菌MSMEG_1556(rplM)敲除株无法在42 ℃条件下生长,由此证明了MSMEG_1556(rplM)对于耻垢分枝杆菌的生长至关重要[17]。rpsO编码核糖体蛋白S15,是位于30S亚基平台上的唯一一级结合蛋白。S15与16S rRNA的预先结合是二级和三级核糖体蛋白(r蛋白)S6、S18、S11、S21与新兴复合物结合所必需的[18]。由此证明,S15参与了亚基缔合并在30S亚基组装中发挥了重要作用[19]。rpsT编码核糖体30S亚基蛋白S20,该蛋白直接与16S rRNA结合,并独立于其他蛋白,被定义为一级结合蛋白,由此表明S20在30S亚基的组装中起着关键作用[20]。并有研究表明,缺乏S20的菌株生长速度明显降低[21]。rpmH编码核糖体大亚基蛋白L34,L34的缺乏会导致70S核糖体形成的严重缺陷和生长速率的降低[22]。rplS编码核糖体50S蛋白L19,L19可以抵御抗体,并且与氯霉素的结合有关[23]。rpsJ编码核糖体30S亚基蛋白S10,有实验表明,该蛋白是参与转录抗终止作用的细胞成分之一[24]。rplT编码核糖体50S蛋白L20,参与50S亚基的早期组装步骤以及自身基因表达的反馈控制[25]。
PPI网络模块分析显示,RseA过表达导致多种核糖体蛋白异常表达,核糖体的结构蛋白合成和翻译通路富集。核糖体是核糖核蛋白复合物,由具有21个蛋白和16S rRNA的小亚基(30S)以及具有36个蛋白,23S rRNA和5S rRNA的大亚基(50S)组成,已成功被多种抗生素所靶向[26]。核糖体执行蛋白质生物合成的关键功能,主要分为翻译起始、延伸、终止和再循环4个阶段,而翻译是适应某些环境条件(例如饥饿,物理或化学压力,尤其是休眠)的主要监管目标[27]。因此,推测RseA过表达后,主要通过涉及核糖体的翻译过程影响耻垢分枝杆菌对环境的适应能力,从而影响耻垢分枝杆菌的药物敏感性。
我们采用复苏指数来衡量持留菌的数量多少。使用高浓度药物INH、RIF、EMB、LVFX、CPFX和STRE处理细菌,使其处于非复制的持留状态,通过复苏促进因子(RpfE)复苏后,计数最大可能数MPN,即包括持留菌在内的所有活菌;同时计数未通过RpfE处理的菌落CFU,即不包含持留菌的活菌,两者之差即为复苏指数RI,以此来反应持留菌的多少。实验结果观察到,INH、RIF、EMB、LVFX、CPFX药物作用后,RseA过表达组的复苏指数明显低于对照组,即RseA过表达可能导致持留菌减少;STRE作用后,RseA过表达组与对照组无差异。而STRE是一种氨基糖苷类抗生素,通过靶向核糖体,引起遗传基因误读干扰翻译启动,抑制细菌蛋白质合成,从而杀灭细菌或抑制细菌生长[28]。由此可见,过表达RseA可能影响了核糖体通路,从而影响耻垢分枝杆菌对药物的敏感性。
综上所述,本研究通过生物信息学分析,发现RseA在耻垢分枝杆菌药物敏感性的影响中发挥了重要作用,为RseA以后在结核分枝杆菌的治疗应用提供了新的思路,后续将开展大量的基础研究对此结果进行进一步的验证。
利益冲突:无

