胃腺癌组织PTEN 表达及病理意义
阮正英 范广民 蔡小波 曹学全 陈崇阳
10 号染色体上缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)是迄今首个被发现的具有双特异性磷酸酶活性的抑癌基因,目前被认为是评价肿瘤预后的重要生物学行为指标[1],PTEN 的突变或缺失与消化道、前列腺、脑组织等多种肿瘤的增殖、存活、基因稳定性、侵袭和转移等密切相关[2-3]。PTEN 作用机制的研究,对肿瘤的诊断、预后评估及基因治疗有着重大意义,成为目前的研究热点之一[4]。研究发现,PTEN 去甲基化和再表达,可抑制胃癌细胞生长和转移[5]。因此,以PTEN 为靶点可能是今后治疗胃癌的新方法。本研究通过观察胃癌组织PTEN 的表达,分析其与胃癌生物学的关系,报道如下。
1 资料与方法
1.1 一般资料 收集浙江省台州市中西医结合医院和台州市中心医院2013 年1 月—2018 年12 月收治的胃腺癌患者(胃癌组)80 例。其中伴有淋巴结转移38 例,TNM 分期为Ⅰ~Ⅱ及Ⅲ~Ⅳ各40 例,浆膜层及浆膜内浸润44 例,浆膜外浸润36 例,高-中分化41 例,低分化39 例,合并有幽门螺旋杆菌(HP)感染45 例。取同期慢性胃炎组织(对照组)80 例。本研究获得台州市中西医结合医院医学伦理委员会批准(伦理批件号:2015-007),并取得患者知情同意。
1.2 纳入、排除标准 胃癌组纳入标准:(1)符合《食管癌和胃癌治疗指南》中胃癌诊断标准[6],均行手术治疗,并在术后经病理确诊为胃腺癌;(2)术前均未接受放疗或化疗;(3)所有标本来自医院组织库,临床资料全面。
对照组纳入标准:(1)符合慢性胃炎的诊断标准[7],病理表现为萎缩性胃炎伴(或不伴)肠化,不包括病理表现为异型增生(上皮内瘤变);(2)胃镜检查前均未接受糖皮质激素、免疫抑制剂、放疗或化疗。
排除标准:(1)有其他系统恶性肿瘤,如食管癌、肝癌等;(2)有严重的自身免疫性疾病,如甲状腺功能亢进、糖尿病等;(3)术前用过免疫抑制剂。
1.3 主要试剂 兔抗人PTEN IgG 抗体购自英国biorbyt 公司(生产批号GR168302-1),二抗即用型DAB 染色免疫组化试剂盒购自北京中杉金桥生物技术有限公司(生产批号19021910)。免疫组化SP 法测定PTEN 的表达(工作浓度为1:100)。
1.4 免疫组化法测定PTEN 表达 SP 两步法染色测定PTEN 的表达,胃组织石蜡切片常规脱蜡至水,3%H2O2灭活内原性过氧化物酶,微波抗原,滴加PTEN 抗体,4℃冰箱过夜,室温滴加二抗,二甲基联苯胺(DAB)显色,苏木素复染。
1.5 PTEN 阳性结果判定标准[8]阳性细胞呈棕黄色表达,在200 倍光镜下随机选择5 个视野观察细胞着色情况,计数阳性例数及阳性率。阳性细胞数<5%为阴性(-),≥5%为阳性(+),阳性率=阳性例数/总例数×100%。并对阳性细胞进行灰度扫描,采用免疫组化图像分析系统,得出细胞染色的阳性强度,计算光密度(OD)值。
1.6 统计学方法 应用SPSS 16.0 统计软件,计量资料以均数±标准差()表示,两组间比较采用成组资料t 检验,计数资料以例(率)表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 胃癌组男47 例,女33 例,年龄41~78(62.76±8.02)岁。对照组男42 例,女38例,年龄45~76(62.85±7.55)岁。两组患者性别、年龄比较,差异无统计学意义(P 均>0.05)。
2.2 PTEN 在胃组织表达水平 免疫组化结果显示,阳性细胞多见表达于细胞的胞核中,少量表达于胞浆中。胃癌组PTEN 阳性率和阳性表达强度显著低于对照组(P 均<0.01),见表1、图1。
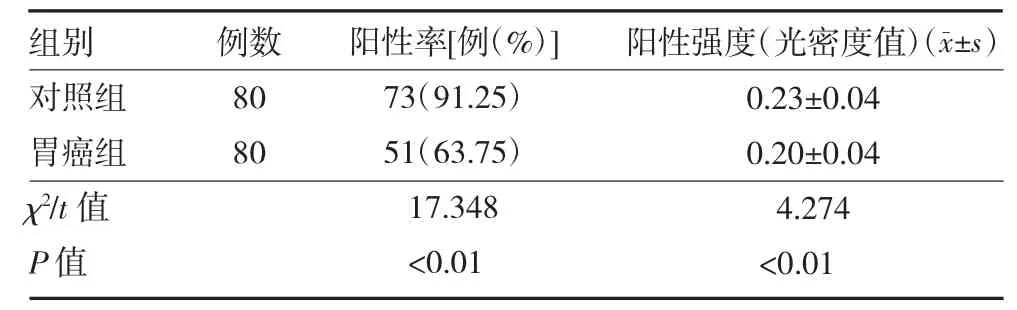
表1 胃腺癌和慢性胃炎组织PTEN 表达水平比较
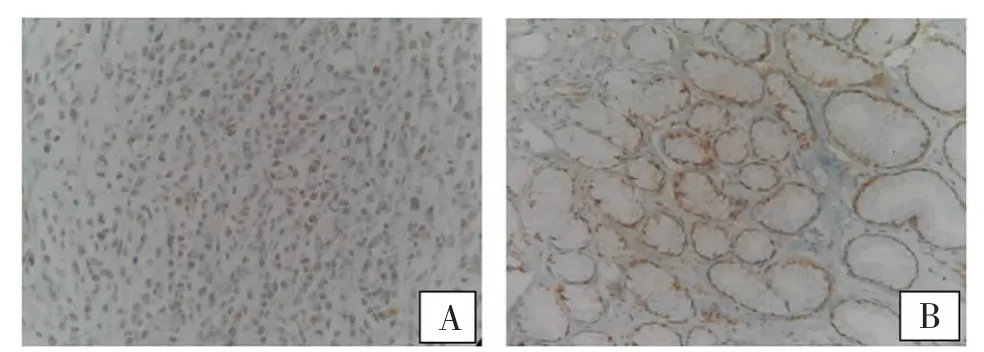
图1 免疫组化法检测胃组织PTEN 的表达(DAB 染色×200)
2.3 胃腺癌组织PTEN 表达水平与临床病理特征的关系 胃癌组PTEN 阳性率和阳性表达强度在低分化、伴有淋巴结转移的胃腺癌组织均分别显著低于高-中分化、不伴有淋巴结转移的胃腺癌组织(P<0.05 或<0.01);浆膜外浸润胃癌组织PTEN 的阳性表达强度显著低于浆膜层及浆膜内浸润(P<0.01),两组阳性率表达差异无统计学意义(P>0.05);TNM 分期为Ⅲ~Ⅳ组胃癌组织的PTEN 阳性率显著低于TNM 分期为Ⅰ~Ⅱ组(P<0.05),两组阳性表达强度差异无统计学意义(P>0.05);不同性别、年龄胃腺癌组织PTEN 阳性率和阳性表达强度比较,差异均无统计学意义(P>0.05)。见表2。
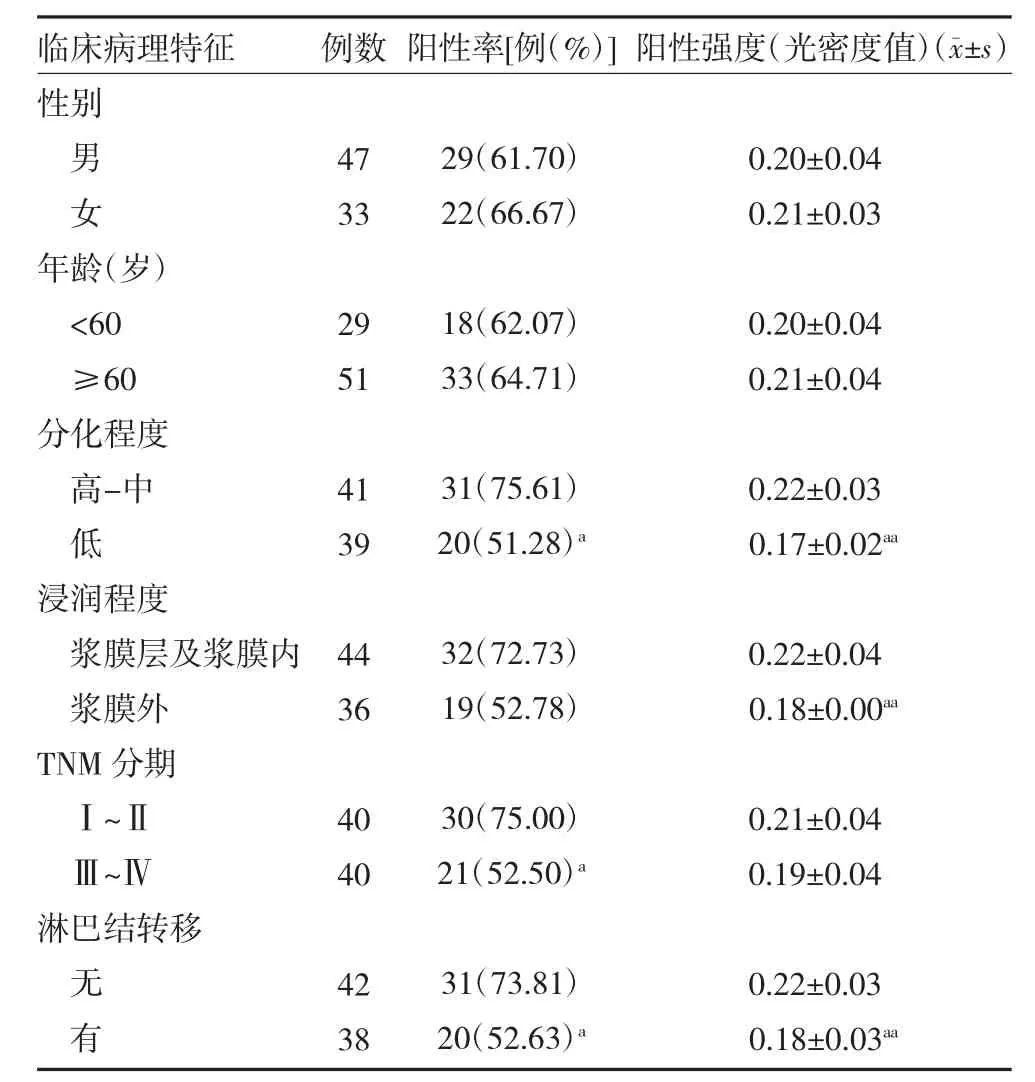
表2 胃癌组织PTEN 表达水平与临床病理特征的关系
2.4 HP 感染胃癌组PTEN 表达水平 HP 阳性感染胃癌组PTEN 阳性率及阳性表达强度低于HP 阴性感染胃癌组(P<0.05 或P<0.01),见表3。
3 讨论
PTEN 是1997 年分离鉴定的一种新颖的抑癌基因,基因位于染色体10q23.3,全长200kb,具有与酪氨酸磷酸酯酶相似的功能,在肿瘤的发生、发展中起重要作用。与抑癌功能相关的结构域主要是氨基端的磷酸酶结构域、脂质结合c2 结构域和羧基端结构域,部分机制可能是通过PI3K/PTEN/Akt/mTOR 信号通路,参与胃癌细胞增殖、凋亡、血管生成、侵袭与转移等过程[9]。过表达转录因子EYA1 可促进胃癌细胞株SGC-7901 PTEN 的表达、抑制PI3K/Akt 通路的激活,抑制细胞胃癌细胞株的增殖、迁移和侵袭能力,抑制细胞凋亡[10]。通过改变miR-590-5p 的表达水平可以上调或下调PTEN 的表达,从而提高胃腺癌细胞对顺铂的敏感性,起到治疗胃癌的作用[11]。

表3 HP 感染胃腺癌组织PTEN 表达水平
本研究发现,阳性细胞多见表达于细胞的胞核中,少量表达于细胞的胞浆中。提示PTEN 可通过细胞质及细胞核部位发挥其病理生理功能[12]。研究还发现,胃癌组织PTEN 的表达强度低于慢性胃炎组织,提示可能由于PTEN 的表达下降,其抑癌作用减弱,降低了对癌细胞生长的抑制作用,从而间接促进癌细胞的生长[13]。
本研究分析了PTEN 与胃癌患者性别、年龄、肿瘤分化程度、淋巴结转移、浸润程度、TNM 分期的相关性,结果显示,在低分化的胃癌组织中PTEN 的表达强度低于高-中分化的胃癌组织,提示随着胃癌细胞的分化程度降低PTEN 的表达水平也随之降低;同时也发现,在伴有淋巴结转移的胃癌组织PTEN表达强度也降低,提示PTEN 与不良预后有关,与杨铭等[14]研究相似。本研究结果还显示,有浆膜外浸润时PTEN 的阳性表达强度降低,而在TNM 分期为Ⅲ~Ⅳ时PTEN 的阳性率下降。表明在有浆膜外浸润或TNM 分期为Ⅲ~Ⅳ时,PTEN 呈现低表达,提示随着疾病生物学恶性程度增加,PTEN 水平下降,其抑癌作用下降。但也有研究认为,PTEN 表达水平与胃癌分化程度和浸润深度无关,而与脏器转移相关[15],支持PTEN 与肿瘤的不良预后有关。本研究发现,HP感染胃癌组织PTEN 表达水平低于无HP 感染组,表明HP 感染后可能与PTEN 的表达水平降低有关,推测HP 感染诱发胃癌发生可能部分通过降低PTEN抑癌的机制[16]。年龄≥60 岁与<60 岁胃癌患者PTEN表达水平无差异,男性与女性PTEN 表达水平也无差异,提示胃癌患者PTEN 表达水平不受患者性别、年龄影响,与庹敏和童仕伦[17]研究结果相似。
综上所述,胃腺癌组织PTEN 表达降低,与胃癌组织低分化、伴淋巴结转移、浆膜外浸润、TNM 分期Ⅲ~Ⅳ期及HP 感染阳性等生物学特性有关,预示胃癌不良预后。

