黄芩苷对氧糖剥夺再复氧损伤模型大鼠海马神经干细胞的保护作用
罗 晨 张 华 欧阳侃
神经干细胞(neural stem cells,NSCs)存在于胚胎和成年哺乳动物的嗅球、海马、齿状回、室管膜等脑区,其增殖、分化调控是神经再生的主要机制之一,对缺血性脑血管疾病所引起的神经损伤具有修复作用,但仅仅依靠内源性NSCs 难以弥补大量的神经元丢失或凋亡[1-2]。中医药可促进内源性神经再生与修复,是治疗缺血性脑血管疾病的潜在治疗策略[3]。研究证实,单味中药、中药有效成分、中药提取物以及中医复方对NSCs 具有调控作用,可以促进缺血性脑血管疾病神经发生与损伤修复[4]。黄芩苷是从黄芩中提取的一种黄酮类化合物,可诱导体外培养的胚胎皮层NSCs 分化为神经元,并抑制其向星形胶质细胞分化[5]。黄芩苷对在体全脑缺血/再灌注损伤大鼠海马NSCs 的增殖具有促进作用,并改善大鼠认知功能[6]。本实验拟采用体外氧糖剥夺/再复氧(OGD/R)损伤模型模拟体内脑缺血/再灌注损伤,观察黄芩苷对模型大鼠海马NSCs 的保护作用。
1 材料与方法
1.1 实验动物 新生24h 内的SPF 级SD 大鼠,雌雄不限,体质量250~300g,由浙江中医药大学实验动物中心提供,动物生产许可证号:SCXK(浙)2013-0016,动物质量合格证号:2008001654872。动物房保持通风,室温22~25℃,湿度60%,12h 日光12h 黑夜,自由饮水采食,所有实验操作严格遵守实验动物的使用和管理原则。本动物实验经浙江省中西医结合医院伦理委员会审核备案。
1.2 主要试剂与仪器 黄芩苷(纯度:93.3%)由中国食品药品鉴定研究院提供(批号110715-2013181);DMEM/F12 培养基(批号12400-024)、B27 添加剂(批号17504-044)均购于美国GIBCO 公司;碱性成纤维细胞生长因子(bFGF,批号AF-100-18B)、青霉素(批号0903311)均由美国Peprotech 提供;四甲基偶氮唑盐(MTT,批号111108)、兔抗BrdU 多克隆抗体(批号ab26890)、Triton X-100(批号V900502)均购于美国Sigma 公司;5-溴脱氧尿嘧啶核苷(BrdU 批号22905630),mil-lipore 公司;二甲基亚砜(DMSO,批号CAS #67-68-5)、胎牛血清(批号c2027050)、D-Hank's(批号H0321)、Earle's 液(批号114049)均由博士德生物工程有限公司提供;乳酸脱氢酶(LDH)试剂盒(批号A020-2),4',6-二脒基-2-苯基吲哚(DAPI,批号28718-90-3)均购于碧云天生物技术有限公司;小鼠抗巢蛋白(Nestin)多克隆抗体(批号AN203)、山羊抗小鼠(Cy3 标记,批号115-165-044)、山羊抗兔(FITC 标记,批号10006588)均购于美国Chemicon 公司;AD340 型酶标仪(美国BECKMAN 公司);IX71 型倒置相差显微镜(日本Olympus 公司);CX41 型奥林巴斯荧光显微镜(日本Olympus);PC1200D 型佳能数码相机(日本Canon),Radiance 2100TM 型激光共聚焦显微镜(中国Bio-Rad 公司)。
1.3 大鼠海马NSCs 培养和鉴定 将新生SD 大鼠脱颈处死,无菌条件下取出全脑并置于4℃预冷DHank's 中,在解剖显微镜下分离出海马组织,剪碎成小块并置于消化液中37℃孵育20min,入D-Hank's反复吹打,过滤、离心、去上清液,细胞重悬于含完全培养基的培养液(2%B27、青霉素、20ng/mL bFGF、DMEM/F12、100U/mL 青霉素)中,以密度2×105/mL接种于75cm2培养瓶中,记为P1 代;细胞在培养箱(37℃、体积分数5%CO2)孵育1 周后机械分离,按2×105/L 密度传代(P2 代),实验用细胞为P3 代。
海马NSCs 的鉴定采取Nestin[7]免疫荧光染色检测,具体步骤:细胞用4%多聚甲醛固定,漂洗,血清封闭,加入一抗小鼠抗Nestin(1∶200)4℃孵育过夜,漂洗,加入二抗山羊抗小鼠(Cy3 标记,1∶1000)室温避光孵育2h,漂洗,在暗室中采取CX41 型奥林巴斯荧光显微镜下观察并拍照。
1.4 实验分组与OGD/R 模型的建立 将P3 代海马NSCs 随机数字表法分为对照组、OGD/R 组、黄芩苷组。对照组:常规条件(37℃、5%CO2)下培养28h。OGD/R 组:将海马NSCs 接种于无糖Earle's 液,置于缺氧罐内,通入厌氧混合气体(95%N2和5%CO2),夹闭缺氧罐的出口和入口,37℃培养4h,然后换成正常培养液继续培养24h,即为OGD/R 模型。黄芩苷组:海马NSCs 接种于含黄芩苷(30μmol/L)的无糖Earle's 液中,置于缺氧罐内,通入厌氧混合气体(95%N2和5%CO2),夹闭缺氧罐的出口和入口,37℃培养处理4h,然后换成含黄芩苷(30μmol/L)正常培养液继续培养24h。
1.5 海马NSCs 存活率和LDH 漏出率检测 MTT法测定:将海马NSCs 接种于96 孔板,加入MTT 溶液(5mg/mL),室温孵育4h,弃除MTT 溶液,加入DMSO处理10min,在酶标仪上570nm 波长处测定细胞的光密度(OD)值;以对照组存活率为100%,各组细胞存活率=(OGD/R 组或黄芩苷组OD 值/对照组OD 值)。
比色法测定:收集每组海马NSCs 的培养液,加入2%Triton-X100 裂解细胞,收集裂解液;按LDH比色法试剂盒测定培养液和裂解液中LDH 含量。LDH 漏出率=培养液LDH 含量/(培养液LDH 含量+裂解液LDH 含量)×100%。
1.6 海马NSCs 凋亡检测 DAPI 测定:细胞加入含DAPI(1:1000)的缓冲液,室温避光处理5min,弃除DAPI 液,漂洗,在暗室中采取CX41 型奥林巴斯荧光显微镜下观察并拍照。
1.7 Nestin/BrdU 免疫荧光染色测定海马NSCs 增殖海马NSCs 加入含BrdU(6μg/mL)的缓冲液,4℃孵育24h。对海马NSCs 行Nestin/BrdU 免疫荧光染色:将海马NSCs 接种于培养板,贴壁3h,4%多聚甲醛固定,血清封闭,一抗混合液[小鼠抗Nestin(1:1000)和兔抗BrdU(1:1500)]4℃孵育过夜,PBS 缓冲液冲洗,二抗混合液[山羊抗小鼠(Cy3 标记)(1:1000)和山羊抗兔(FITC 标记)(1:1000)]室温避光孵育2h,漂洗,荧光显微镜下观察拍照。采用Image J 分析3 组细胞的Nestin/BrdU 阳性结果,每组随机取3 个细胞孔,每孔随机取5 个视野,计数细胞面密度和阳性细胞数。
1.8 统计学方法 应用SPSS 19.0 统计软件分析数据,计量资料以均数±标准差()表示,组间比较进行单因素方差分析;P<0.05 表示差异有统计学意义。
2 结果
2.1 海马NSCs 培养及鉴定 原代培养3 天的海马NSCs 在倒置显微镜下以神经球的方式生长(见图1A);细胞传代培养后经免疫荧光染色显示Nestin 表达呈阳性(见图1B);提示所培养的细胞为NSCs,可用于后续实验。
2.2 黄芩苷对海马NSCs 存活率和LDH 漏出率的影响 MTT 法和比色法检测结果显示,OGD/R 组细胞OD 值和存活率下降,LDH 漏出率增加(P<0.01);与OGD/R 组相比,黄芩苷组细胞OD 值和存活率明显升高,LDH 漏出率显著降低(P<0.01),见表1。
2.3 黄芩苷对细胞凋亡的影响 DAPI 染色显示,OGD/R 组大量细胞核萎缩,出现细胞凋亡碎片或小体,黄芩苷组细胞的上述现象明显改善,见图2。
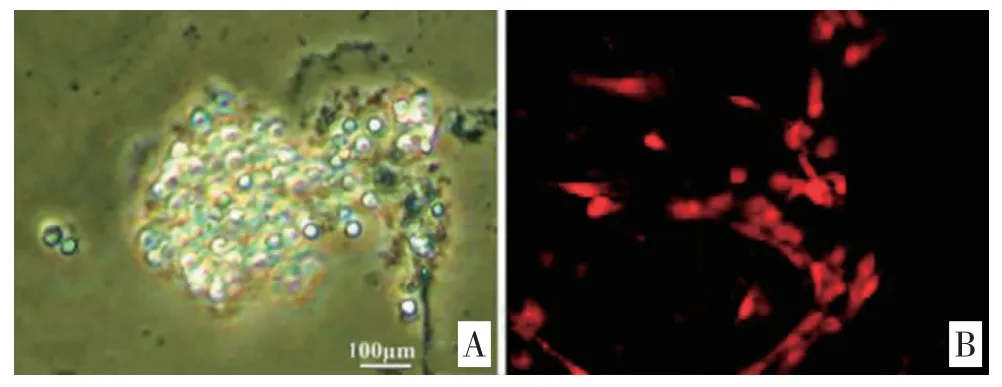
图1 原代海马NSCs 培养及鉴定(免疫荧光染色×200)
表1 黄芩苷对海马NSCs 存活率和LDH 漏出率的影响()
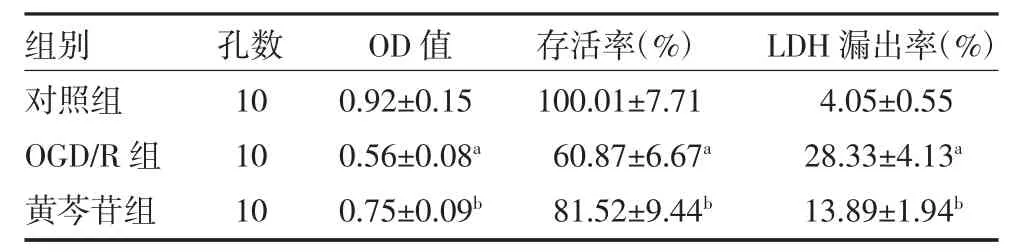
表1 黄芩苷对海马NSCs 存活率和LDH 漏出率的影响()
注:对照组为常规条件(37℃、5%CO2)下培养的NSCs;OGD/R 组为氧糖剥夺NSCs;黄芩苷组为氧糖剥夺NSCs,予含30μmol/L 黄芩苷无糖Earle's 液;NSCs 为神经干细胞;LDH 为乳酸脱氢酶;OD 值为细胞光密度值;OGD/R 为氧糖剥夺再复氧;与对照组比较,aP<0.01;与OGD/R组比较,bP<0.01
2.4 黄芩苷对海马增殖的影响 免疫荧光染色检测NSCs Nestin/BrdU 表达显示,对照组、OGD/R 组、黄芩苷组均有Nestin/BrdU 阳性表达;对照组Nestin/BrdU阳性表达较丰富,阳性细胞之间连接较多,细胞周围有大量大小和长短不一的突起;OGD/R 组Nestin/BrdU 阳性表达位置无异常改变,但阳性细胞较少,细胞之间的连接和细胞周围的突起数量减少,且细胞周围的阳性碎片增多;OGD/R 组上述异常变化在给予黄芩苷后有所改善(见图3)。与对照组比较,OGD/R 组Nestin/BrdU 阳性表达的面密度及细胞数明显降低(P<0.01);黄芩苷组Nestin/BrdU 阳性表达的面密度、细胞数显著多于OGD/R 组(P<0.01),见表2。
表2 黄芩苷对Nestin/BrdU 表达的影响()

表2 黄芩苷对Nestin/BrdU 表达的影响()
注:对照组为常规条件(37℃、5%CO2)下培养的NSCs;OGD/R 组为氧糖剥夺NSCs;黄芩苷组为氧糖剥夺NSCs,予含30μmol/L 黄芩苷无糖Earle's 液;Nestin 为巢蛋白;BrdU 为5-溴脱氧尿嘧啶核苷;OGD/R 为氧糖剥夺再复氧;与对照组比较,aP<0.01;与OGD/R 组比较,bP<0.01
3 讨论
缺血性脑卒中可引起神经元死亡或凋亡,及时恢复缺血区血液灌注,有利于脑内神经元再生,但会进一步加重缺血所致的神经损伤及脑功能、结构破坏,即发生缺血再灌注损伤[8]。体外OGD/R 微环境对NSCs 增殖、分化的影响是体外模拟缺血性脑卒中的重要模型之一,已被广泛用于脑卒中的各种动物实验研究中[9-10]。海马是NSCs 的主要分布脑区之一,该区域神经元与学习、记忆等功能联系密切。生理条件下NSCs 聚集的海马齿区域的氧体积分数为2.5%~3.0%,缺血性脑卒中发生时海马局部的氧体积分数接近于0,引起大量神经元丢失或死亡[11]。Nestin 是主要的胚胎中枢神经系统第Ⅳ类中间丝蛋白,且常表达在发育中枢神经系统中,而在已出现分化的胶质细胞及神经元中几乎不表达,在NSCs 标志物中,Nestin 被广泛认可[12-13]。本研究结果显示,原代培养的海马NSCs 在倒置显微镜下以神经球的方式生长,具有折光性强的特点,经免疫荧光染色后NSCs 细胞呈Nestin 阳性表达,提示本实验培养的细胞为NSCs。

图2 黄芩苷对细胞凋亡的影响(免疫荧光染色×200)

图3 黄芩苷对海马NSCs Nestin/BrdU 阳性表达的影响(免疫荧光染色×200)
本研究结果显示,与对照组比较,OGD/R 组细胞OD 值、存活率明显降低,LDH 漏出率显著增加(P<0.01)。LDH 是活细胞胞浆内含酶之一,正常情况下不能通过细胞膜;当细胞遭到损伤或死亡时可释放至胞外,使细胞培养液中LDH 含量增高[14],说明OGD/R 可降低细胞存活率以及引起细胞死亡。马浚宁等[15]采取OGD/R 诱导NSCs 损伤发现细胞增殖能力明显降低,且可促进细胞发生凋亡。本研究DAPI核染结果显示,OGD/R 组大量细胞核萎缩,出现细胞凋亡碎片或小体。
目前临床或研究领域对OGD/R 诱导大鼠海马NSCs 损伤的标准药未见报道,部分文献报道中药单体对海马NSCs 损伤具有保护作用,但其确切作用尚待研究证实[10]。本研究结果显示,黄芩苷(浓度为30μmol/L)可增强OGD/R 后细胞的存活率,减少LDH 漏出率,并减轻OGD/R 所引起的细胞凋亡。BrdU 是一种胸腺嘧啶衍生物,在细胞处于DNA 合成期时BrdU 可掺入新合成的DNA 中,经免疫组化染色法检测其表达可用于评价细胞的增殖状态[16]。本研究结果显示,OGD/R 组Nestin/BrdU 阳性表达位置无异常改变,但阳性细胞较少,细胞之间的连接和细胞周围的突起数量减少,且细胞周围的阳性碎片增多;OGD/R 组上述异常变化在给予黄芩苷后有所改善。本研究结果还显示,黄芩苷(浓度为30μmol/L)能明显提高Nestin/BrdU 阳性表达的面密度、细胞数,即改善OGD/R 抑制海马NSCs 的增殖。崔猛等[5]观察到7.5、15、30μmol/L 的黄芩苷均可促进体外培养的NSCs 向神经元分化,以30μmol/L 黄芩苷组最明显。林筱洁等[16]也发现,20μmol/L 的黄芩苷可通过调控线粒体自噬,减轻OGD/R 诱导的神经元损伤。综合以上研究表明,黄芩苷(浓度为30μmol/L)能减轻OGD/R 对大鼠海马NSCs 的损伤,并促进其增殖。但黄芩苷能否促进体内脑缺血性损伤后海马NSCs 的增殖、改善神经损伤,则有待进一步探讨。

