SNAI2在口腔鳞状细胞癌中的表达及其对细胞增殖侵袭能力的影响*
张楚楚 白 颖 李福军 金灿辉
口腔鳞状细胞癌是常见的口腔颌面部肿瘤,其恶性程度高、侵袭能力强,患者5 年生存率不超过50%,存活下来的患者也常常因手术致残而严重影响生活质量[1],同时其发病率呈逐年上升的趋势[2],严重威胁着人类的健康安全。因此,找到影响口腔鳞状细胞癌发生发展的关键调控因素就成为提高患者生存率并改善预后的重要途径。近年许多研究指出,转录因子SNAI2(zinc-finger transcription factor-2)与多种肿瘤发生发展密切相关[3],但其在口腔鳞状细胞癌中的生物学效应尚不明确。本研究拟在口腔鳞状细胞癌组织中检测SNAI2 的表达水平,探究SNAI2 对口腔鳞癌细胞增殖侵袭能力的影响,为SNAI2 对口腔鳞状细胞癌的临床诊断、预后评估及靶向治疗提供研究基础。
1.材料与方法
1.1 实验材料 本实验使用的临床样本组织取自我院口腔外科2015 年7 月至2017 年3 月收治的53 例口腔鳞状细胞癌患者,其中男29 例,女24例,年龄60~74 岁,平均年龄65.6±5.2,其中发生于舌根27 例、软腭22 例、腭扁桃体6 例。手术切除的癌变组织及癌旁组织(距原发灶边缘距离大于5cm)均采用液氮保存。
1.1.1 实验仪器 主要实验仪器包括:超净工作台(Thermo Scientific Heraguard ECO1.8),生化培养箱(Thermo Scientific 3111),冷冻离心机(Sigma 2-16KL),超微量分光光度计(Nanodrop 2000),荧光定量PCR 仪(Applied Biosystems 9700),电泳仪及转膜仪(Bio-Rad Mini-PROTEAN Tetra),化学发光仪(Bio-Rad ChemiDocEQ),光学显微镜(Olympus DSX100),切片机(德国徕卡RM2235)。
1.1.2 实验细胞及材料 细胞来源:人口腔鳞癌细胞SCC-090 细胞购自盖宁生物,产品编号CMH-269,人肾上皮细胞293T 购自盖宁生物,产品编号CMH-010。主要实验材料:RPMI1640 及高糖DMEM 培养基、胎牛血清、胰蛋白酶、嘌呤霉素puromycin、脂质体Lipofectamine2000(Thermo Scientific Hyclone 公司),病毒包装质粒pLP1-gag/pol、REV 和VSV-G(addgene),转染促进因子polybrene(sigma 公司),RNA 提取试剂Trizol、逆转录试剂盒及SYBR Green 核酸荧光染料(Takara公司)。蛋白酶抑制剂、蛋白裂解液及BCA 蛋白定量试剂盒(sigma 公司)。MTT 细胞增殖能力检测试剂盒(Promega)。Matrigel 胶(BD Biosciences)。二甲苯、甲醇、无水乙醇及过氧化氢(H2O2)(国药集团化学试剂有限公司),GTVisionTM Ⅲ抗鼠/ 兔通用型免疫组化检测试剂盒(上海基因科技股份有限公司)等。抗体包括β-Actin(abcam,ab5694),SNAI2(abcam,ab51772),金属基质蛋白酶-2(matrix-metalloproteinase-2,MMP-2)(abcam,ab37150),金属基质蛋白酶-9(matrix-metalloproteinase-9,MMP-9)(abcam,ab38898)。
1.2 实验方法
1.2.1 细胞培养 细胞培养条件:37℃,5%CO2 恒温生化培养箱中培养。SCC-090 使用含10%胎牛血清的RPMI1640 培养基培养,293T 使用含10%胎牛血清的DMEM 培养基培养。
1.2.2 RT-PCR 检测组织及细胞中SNAI2 mRNA 的表达水平 RNA 抽提:①组织RNA 抽提:将组织从液氮中取出,低温无合酶的条件下研磨器研磨组织,取约30mg 组织加入1ml Trizol,冰上裂解5min,严格按说明书进行抽提。②收集6cm 培养皿中的细胞,细胞融合度约80%,0.4ml胰蛋白酶消化细胞后1ml 培养基终止消化,500g离心5min,PBS 冲洗3 次,去上清,加入1ml Trizol,冰上裂解5min,严格按说明书进行抽提。Nanodrop2000 超微量分光光度计检测RNA 浓度,取1μg 行逆转录,严格按说明书进行反应,得到20μl PCR cDNA 产物后,无核酶水稀释至500μl。在荧光定量96 孔板中上样,上样体系为:10μl SYBR Green 核酸荧光染料,5μl cDNA 及5μl 引物,设置5 个重复孔,反应条件:预变性94℃4min;扩增条件94℃30 s,60℃1min,总共40 个循环。β-actin 片段大小186bp,SNAI2 片段大小249bp。
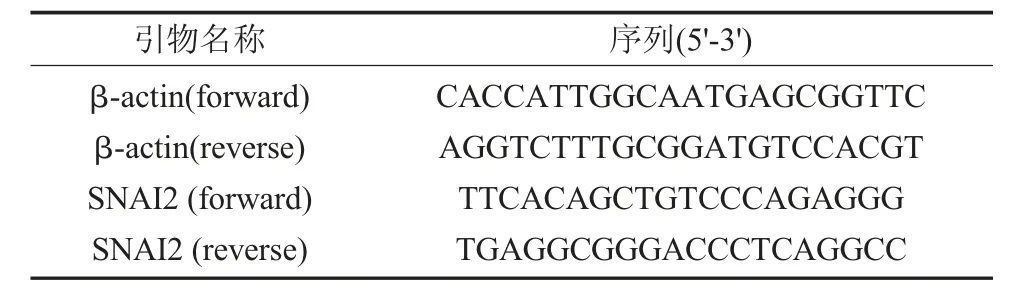
表1 荧光定量引物表
1.2.3 IHC 检测组织中SNAI2 蛋白的表达水平 新鲜组织用固定液处理24h,石蜡切片浸于二甲苯后10min,取出切片稍晾干后置于无水乙醇、90%、85%、80%、75%及70%各级酒精中各5min。0.3%H2O2处理切片10min,用蒸馏水冲洗3 次,切片放入抗原修复液中,放入高压锅中加热至沸腾,盖上压力阀至喷汽后持续4min。修复完成后待切片自然冷却,蒸馏水冲洗5min。37℃条件下干燥后,滴加3%过氧化氢于组织上,避光孵育15min。蒸馏水冲洗5min。滴加1∶1000 SNAI2的一抗于组织上,总体积100μl。室温孵育1h,蒸馏水冲洗5min,擦干组织周围的蒸馏水。滴加100μl 免疫组化试剂盒中的A 液于组织上,室温孵育30min,蒸馏水冲洗3 次,每次5min,擦干组织周围的蒸馏水。滴加100μl 显色剂DAB 溶液于组织上,室温孵育10min,蒸馏水冲洗终止显色。依次置于70%、75%、80%、85%、90%及无水乙醇中脱水,各3min,脱水后浸于二甲苯中15min,中性树胶封片。IHC 染色切片采用光学显微镜进行观察,每张切片选取10 个高倍视野,每个视野观察100 个肿瘤细胞,计算其中平均阳性的细胞比例。以细胞核或细胞质中出现棕黄色颗粒为阳性判断标准,无阳性细胞或阳性细胞<10%的为阴性(-),≥10%的为阳性(+)。
1.2.4 慢病毒转染构建稳定干扰SNAI2 细胞系 干扰质粒靶序列为shSNAI2 1# :TGAGGCGGGACCCTCAGGCC,shSNAI2 2# :TTCACAGCTGTCCCAGAGGG,阴性对照序列shcontrol:GCTGTTTTTTGAGATTTCAG。载体构建方法见参考文献[4],①包装病毒:在六孔板中接种293T细胞,当细胞密度达到融合度80%左右,每孔加入包装质粒pLP1-gag/ pol 0.75μg、REV 0.3μg和VSV-G 0.45μg 及1.5μg 目的质粒,与10μL Lipofectamine 2000 转染试剂充分混合,室温放置20min,PBS 冲洗2 次293T 细胞,加入1ml 无血清DMEM,20min 后将混合好的质粒逐滴加入孔中,轻轻摇动混匀后37℃,5%CO2培养8h,更换DMEM+10%FBS 培养,收集24h 及48h 后的病毒悬液,0.45μm 滤器过滤,收集于新的离心管中,-80℃保存。②慢病毒感染:在六孔板中接种SCC-090 细胞,保证细胞融合度40%左右时RPMI1640+10%FBS 培养基与病毒悬液2∶1 加入相应孔中,总体积3ml,3μL Polybrene,重复感染2d 后,使用puromycin 筛选稳定细胞系,筛选浓度2μg/ ml,待细胞生长良好后完成建系。
1.2.5 MTT 检测细胞增殖活力 将细胞系shcontrol、shSNAI2 1#、shSNAI2 2# 以2000 个每孔接种至96 孔板中,设置5 个重复孔,置于5%CO2,37℃培养箱中培养。待12h 细胞贴壁后,在0h,24h,48h 以及72h 时间点将MTT 溶液与培基以1:9 的比例混合均匀,弃去上清液,每孔加入100μl MTT 混合液,37℃培养箱中孵育1h 后,多孔板酶标仪检测490nm 处吸光度。
1.2.6 Transwell 侵袭实验检测细胞侵袭能力50μg/ ml Matrigel 胶稀释液包被Transwell 小室底的上室面,4℃下风干。50μl 1%BSA 无血清培养液加入基底膜,生化培养箱中37℃放置30min。shcontrol、shSNAI2 1#、shSNAI2 2# 3 种建系细胞胰酶消化,终止消化后转移至1.5ml 离心管,去上清后PBS 洗3 次,更换1%BSA 无血清培养液重悬,细胞计数,取5×105/ 孔的细胞加入Transwell上小室,下室加入500μl 的RPMI1640+10%FBS培养基,置于生化培养箱中培养48h,注意尽量减少晃动。48h 后甲醇固定10min,结晶紫染色15min,光镜下细胞计数,计数方法为200×光镜下观察膜背面侵袭的细胞数,五点取样法观察孔中央及四周各5 个视野,重复取样3 次,求平均值及标准差。
1.2.7 Western Blot 检测细胞SNAI2、MMP-2及MMP-9 蛋白的表达水平 ①蛋白收集及准备工作:SCC-090 shcontrol、SCC-090 shSNAI2 1#、SCC-090 shSNAI2 2# 3 种建系细胞在10cm 培养皿中细胞融合度达80%左右时,0.4ml 胰酶消化后1ml RPMI1640+10%FBS 培养基终止消化,细胞悬液转移至1.5ml 离心管,800rpm,5min,4℃离心,去上清后PBS 洗3 次,配置1ml 蛋白裂解液与蛋白酶抑制剂的混合溶液,每种细胞加入300μl,充分混合后冰上裂解2h,期间不断混匀,16000rpm,15min,4℃离心,收集上清液。使用BCA 试剂盒进行蛋白定量分析,配平体系,上样量50μg。②Western Blot 实验:配置10%丙烯酰胺胶,上样(两个重复孔)后80V 稳压跑出积层胶,调整电压至110V 稳压跑至胶底,湿转至PVDF膜,转膜稳流250mA,10%脱脂奶粉封闭2h,一抗SNAI2、MMP-2 及MMP-9 于4℃孵育12h,浓度分别为SNAI2(1∶1000)、MMP-2(1∶1000)、MMP-9(1 ∶1000)及β-actin(1 ∶2000),二抗于37℃孵育1.5h,β-actin、MMP-2、MMP-9 及SNAI2 均为鼠二抗(1∶2000),发光液曝光显影,ImageLab 4.1 行灰度扫描,待测蛋白样品灰度比值为样品DPI 值(dots per inch 值)与内参基因β-actin 的比值。
1.3 统计方法 本实验统计分析使用SPSS17.0软件。计量资料以平均数±标准差()表示,方差分析比较计量资料间的统计学差异,SNK 法进行多组资料间的两两比较,χ2检验比较计数资料间的统计学差异,检验水准α 均取0.05。
2.结果
2.1 口腔鳞状细胞癌临床样本组织SNAI2 mRNA 及蛋白的表达水平 RT-PCR 结果示口腔鳞状细胞癌组织中SNAI2 mRNA 相对表达量为0.171±0.010 显著高于癌旁组织0.106±0.007,差异具有统计学意义(P<0.001),见图1。IHC 结果示患者口腔鳞状细胞癌组织SNAI2 的阳性率为58.49%(31/ 53)显著高于癌旁组织SNAI2 的阳性率26.45%(14/ 53),差异具有统计学意义(P=0.002),见图2。
2.2 SCC-090 稳定干扰SNAI2 细胞系的构建RT-PCR 结果示SCC-090shSNAI21# 及shSNAI2 2# 细胞系SNAI2 mRNA 的相对表达量显著低于shcontrol 细胞系(F=40.71,P<0.0001),见图3 及表2。Western Blot 半定量的结果也与一致,进一步证实了干扰SNAI2 细胞系的成功构建,见图4。
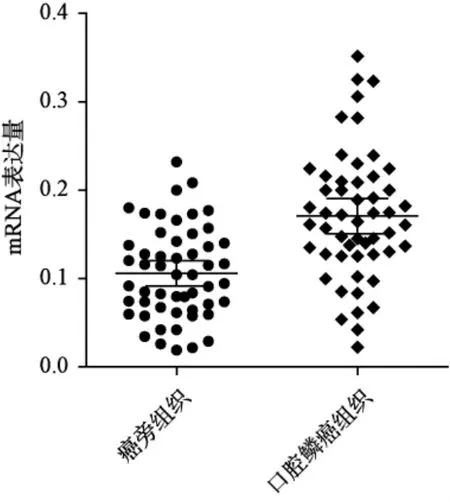
图1 口腔鳞状细胞癌组织与癌旁组织SNAI2 mRNA表达的比较

图2 口腔鳞状细胞癌组织与癌旁组织SNAI2 免疫组化结果的比较

表2 SCC-090 稳定干扰SNAI2 细胞系SNAI2 表达量比较
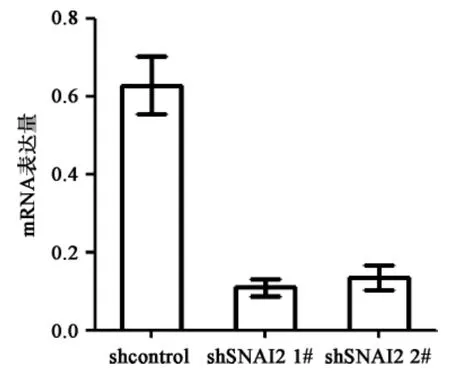
图3 SCC-090 shSNAI2 细胞系mRNA 水平的验证

图4 SCC-090 shSNAI2 细胞系蛋白水平的验证
2.3 SCC-090 shSNAI2 细胞系增殖能力的变化 MTT 的结果显示SCC-090 shSNAI2 细胞系增殖能力在48h 及72h 显著低于对照组SCC-090 shcontrol 细胞,差异具有统计学意义,见图5 及表3。

表3 SCC-090 稳定干扰SNAI2 细胞系增殖能力的比较

图5 SCC-090 shSNAI2 细胞系增殖能力的变化
2.4 SCC-090 shSNAI2 细胞系侵袭能力的变化Transwell 侵袭实验结果显示SCC-090 shSNAI2 1# 及shSNAI2 2# 在48h 后穿过基底膜的细胞数显著低于shcontrol 细胞,差异具有统计学意义,见图6、7 及表4。

表4 SCC-090 稳定干扰SNAI2 细胞系侵袭能力的比较
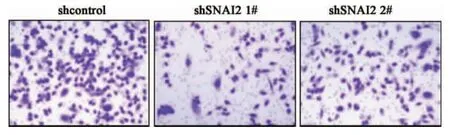
图6 SCC-090 shSNAI2 细胞系侵袭能力的变化

图7 SCC-090shSNAI2 细胞系穿过基底膜细胞数量的比较
2.5 SCC-090 shSNAI2 细胞系MMP-2 及MMP-9 的变化 Western Blot 结果显示,shcontrol细胞的MMP-2 及MMP-9 相对灰度值均显著高于shSNAI2 1# 及shSNAI2 2# 的灰度值,差异存在统计学意义,见图8、图9 及表5。

表5 SCC-090 shSNAI2 细胞系MMP-2 及MMP-9 蛋白表达的比较
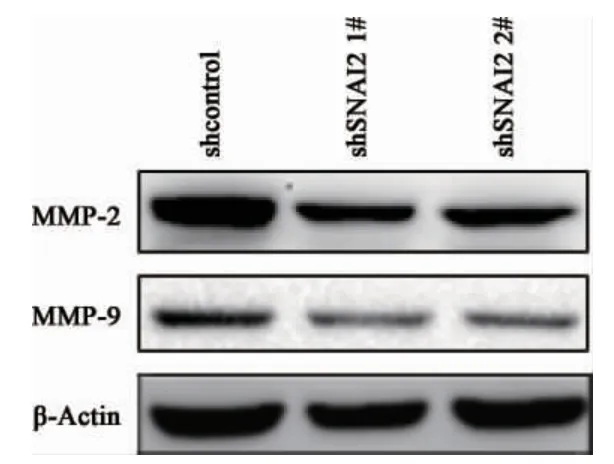
图8 SCC-090 shSNAI2 细胞系MMP-2 及MMP-9表达的变化

图9 SCC-090 shSNAI2 细胞系MMP-2 及MMP-9相对灰度值的比较
3.讨论
SNAI2 位于染色体8q11.21 上,是重要的转录激活因子,在正常机体内参与早期的神经系统发育[5],近年来许多研究指出,SNAI2 在多种恶性肿瘤中表达异常,且一致的认为其表达能够促进肿瘤的发生发展。在乳腺癌中,SNAI2 高表达于恶性程度较高的基底细胞样癌,且其表达与患者TNM分期呈正相关[6],SNAI2 还可促进乳腺癌细胞上皮间充质转化(Epithelial-Mesenchymal Transition,EMT)过程的发生及癌细胞干性的维持,促进细胞增殖及侵袭能力[7],并介导细胞化疗药物抵抗的形成[8]。在胃癌中,SNAI2 高表达于胃癌组织,且与患者的预后呈负相关[9],体外实验中发现SNAI2可促进胃癌细胞的增殖侵袭能力[10]。在非小细胞肺癌中,SNAI2 的高表达不利于患者的预后[11],体外干扰SNAI2 的表达后,A549 肺癌细胞的增殖侵袭能力均降低,并可促进细胞EMT 过程的发生[12],同时有研究指出SNAI2 可通过促进EMT 过程进而介导癌细胞放化疗抵抗[13]。
本研究我们应用RT-PCR 及IHC 技术在临床水平发现,SNAI2 在口腔鳞状细胞癌组织中高表达,提示SNAI2 可能在口腔鳞状细胞癌的发生发展中起到一定作用。我们进一步在体外实验中探究了SNAI2 与口腔鳞癌细胞SCC-090 增殖侵袭能力的关系,慢病毒稳定干扰SNAI2 的表达后,MTT结果显示SCC-090 细胞的增殖能力显著下降,提示SNAI2 在口腔鳞癌细胞的增殖过程中起着促进作用,Transwell 侵袭实验结果显示SCC-090 细胞的侵袭能力显著下降,提示SNAI2 可能对口腔鳞癌细胞的局部侵袭、淋巴结及远处转移过程中发挥重要作用。MMP-2 及MMP-9 是与多种恶性肿瘤侵袭转移能力密切相关的两种分子,其可降解细胞间质,在癌细胞侵袭转移能力中发挥着重要作用[14-16]。本研究在稳定干扰SNAI2 的SCC-090细胞中检测了MMP-2 和MMP-9 的表达,发现干扰SNAI2 表达后,MMP-2 和MMP-9 表达也显著降低,由此我们推测SNAI2 可能通过促进其下游靶基因MMP-2 和MMP-9 的表达介导细胞侵袭能力的增强。
我们将在接下来的临床研究中对患者进行长期随访,绘制生存曲线,从流行病学的角度探究SNAI2 与患者预后的关系,并补充体内实验,进一步证实SNAI2 对口腔鳞癌细胞增殖能力的影响,对SNAI2 与MMP-2 及MMP-9 的相互作用深入研究,进行免疫共沉淀(Co-Immunoprecipitation,Co-IP)实验证实其相互作用,并对相互作用的位点进行分析,为揭示SNAI2 在口腔鳞状细胞癌中的确切作用提供线索,为SNAI2 的分子靶向治疗及患者预后的评估提供新的依据。

