鸡原始生殖细胞转染条件优化
邹娴,何燕华,何静怡,王艳,舒鼎铭,罗成龙
技术与方法
鸡原始生殖细胞转染条件优化
邹娴,何燕华,何静怡,王艳,舒鼎铭,罗成龙
广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,广东省畜禽育种与营养研究重点实验室,广州 510640
为获得鸡原始生殖细胞(primordial germ cells, PGCs)的最佳转染效率,本研究比较不同质粒用量和不同细胞数在3种转染试剂(Lipofectamine 2000、3000和LTX & Plus Reagent)中PGCs的转染效率,利用荧光激活细胞分选技术(fluorescence activated cell sorting technology, FACS)辅助优化Lipofectamine 3000转染试剂,经FACS进一步分选获得带绿色荧光蛋白(GFP)的PGCs,继续培养3周后,移植回注到受体鸡胚中,移植3.5 d后分离性腺拍照观察。结果显示,转染试剂Lipofectamine 3000的转染效率最高,质粒、Lipofectamine 3000转染试剂和PGCs细胞数的配比为3 μg: 4 μL: 0.5×104个,转染5 h转染效率最高,达到23.4%,与现有的研究结果相比提高了2倍以上。移植回注PGCs到受体鸡胚中,荧光显微镜观察到鸡胚性腺中有GFP阳性细胞。本研究综合考虑转染试剂、质粒用量和细胞数量的影响因素以优化PGCs的转染条件,为高效制备转基因鸡及基因编辑鸡的研究奠定基础。
鸡;原始生殖细胞;稳定转染;脂质体
鸡()已被广泛用于早期胚胎发生、毒理学和干细胞等研究,特别是鸟类转基因和基因组编辑研究[1,2]。原始生殖细胞(primordial germ cells,PGCs)是精原细胞和卵原细胞的祖先细胞,能将遗传信息传递给下一代。鸡PGCs经过体外培养及基因修饰后,仍保持其生物学特性,移植回注到鸡胚血脉系统后可迁移到性腺并发育成功能性配子,产生转基因后代[3]。近年来,CRISPR/Cas9技术的发展及应用,使基因编辑鸟类模型成为可能,包括将LOXP位点导入鸡IgH位点、靶向卵球蛋白基因、标记基因插入Z染色体和抗J亚型禽白血病鸡模型[4~7]。但是,在利用鸡PGCs为载体进行基因操作过程中,需经历基因克隆、细胞转染、PGCs移植等步骤,而细胞转染技术则是此过程中的重要环节。目前鸡PGCs转染技术主要有脂质体转染、腺病毒或慢病毒转染和电转染,其中脂质体转染技术因其安全、操作简便、成本低而应用较多。但鸡PGCs脂质体转染效率较低(约5%~10%)[8],限制了其应用。本研究以鸡PGCs为模型,用3种不同脂质体转染试剂(Lipofectamine 2000、3000和 LTX & Plus Reagent)进行转染,摸索质粒浓度、转染试剂复合物配比以及细胞数量等,分析转染效率,旨在优化脂质体转染试剂介导的PGCs转染条件。
1 材料与方法
1.1 材料
种蛋为惠阳胡须鸡种蛋,来源于广东省农业科学院动物科学研究所原种鸡场。在Rcom PRO 50孵化箱(Rutoex)中38.5℃、相对湿度60%孵化至所需日龄。Bac转座子和mPB转座酶质粒由华南农业大学提供;pPB-GFP转座子质粒由本实验室构建,内含由pGK启动子启动双基因和表达的片段(图1)。
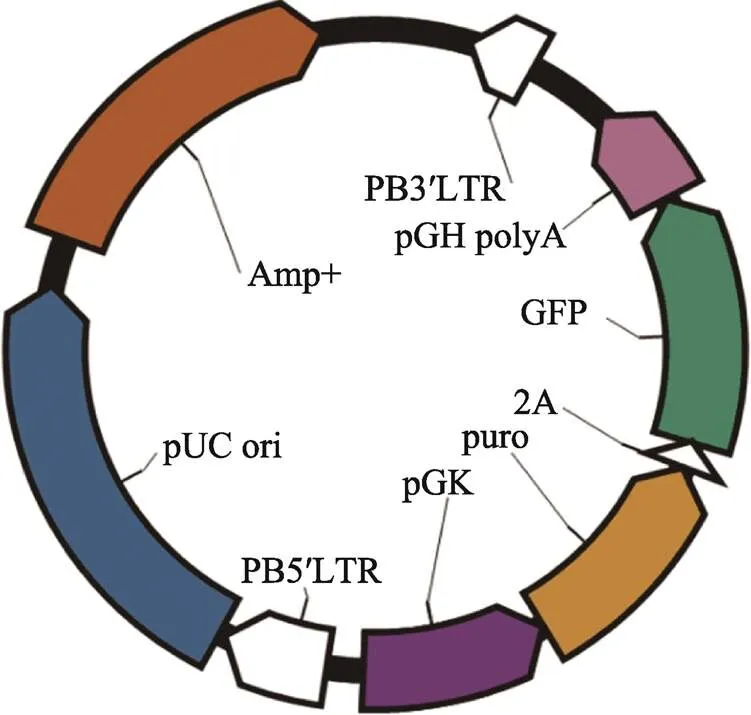
图1 pPB-GFP质粒图谱
1.2 细胞分离及培养
从孵育至5.5 d的惠阳胡须鸡胚性腺分离获得PGCs,然后接种至经钴源处理的BRL饲养层上培养,培养箱条件37℃、5% CO2。PGCs培养液中含56% KO-DMEM、30% BRL培养液、7.5%胎牛血清(FBS)、2.5%鸡血清、1×GS非必需氨基酸、1×GlutaMAXTM、1×双抗(青霉素和链霉素)、0.1 mmol/L β-巯基乙醇、重组人碱性成纤维细胞生长因子(rhFGF)、人干细胞因子(human SCF)。细胞每2 d进行半量换液,每3~4 d传代1次。从孵育至5.5 d的惠阳胡须鸡胚分离获得胎儿成纤维细胞(chicken embryo fibroblasts,CEF),培养箱条件为39℃、5% CO2,培养液中含89% DMEM、10%胎牛血清(FBS)和1%双抗(青霉素和链霉素)。
1.3 qRT-PCR验证分析
利用qRT-PCR验证多能性基因、、和在PGCs和CEF中的表达量。PCR扩增体系为10 μL,包括5 μL SYBR® Green Master Mix,上下游引物各0.5 μL,1 μL cDNA 和3 μL ddH2O。扩增条件:95℃ 1 min;95℃ 30 s,54~58℃ 30 s,72℃ 1 min,34个循环。参考NCBI中鸡相关基因序列,利用Primer 5.0软件设计扩增引物,作为内参基因,由Sangon Biotech公司合成,引物信息见表1。

表1 用于qRT-PCR检测的基因引物
1.4 免疫荧光检测PGCs特征
PGCs铺到有盖玻片的24孔细胞培养板中制作细胞爬片,用4%多聚甲醛室温固定10~15 min,然后Tris base缓冲液(TBS)洗净;加入适量0.1% TritonX-100,室温破膜10 min后TBS缓冲液洗净;10%驴血清室温孵育20 min;甩去血清,滴加一抗工作液,4℃过夜;次日从4℃冰箱拿出,复温15 min,TBS缓冲液洗净,每张切片滴加50 μL荧光二抗(稀释比均为1∶400),37℃孵育30 min,TBS缓冲液洗净(此步骤开始进行避光);甩去TBS,每张切片滴加50 μL新鲜配置的DAPI (稀释比为1∶500),进行荧光染核,室温孵育10 min,TBS冲洗3次,每次5 min;甩去TBS,用抗荧光淬灭封片剂进行封片,避光保存于4℃,在激光共聚焦显微镜下拍照。
1.5 实验分组与带绿色荧光蛋白(GFP)质粒的转染
前期我们在DF1细胞(鸡胚成纤维细胞系)中研究发现当转座子质粒pPB-GFP与转座酶质粒mPB的比例为3~4∶1时,转染效率最高。因此,本研究选择二者比例为3∶1,在PGCs中进行转染试验。
转染前将PGCs转移到24孔板中,每孔接种103个PGCs。将PGCs随机分组,即Lipofectamine 2000 (添加质粒和Lipofectamine 2000,用A表示)、Lipofectamine 3000 (添加质粒和Lipofectamine 3000,用B表示)和Lipofectamine LTX & Plus Reagent(添加质粒和Lipofectamine LTX & Plus Reagent,用C表示)。根据转染试剂说明书做如下分组:A组依质粒剂量及转染试剂Lipofectamine 2000剂量分为A1 (1 μg: 2 μL)、A2 (3 μg: 2 μL)、A3 (5 μg: 3 μL)和A4 (6 μg: 4 μL);B组依质粒剂量及转染试剂Lipofectamine 3000剂量分为B1(1 μg: 2 μL)、B2(1.5 μg: 3 μL)、B3 (3 μg: 4 μL)和B4(5 μg: 6 μL);C组依质粒剂量及转染试剂Lipofectamine LTX剂量分为C1 (1 μg: 1 μL)、C2 (2 μg: 2 μL)、C3 (3 μg: 2 μL)和C4 (5 μg: 3 μL)。每小组3个重复。然后按照转染试剂盒说明进行转染,转染6 h后收集细胞,离心,重悬后接种到新的饲养层上,加入新鲜PGCs培养液,置于37℃、5% CO2培养箱中继续培养48 h后用倒置显微镜照相并分析。
筛选出较高转染效率的组别后,提高细胞密度至0.3×104个/孔或0.5×104个/孔,减少转染时间至5 h,并用含有血清培养基转染,进一步优化转染条件。
1.6 流式细胞术分选稳定表达GFP蛋白的PGCs
将细胞接种到T25培养皿中,脂质体方法转染GFP蛋白质粒。同时以转染GFP蛋白质粒的DF1细胞作为阳性对照,以未转染任何质粒的DF1细胞作为阴性对照进行流式细胞分选。上机分选前,制备无菌操作液清洗流式细胞仪(BD FACSAriaII)。分别收集PGCs和DF1细胞到15 mL离心管中,并用PBS悬浮细胞,细胞数要大于106个/mL。分别用阳性和阴性对照DF1细胞设定流式细胞仪的取样参数和十字门的范围,再进行PGCs分选。
1.7 阳性PGCs移植受体鸡及性腺分离
将PGCs培养液收集到15 mL离心管中,常温离心,用PBS洗一次,常温离心,之后加入适量的PBS悬浮细胞,细胞计数。取所需细胞数,加PBS至总体积的90%,然后加入10%台盼蓝,混匀。取2~2.5日龄鸡胚,鸡蛋尖端处开壳0.5~1 cm,在体视显微镜下找到鸡胚背主动脉,针斜面向下,沿着血流方向轻轻吹入1~3 µL含有PGCs的溶液,溶液中PGCs总量约为2000个。在开口周围涂上蛋清,用膜封好开口,待蛋清干了之后,放入孵化箱继续孵化。
移植注射3.5 d后取出活胚,在体视显微镜下用镊子分离鸡胚性腺,置于滴有80 μL PBS的载玻片上,盖上盖玻片,倒置荧光显微镜下观察并拍照。
1.8 数据处理
荧光显微镜下统计每孔绿色荧光PGCs数量,数据用JMP 8.0 (SAS Institute, Cary, NC)统计软件检验,进行差异显著性分析(<0.05为差异显著)。
2 结果与分析
2.1 PGCs分离培养
本研究共分离40只鸡胚,其中有10个雄性PGCs在第3周结束之前细胞数达到5.0×104,被认为已成功建立了品系。这10个PGCs品系均来自单个胚胎。这些细胞呈圆形、边缘光亮、体积较大、细胞核大等形态特征,通常能看到细胞两个连在一起或成串,符合PGCs的形态特征(图2A)。PGCs培养60 d后,qRT-PCR检测生殖细胞标记基因、、和,结果表明,它们在PGCs中表达量高,在CEF中表达量极低(图2B),表明本研究分离的PGCs具有多能性。同时,通过免疫荧光法检测到几乎所有PGCs均表达了生殖细胞表面标志蛋白SSEA-1和DAZL (图2:C~F)。
2.2 PGCs转染条件的优化
用3种不同转染试剂转染携带GFP蛋白的Bac转座子质粒。结果表明,Lipofectamine 3000转染试剂中B3阳性细胞数最多,高于所有组别;其次是Lipofectamine 3000转染试剂B2,第三是Lipofectamine LTX & Plus Reagent转染试剂C3 (表2)。实验过程中还观察到Lipofectamine 2000转染试剂组以及其他两种试剂的高浓度组B4和C4对PGCs伤害较大,48 h后观察到大量PGCs死亡。在B3转染条件基础上,提高每孔中PGCs细胞数量到0.5×104,并减少转染时间至5 h,同时加入含有血清培养基,48 h后,在荧光显微镜下计数,发现阳性细胞数更多,每孔阳性细胞数超过了1000个。初步判断此条件下PGCs转染效率更佳(命名为D1),即质粒3 μg、Lipofectamine 3000试剂4 μL和PGCs细胞数0.5×104的配比。
2.3 稳定表达GFP蛋白PGCs细胞株的获得
为了确定最佳转染条件,根据B3转染条件和D1转染条件分别转染PGCs细胞,72 h后,利用基因表达绿色荧光蛋白,用流式细胞仪进行阳性细胞分选。以未转染任何质粒的DF1细胞作为阴性对照、转染GFP蛋白质粒的DF1细胞作为阳性对照。图3可知,DF1阴性对照组中阳性细胞比例为0% (图3A),DF1阳性对照组中阳性细胞比例为46.2% (图3B),B3转染条件下阳性PGCs比例为12.7% (图3C),D1转染条件下阳性PGCs比例为23.4% (图3D)。
将流式细胞仪分选后的PGCs接种到24孔板继续培养,状态良好(图4)。继续培养72 h后进行传代。

图2 PGCs的分离培养
A:PGCs体外培养3周后的形态特征;B:qRT-PCR检测、、和基因在PGCs和CEF中表达情况;C:PGCs中生殖细胞表面标志蛋白SSEA-1(绿色荧光)、DAZL蛋白(红色荧光)的表达;D:PGCs核染色;E :PGCs中生殖细胞表面标志蛋白SSEA-1蛋白;F:PGCs中生殖细胞表面标志蛋白DAZL蛋白。
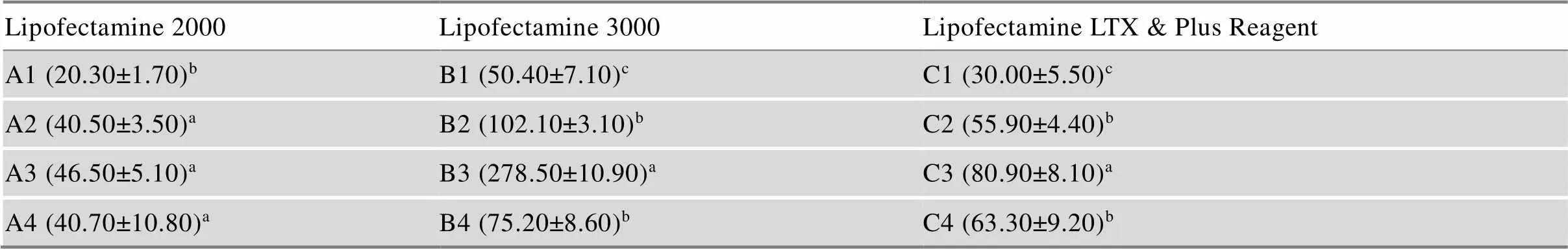
表2 不同转染试剂和不同剂量GFP质粒转染PGCs后48 h的阳性细胞数(个/孔)
同一列不同字母表示差异显著(<0.05)。
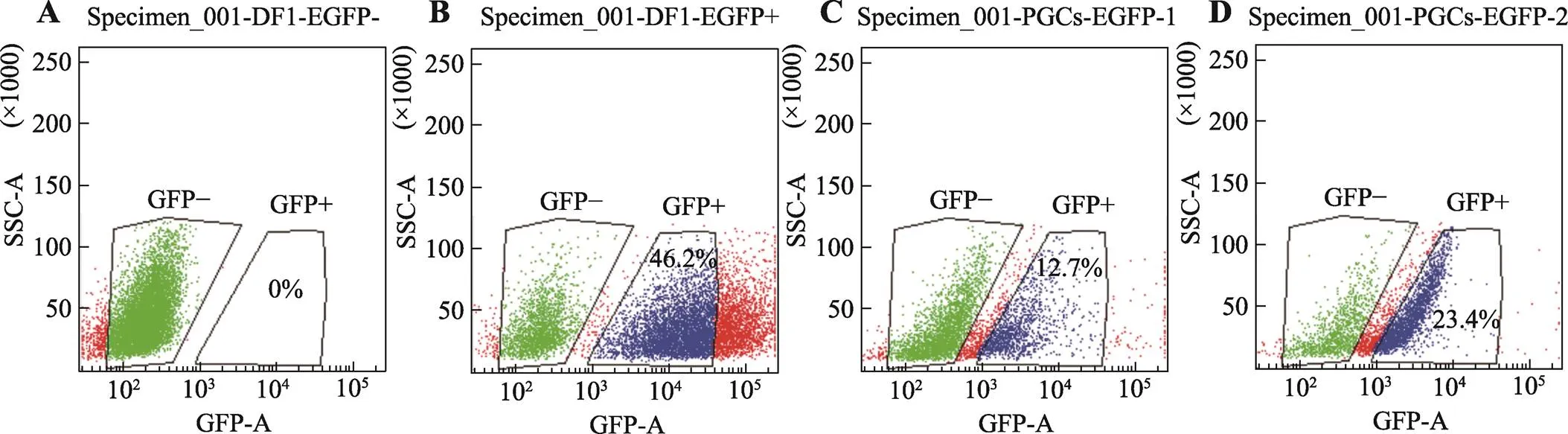
图3 流式细胞仪分选阳性PGCs
A:未转染任何质粒的阴性DF1细胞分选结果;B:转染了GFP蛋白质粒的DF1细胞分选结果;C:B3转染条件下阳性PGCs分选结果;D:D1转染条件下阳性PGCs分选结果。
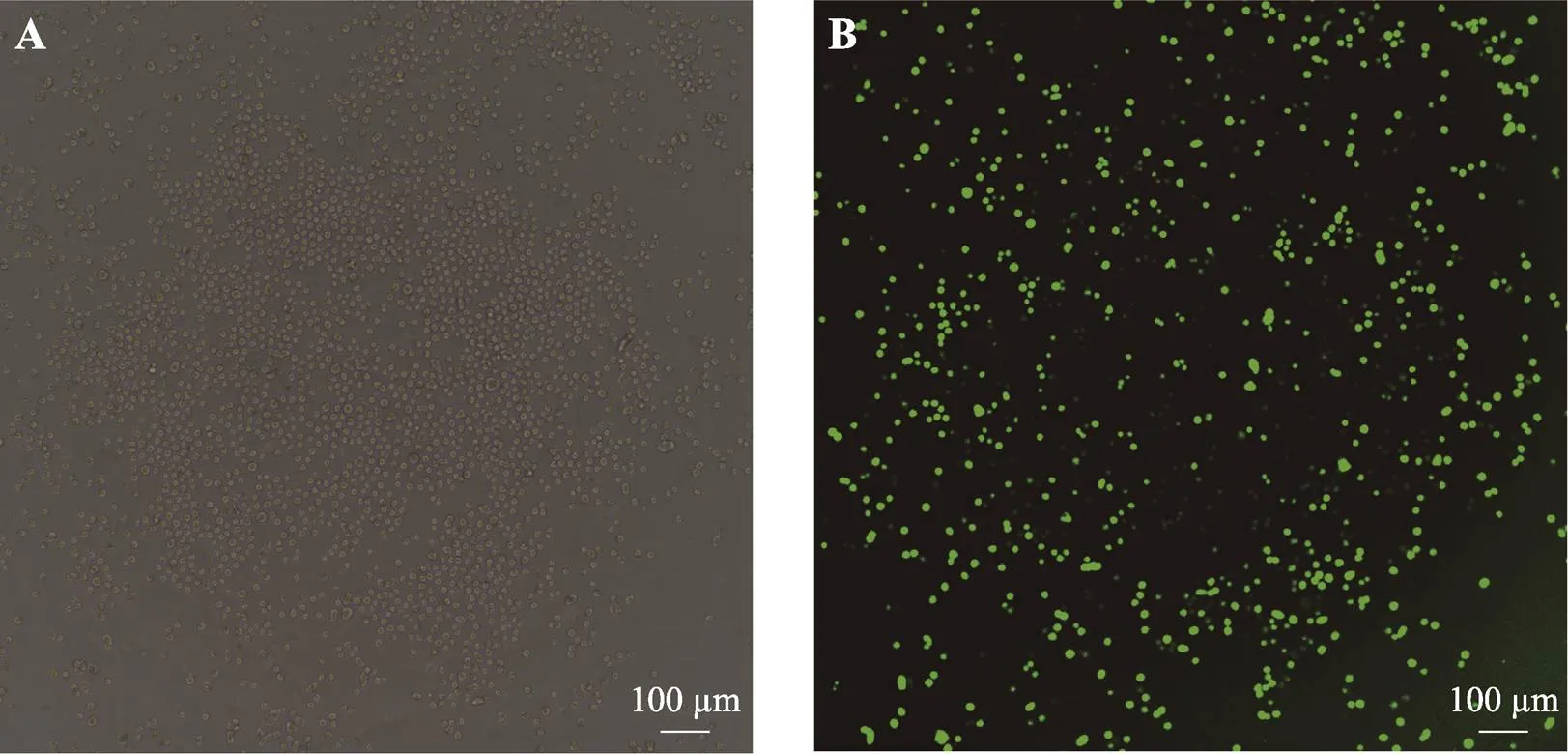
图4 稳定表达绿色荧光蛋白的PGCs
A:白光视野;B:绿色荧光视野。由于鸡PGCs是悬浮细胞,无法固定,会漂来漂去,导致PGCs并不总在同一平面或同一位置,因此绿色荧光视野下拍摄的PGCs荧光有强有弱,A和B图并不能完全匹配上。
2.4 鸡早期胚胎注射技术生产转基因鸡
阳性PGCs培养3周后,大量细胞继续表达GFP蛋白,表明基因已稳定整合到PGCs中。把它们注射到2~2.5胚龄的100只受体鸡胚中,继续孵化至5.5~6胚龄,分离性腺,在荧光显微镜下观察到有2只鸡胚性腺表达绿色荧光蛋白(图5),表明本研究分离、筛选的PGCs能够在受体鸡中继续发育。考虑到此次注射的PGCs在体外培养时间较长(约200 d),本文重新分离PGCs并转染pPB-GFP质粒,流式细胞术分选阳性PGCs,继续培养3周后注射到200只鸡胚中,随机取了15枚,荧光显微镜下观察到5枚鸡胚性腺表达绿色荧光蛋白。经PCR鉴定性腺中基因表达情况,结果表明阳性性腺中可以检测到基因的表达,而阴性性腺则无法检测到(图5E)。
3 讨论
鸡肉是人类最重要的食物来源之一,也是用于生产药用蛋白的生物反应器[9]。随着基因编辑技术的发展,鸡胚胎作为发育和细胞生物学的模型有了更多的机遇,但鸟类在基因组编辑技术方面一直落后于哺乳动物[1,10,11]。本研究旨在探究提高鸡PGCs转染效率的方法,为家禽基因组编辑技术的应用奠定基础。本研究利用Bac转座子,比较了3种不同转染试剂的转染效率,优化了转染条件,经流式细胞仪分析转染效率最高达到了23.4%,PGCs回注到鸡胚血液中,获得了表达GFP蛋白的鸡胚。Macdonald等[12]利用Bac及Tol2转座子有效转染PGCs后回注到鸡胚血脉系统,获得表达GFP蛋白的转基因鸡,Bac的转染效率为10.5%。陈美娟等[8]利用Bac转座子转染PGCs后回注到鸡胚血脉系统,获得表达GFP蛋白的鸡胚,转染效率最高为6.16%。由此可知,本研究中PGCs的转染效率高于上述研究结果,筛选出的阳性PGCs可以在受体鸡胚中继续发育,为后续开展基因编辑鸡的研究奠定了良好基础。
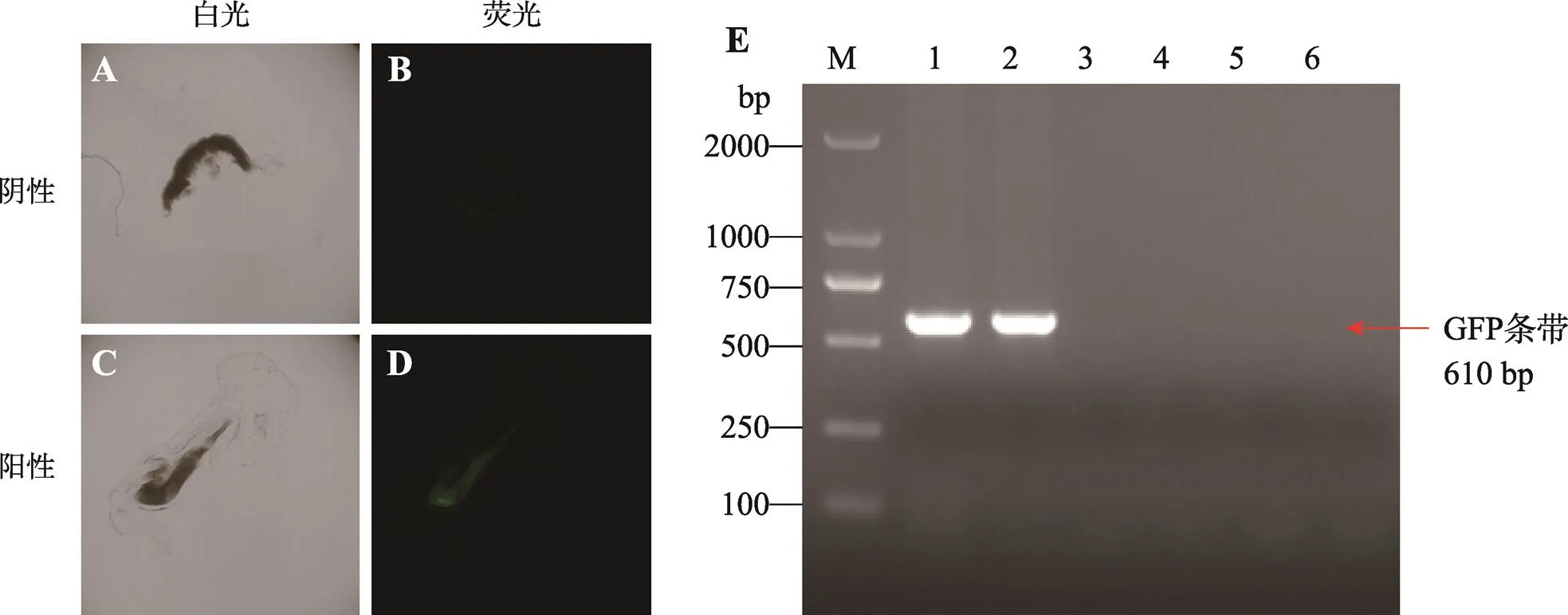
图5 含有表达绿色荧光蛋白PGCs的鸡胚性腺
A:阴性鸡胚性腺(白光视野);B:阴性鸡胚性腺(绿色荧光视野);C:阳性鸡胚性腺(白光视野);D:阳性鸡胚性腺(绿色荧光视野);E:PCR鉴定阳性性腺。泳道1和2为表达GFP蛋白的性腺,3和4为注射了阳性PGCs但不表达GFP蛋白的性腺,5和6为未注射阳性PGCs的性腺,M为DL2000 Marker。
本研究用脂质体转染方法转染PGCs,比较转染试剂的转染效率。结果发现,质粒3 μg、Lipofectamine 3000试剂4 μL和PGCs细胞数104的配比时转染效率最高。据报道,在一定范围内, 质粒用量和转染效率成正比,但当DNA加入过量时,转染效率反而下降,与本研究结果一致[13,14]。本研究还发现,质粒浓度和转染试剂剂量相同情况下,提高细胞密度,可以提高转染效率。这可能是由于细胞密度大,细胞间空隙较小,质粒DNA与细胞接触面多,进入细胞的阻力变小,从而提高转染水平。Lipofectamine 3000试剂在操作过程中不需要使用无血清、无双抗培养基,对PGCs后续生长影响较小。另外,在PGCs传代后第2 d、3 d、4 d时用最优转染条件进行转染,发现转染效率差异不显著(数据未呈现),表明PGCs传代后第2~4 d均可进行转染试验。
目前获得PGCs的方法主要有两种:一是从孵化2.5 d左右鸡胚循环血液中获得;二是从孵化5 d左右鸡胚性腺中获得。血液和性腺PGCs的细胞生长和特性基本没有差异,均表现出FGF依赖性的生长速率,且两种方法获得的PGCs均能在体外培养并进行基因修饰后产生转基因鸡[3,7,15~21]。本研究从孵化5.5 d鸡胚性腺中分离培养PGCs。与循环血液中PGCs相比,使用性腺PGCs的优点是可以从一个胚胎中获得更多的PGCs,且每个胚胎都更容易发育出许多PGCs,更有效地筛选出具有生殖细胞多能性的PGCs系,以产生胚系嵌合体和转基因鸡。
相比脂质体转染试剂Lipofectamine 2000和Lipofectamine LTX & Plus Reagent,Lipofectamine 3000转染试剂更适用于转染PGCs,最优转染条件为:质粒3 μg、Lipofectamine 3000试剂4 μL和PGCs细胞数0.5×104的配比,且可以用有血清有双抗的培养基。本研究综合考虑转染试剂、质粒用量和细胞数量的影响因素以优化PGCs的转染条件,为高效制备转基因鸡及基因编辑鸡的研究奠定基础。
[1] Chojnacka-Puchta L, Sawicka D. CRISPR/Cas9 gene editing in a chicken model: current approaches and applications., 2020, 61(2): 221–229.
[2] Zhang G, Li C, Li Q, Li B, Larkin DM, Lee C, Storz JF, Antunes A, Greenwold MJ, Meredith RW, Ödeen A, Cui J, Zhou Q, Xu L, Pan H, Wang Z, Jin L, Zhang P, Hu H, Yang W, Hu J, Xiao J, Yang Z, Liu Y, Xie Q, Yu H, Lian J, Wen P, Zhang F, Li H, Zeng Y, Xiong Z, Liu S, Zhou L, Huang Z, An N, Wang J, Zheng Q, Xiong Y, Wang G, Wang B, Wang J, Fan Y, Da FR, Alfaro-Núñez A, Schubert M, Orlando L, Mourier T, Howard JT, Ganapathy G, Pfenning A, Whitney O, Rivas MV, Hara E, Smith J, Farre M, Narayan J, Slavov G, Romanov MN, Borges R, Machado JP, Khan I, Springer MS, Gatesy J, Hoffmann FG, Opazo JC, Håstad O, Sawyer RH, Kim H, Kim KW, Kim HJ, Cho S, Li N, Huang Y, Bruford MW, Zhan X, Dixon A, Bertelsen MF, Derryberry E, Warren W, Wilson RK, Li S, Ray DA, Green RE, O'Brien SJ, Griffin D, Johnson WE, Haussler D, Ryder OA, Willerslev E, Graves GR, Alström P, Fjeldså J, Mindell DP, Edwards SV, Braun EL, Rahbek C, Burt DW, Houde P, Zhang Y, Yang H, Wang J, Consortium AG, Jarvis ED, Gilbert MT, Wang J. Comparative genomics reveals insights into avian genome evolution and adaptation., 2014, 346(6215): 1311–1320.
[3] van de Lavoir MC, Diamond JH, Leighton PA, Mather-Love C, Heyer BS, Bradshaw R, Kerchner A, Hooi LT, Gessaro TM, Swanberg SE, Delany ME, Etches RJ. Germline transmission of genetically modified primordial germ cells., 2006, 441(7094): 766–769.
[4] Koslová A, Trefil P, Mucksová J, Reinišová M, Plachý J, Kalina J, Kučerová D, Geryk J, Krchlíková V, Lejčková B, Hejnar J. Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J subgroup of avian leukosis virus., 2020, 117(4): 2108–2112.
[5] Lee HJ, Yoon JW, Jung KM, Kim YM, Park JS, Lee KY, Park KJ, Hwang YS, Park YH, Rengaraj D, Han JY. Targeted gene insertion into Z chromosome of chicken primordial germ cells for avian sexing model development., 2019, 33(7): 8519–8529.
[6] Dimitrov L, Pedersen D, Ching KH, Yi H, Collarini EJ, Izquierdo S, van de Lavoir MC, Leighton PA. Germline gene editing in chickens by efficient CRISPR-mediated homologous recombination in primordial germ cells., 2016, 11(4): e154303.
[7] Oishi I, Yoshii K, Miyahara D, Kagami H, Tagami T. Targeted mutagenesis in chicken using CRISPR/Cas9 system., 2016, 6: 23980.
[8] Chen MJ, Chen DY, Xie L, Lu ZP, Yang MM, Mo LF, LU KH, Lu YQ.Effect of recipient embryos age on homing of chicken primordial germ cell after transplantation., 2016, 47(06): 1014–1018.陈美娟,陈东阳,谢龙,陆振萍,杨蒙蒙,莫丽芬,卢克焕,陆阳清. 受体胚龄对鸡原始生殖细胞移植后归巢的影响. 南方农业学报, 2016, 47(06): 1014–1018.
[9] Lillico SG, McGrew MJ, Sherman A, Sang HM. Transgenic chickens as bioreactors for protein-based drugs., 2005, 10(3): 191–196.
[10] Intarapat S, Stern CD. Chick stem cells: Current progress and future prospects., 2013, 11(3): 1378– 1392.
[11] Lee HJ, Lee HC, Han JY. Germline modification and engineering in avian species., 2015, 38(9): 743–749.
[12] Macdonald J, Taylor L, Sherman A, Kawakami K, Takahashi Y, Sang HM, McGrew MJ. Efficient genetic modification and germ-line transmission of primordial germ cells using piggyBac and Tol2 transposons., 2012, 109(23): E1466–E1472.
[13] He CW, He YL, Wu YH, Shao FH. Effects of different transfection reagents on lentiviral packaging efficiency and the lentiviral infection efficiency of guinea-pig fibroblasts after packaging.2015, (10): 34–38.何承文,何玉龙,吴月红,邵风慧. 不同转染试剂对慢病毒包装及包装后病毒感染豚鼠成纤维细胞效率的影响. 黑龙江畜牧兽医,2015, (10): 34–38.
[14] Zhong CL, Li GL, Mo JX, Quan R, Wang HQ, Li ZC, Wu ZF, Zhang XW. Effects of parameters, plasmid dosages and topological structures on transfection efficiency of porcine fetal fibroblasts using different electroporators.2017, 39(10): 930–938.钟翠丽, 李国玲, 莫健新, 全绒, 王豪强, 李紫聪, 吴珍芳, 张献伟. 不同电转仪的电转参数、质粒用量和拓扑结构对猪胎儿成纤维细胞转染效率的影响. 遗传, 2017, 39(10): 930–938.
[15] Macdonald J, Glover JD, Taylor L, Sang HM, McGrew MJ. Characterisation and germline transmission of cultured avian primordial germ cells., 2010, 5(11): e15518.
[16] Choi JW, Kim S, Kim TM, Kim YM, Seo HW, Park TS, Jeong JW, Song G, Han JY. Basic fibroblast growth factor activates MEK/ERK cell signaling pathway and stimulates the proliferation of chicken primordial germ cells., 2010, 5(9): e12968.
[17] Park TS, Han JY. piggyBac transposition into primordial germ cells is an efficient tool for transgenesis in chickens., 2012, 109(24): 9337–9341.
[18] Yamamoto Y, Usui F, Nakamura Y, Ito Y, Tagami T, Nirasawa K, Matsubara Y, Ono T, Kagami H. A novel method to isolate primordial germ cells and its use for the generation of germline chimeras in chicken., 2007, 77(1): 115–119.
[19] Wang L, Chen MJ, Chen DY, Peng SF, Zhou XL, Liao YY, Yang XG, Xu HY, Lu SS, Zhang M, Lu KH, Lu YQ. Derivation and characterization of primordial germ cells from Guangxi yellow-feather chickens., 2017, 96(5): 1419–1425.
[20] Taylor L, Carlson DF, Nandi S, Sherman A, Fahrenkrug SC, McGrew MJ. Efficient TALEN-mediated gene targeting of chicken primordial germ cells., 2017, 144(5): 928–934.
[21] Naito M, Harumi T, Kuwana T. Long-term culture of chicken primordial germ cells isolated from embryonic blood and production of germline chimaeric chickens., 2015, 153: 50–61.
Optimization of transfection conditions of chicken primordial germ cells
Xian Zou, Yanhua He, Jingyi He, Yan Wang, Dingming Shu, Chenglong Luo
To improve the transfection efficiency of chicken primordial germ cells (PGCs), the present study evaluated the plasmid dosage and cell number on the efficiencies of three transfection reagents (Lipofectamine 2000, 3000 and LTX & Plus Reagent). PGCs was isolated from embryonic gonads of Huiyang bearded chicken. After 60 days of culture, the cells were transfected by using Lipofectamine transfection reagents withBac vectors coding for the green fluorescence protein (GFP). PGCs were passaged in culture and fluorescent cells were screened and selected by flow cytometry at three days after transfection. At three weeks post transfection, about 2000 cells were injected into the stage 16 Hamburger and Hamilton (HH) embryos and incubated until stage 30 HH. The results showed that Lipofectamine 3000 was the best for transfection of PGCs. The highest transfection efficiency of PGCs could be achieved with a combination of 3 μg plasmid, 4 μL Lipofectamine 3000 transfection reagent and 0.5×104PGCs cells. Flow cytometry analysis showed a 23.4% efficiency of stable transfection of PGCs using Lipofectamine 3000 withBac vector, which was improved 2 times or more over current commonly used methods. After reinjecting PGCs into recipient chicken embryos, GFP-positive cells were observed in the gonads of the recipient chicken embryo by fluorescence microscopy. The study comprehensively evaluated the factors of transfection reagents, plasmid dosage and cell number to optimize the transfection of PGCs, thereby providing a foundation for the efficient preparation of transgenic and gene-edited chickens.
chicken; primordial germ cells; stable transfection; Lipofectamine
2020-07-07;
2020-12-21
广东省自然科学基金项目(编号:2018B030311044),广东省科技计划项目(编号:2017B020232003,2019A050505007),2020年省级现代农业科技联盟建设共性关键技术创新团队项目(编号:2020KJ106),国家肉鸡产业技术体系岗位科学家项目(编号:CARS-41)和科技创新战略专项资金—高水平农科院建设项目(编号:R2017PY-QY007)资助[Supported by the National Natural Science Foundation of Guangdong Province (No. 2018B030311044), the Science and Technology Program of Guangdong Province (Nos. 2017B020232003, 2019A050505007), 2020 Provincial Modern Agricultural Science and Technology Alliance Construction of Common Key Technology Innovation Team Project (No. 2020KJ106), the Earmarked Fund for Modern Agro-Industry Technology Research System (No. CARS41), and Special Fund for Scientific Innovation Strategy-construction of High Level Academy of Agriculture Science (No. R2017PY-QY007)]
邹娴,博士,副研究员,研究方向:动物种质资源保护、育种与繁殖。E-mail: zouxian08@163.com
舒鼎铭,博士,研究员,研究方向:动物种质资源保护与创新利用。E-mail: shudingming@gdaas.cn罗成龙,博士,研究员,研究方向:家禽种质资源保护、遗传育种与健康生产。E-mail: chenglongluo1981@163.com
10.16288/j.yczz.20-212
2021/2/1 15:08:18
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20210201.1110.005.html
(责任编委: 姜雨)

