安罗替尼治疗难治性自然杀伤/T 细胞淋巴瘤的有效性与安全性的探索性研究
李高扬,姜霁峰,刘传绪,张文皓,朱 杨,马玉杰,陶 荣
上海交通大学医学院附属新华医院血液科,上海200092
自然杀伤/T 细胞淋巴瘤(natural killer/T-cell lymphoma,NKTCL) 是 一 种 与EB 病 毒(Epstein-Barr virus,EBV)感染密切相关,好发于东亚人群的高侵袭性非霍奇金淋巴瘤,发病率约占中国所有淋巴瘤的6%。过去10 年,随着门冬酰胺酶用于该病的一线治疗,患者的预后显著改善。初诊时按Ann Arbor 分期系统为ⅠE/ⅡE期的患者中位无进展生存期(progression-free survival,PFS)为20 个月,中位总生存期(overall survival,OS)为59个月[1]。但Ⅲ/Ⅳ期患者的预后仍较差,中位PFS仅为8个月,中位OS仅10个月[1];而NKTCL一旦复发,再次治疗的中位PFS仅4.1个月,中位OS为6.4个月[2]。因此,复发/难治性NKTCL患者的治疗难度较大。本课题组先前使用程序性死亡蛋白-1(programmed death-1,PD-1)单克隆抗体(单抗,mAb)治疗复发/难治性NKTCL取得了一定的成效,总体应答率高达67.9%,但是完全缓解率较低,仅7.1%[3];所以针对复发/难治性NKTCL仍需进一步探索新型的治疗靶点与策略。
血管生成在肿瘤的发展与转移过程中起到重要作用,抑制这一过程能显著减缓肿瘤的发展和扩散转移。迄今为止,许多具有促进血管生成的因子及相关受体已被确认,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板源性生长因子(platelet-derived growth factor, PDGF)、 血 管 生 成 素(angiopoietin,Ang)、肝细胞生长因子(hepatocyte growth factor,HGF)、表皮生长因子(epidermal growth factor,EGF)等。靶向血管生成的治疗策略在多种肿瘤治疗中获得了成功。例如靶向VEGF的贝伐单抗,能与该分子特异性结合,阻断其与内皮细胞表面的血管内皮生长因子受体1/2(vascular endothelial growth factor receptor 1/2,VEGFR 1/2)结合,从而抑制肿瘤血管生成。该药被美国食品药品监督管理局批准用于治疗转移性结直肠癌、非鳞状非小细胞肺癌、宫颈癌、卵巢癌、转移性乳腺癌和恶性胶质瘤。前期研究[4-6]发现NKTCL细胞株通过多种生长因子自分泌通路,如VEGF/VEGFR、PDGF/血小板源性生长因子受体(platelet-derived growth factor receptor,PDGFR)、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)/胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF-1R),促进肿瘤细胞的增殖与侵袭,因此如能阻断这些生长因子的自分泌通路,可能对NKTCL有治疗作用。
安罗替尼(anlotinib)是一种具有多种生长因子受体抑制作用的酪氨酸激酶抑制剂,体外研究发现其对VEGFR、PDGFR、成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)具有抑制作用。在一项针对三线化学治疗(化疗)失败的非小细胞肺癌患者的临床试验中,给予安罗替尼的患者的PFS 和OS 均较安慰剂组显著延长[7];2018 年该药在中国被批准上市用于治疗经二线以上化疗失败的非小细胞肺癌。基于以上研究基础,本研究将安罗替尼用于治疗门冬酰胺酶耐药的Ⅳ期结外NKTCL,观察其安全性及有效性。
1 对象与方法
1.1 研究对象
选取2018 年8 月—2019 年12 月在上海交通大学医学院附属新华医院血液科门诊就诊的NKTCL 患者。入选标准:①经上海交通大学医学院附属新华医院病理科复核符合2008 版WHO 造血和淋巴组织肿瘤分类标准诊断的NKTCL。②根据Lugano 2014 淋巴瘤分期系统[8],正电子发射计算机断层显像(positron emission tomography/computed tomography,PET/CT)分期为Ⅳ期,或者分期为Ⅰ/Ⅱ期但不适合放射治疗(放疗)者。③接受了门冬酰胺酶为基础的联合化疗未获得缓解或者出现疾病进展,或接受了PD-1 抗体治疗无应答且无快速进展者。④具有至少一个CT/MRI可测量病灶,或者PET/CT可评估病灶。⑤美国东部肿瘤协作小组(Eastern Cooperative Oncology Group,ECOG)的体能状态评分为0~3 分。⑥需要具有一定的器官功能储备,包括血红蛋白>80 g/L,血小板计数>50×109/L,总胆红素<3×正常值上限,血清肌酐<1.5×正常值上限。排除标准:①可能从放疗获益的患者。②合并有肝炎病毒或人类免疫缺陷病毒等感染。③具有严重合并症,如呼吸衰竭、美国纽约心脏协会(New York Heart Association,NYHA)分级≥2 级的慢性充血性心力衰竭、失代偿的肝脏或肾脏功能不全、虽经积极治疗仍无法控制的高血压和糖尿病、近6个月内有心脑血管血栓性或出血性事件。④有消化道溃疡病史。⑤妊娠期和哺乳期妇女。受试者满足所有入组标准且不具有任一排除标准可参加本试验研究。
1.2 研究方法
1.2.1 研究终点 主要研究终点为治疗3 个月时经Lugano 2014 标 准[8]评 估 的 客 观 缓 解 率(objective response rate,ORR),次要研究终点包括疾病PFS 和OS,以及根据美国国家癌症研究所(National Cancer Institute,NCI)常见不良反应事件评价标准(Common Terminology Criteria for Adverse Events,CTCAE)4.03版分级的血液学和非血液学毒性。本研究的PFS定义为从安罗替尼治疗开始到发现疾病进展或任何原因导致死亡的时间;OS 定义为从安罗替尼治疗开始到任何原因导致死亡的时间。
1.2.2 治疗方法 经入选/排除标准筛选后,受试者签署知情同意书,并接受安罗替尼口服治疗;推荐剂量为12 mg/d,早餐前一次性口服,连续服药2周停药1周,即每3周为一个疗程。根据不良反应的严重程度,研究者可以调整剂量。若患者发生3级以上不良反应且在计划用药前未恢复到2级,可以下调药物剂量。第一级下调剂量为10 mg/d,第二级下调剂量为8 mg/d。接受安罗替尼单药治疗患者起始剂量均为12 mg/d,联合PD-1单抗治疗的患者起始安罗替尼剂量均为10 mg/d。
患者可持续用药直至疾病进展或不能耐受药物不良反应。本研究中使用的安罗替尼由江苏正大天晴药业股份有限公司免费提供。
1.2.3 疗效监测 受试者每3 周进行一次完整的体格检查,包括血液常规与生化、尿常规、甲状腺功能、心电图检查。第一个疗程的第3 周进行首次疗效评估,首选PET/CT,其次为增强CT/增强MRI;此后每6周进行一次评估。若临床上考虑疾病进展可提前进行必要的影像学检查确认。末次随访截至2020 年5 月。参照Lugano 2014淋巴瘤疗效标准[8]客观疗效评估分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾 病 稳 定(stable disease,SD) 或 疾 病 进 展(progressive disease,PD)。客观应答(缓解)指获得CR或者PR,ORR指获得CR和PR的患者所占的比例。
1.2.4 中止标准 计划入组患者不超过20 例,入组达到10 例后进行一次中期分析。复发/难治性NKTCL 的末线治疗药物的ORR 为20%~30%,故中期分析时若少于2 例患者获得客观应答,则中止试验。复发/难治性NKTCL患者的中位OS为2.0~2.3个月,故中期分析时若患者的中位OS 短于2.3 个月,则中止试验。治疗中若发生治疗相关严重不良反应事件导致患者住院或者死亡,则中止试验。本研究获上海交通大学医学院附属新华医院伦理委员会的书面批准(审批号:XHEC-C-2018-023-2)。
1.3 统计学分析
应用STATA SE15.0 软件进行统计分析。定性资料采用频数和百分比表示。生存分析采用Kaplan-Meier 法和LogRank检验。检验水准α=0.05。
2 结果
2.1 患者临床特征
共有12 位受试者纳入本研究。受试者中位年龄为44岁(范围:22~80岁),男性9例,女性3例。患者先前接受的中位化疗线数是二线(范围:二线至四线)。所有患者接受安罗替尼时疾病状态均为耐药状态,其中6例为原发耐药(其中3例患者在接受化疗和放疗过程中出现疾病进展,即同时对门冬酰胺酶和放疗耐药);所有患者均接受过含门冬酰胺酶的化疗,6 例患者接受过放疗,1 例患者接受过自体造血干细胞移植治疗,门冬酰胺酶耐药且PD-1单抗(信迪利单抗)治疗无应答患者6例(4例PD-1单抗单药治疗后表现为PD,2 例PD-1 单抗治疗多个周期后表现为SD)。入组时12例患者的Lugano 2014疾病分期为Ⅱ期3 例、Ⅳ期9 例,有B 组症状9 例,ECOG 评分中位数2 分(范围:1~3 分),乳酸脱氢酶升高10 例,骨髓累及4 例,伴有淋巴结累及3 例,所有患者血浆EBVDNA 阳性。安罗替尼单药(12 mg/d)治疗6 例,安罗替尼联合PD-1单抗治疗6例。
2.2 药物不良反应
12 例患者均接受了至少1 个周期的安罗替尼治疗,治疗周期中位数为3 个(范围:1~8 个)。所有患者均出现了不良反应,其中3 级不良反应有高血压(2/12)、低钠血症(1/12),均为12 mg/d安罗替尼单药治疗患者。出现3 级高血压的2 例患者接受联合降压药物治疗后血压控制良好,故未进行剂量调整。发生3 级低钠血症患者1例,首次疾病评估为PD,故停药退出试验。6例患者曾接受PD-1单抗治疗无应答,在继续使用PD-1单抗基础上接受安罗替尼试验治疗;该6例患者的初始安罗替尼剂量均为10 mg/d,未出现3级不良反应。1级/2级不良反应发生2 例及以上的包括乏力(7/12)、高血压(6/12)、声音嘶哑(4/12)、食欲下降(4/12)、低钠血症(3/12)、咽痛(3/12)、手足皮肤反应(3/12)、甲状腺功能减退(3/12)、淋巴细胞计数下降(3/12)、白蛋白降低(2/12)、血糖升高(2/12)。本研究中未观察到非预期的不良反应。
2.3 患者的治疗应答
纳入研究的12 名患者均接受了至少1 次疗效评估。6 例接受安罗替尼单药治疗的患者中,2 例为PR(图1A),2例为SD,2例为PD。6例安罗替尼联合PD-1单抗治疗的患者中,2例为CR,2例为PR,2例为PD,其中2例为CR 的患者均经PET/CT 评估确认为完全代谢学缓解(图1B)。12 例患者总ORR 为50.0%,其中CR 率为16.7%,PR 率为33.3%;安罗替尼单药治疗的ORR 为33.3%,安罗替尼联合PD-1单抗治疗的ORR为66.7%。
2.4 患者的生存时间分析
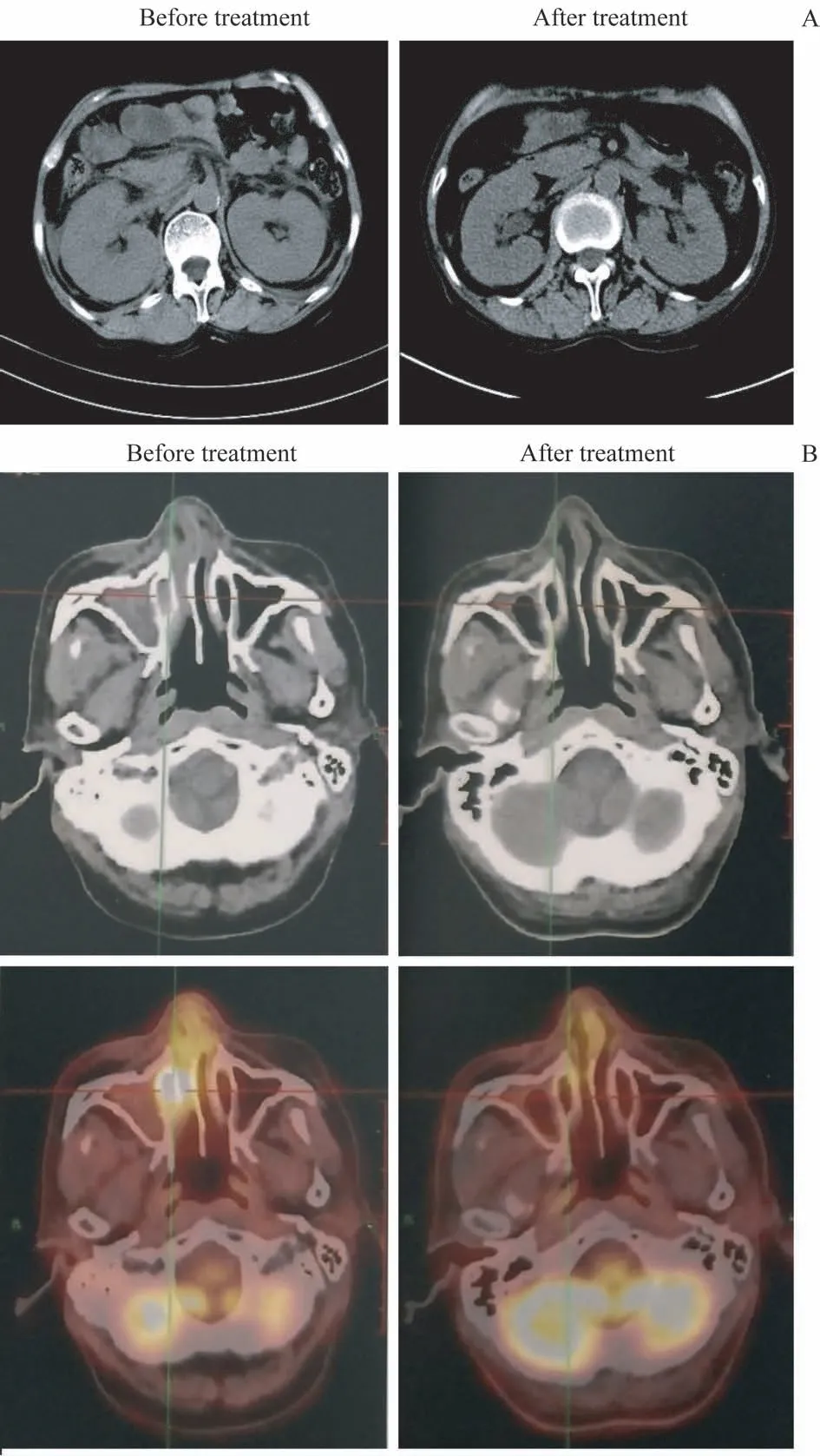
图1 安罗替尼治疗前后NKTCL患者病灶的影像学变化Fig 1 Imaging changes of lesions before and after treatment with anlotinib in NKTCL patients
12 例患者截至末次随访时有9 例死亡,均死于疾病进展。3 例存活患者中2 例仍处于CR,1 例疾病进展后接受其他治疗。12 例患者的中位PFS 为3.0 个月,中位OS为3.0 个月(图2)。6 例接受安罗替尼单药治疗的患者的中位PFS 为1.8 个月,中位OS 为2.8 个月;6 例PD-1 单抗联合安罗替尼治疗的患者中位PFS 为6.2 个月,中位OS为8.0 个月(图3)。安罗替尼治疗无应答患者的中位PFS为1.0 个月,中位OS 为2.8 个月;应答患者的中位PFS 为6.2 个月,中位OS 为8.0 个月(图4)。安罗替尼应答患者的PFS 和OS 相比于无应答患者的风险比(hazard ratio,HR) 分 别 为0.065 (95%CI 0.007~0.571,P=0.002) 和0.063(95%CI 0.007~0.552,P=0.002)。
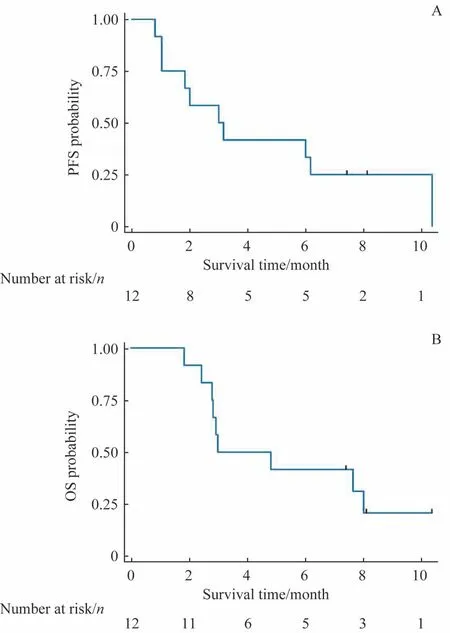
图2 安罗替尼治疗NKTCL患者的整体PFS曲线和OS曲线Fig 2 Overall PFS curve and OS curve of the patients with NKTCL treated with anlotinib
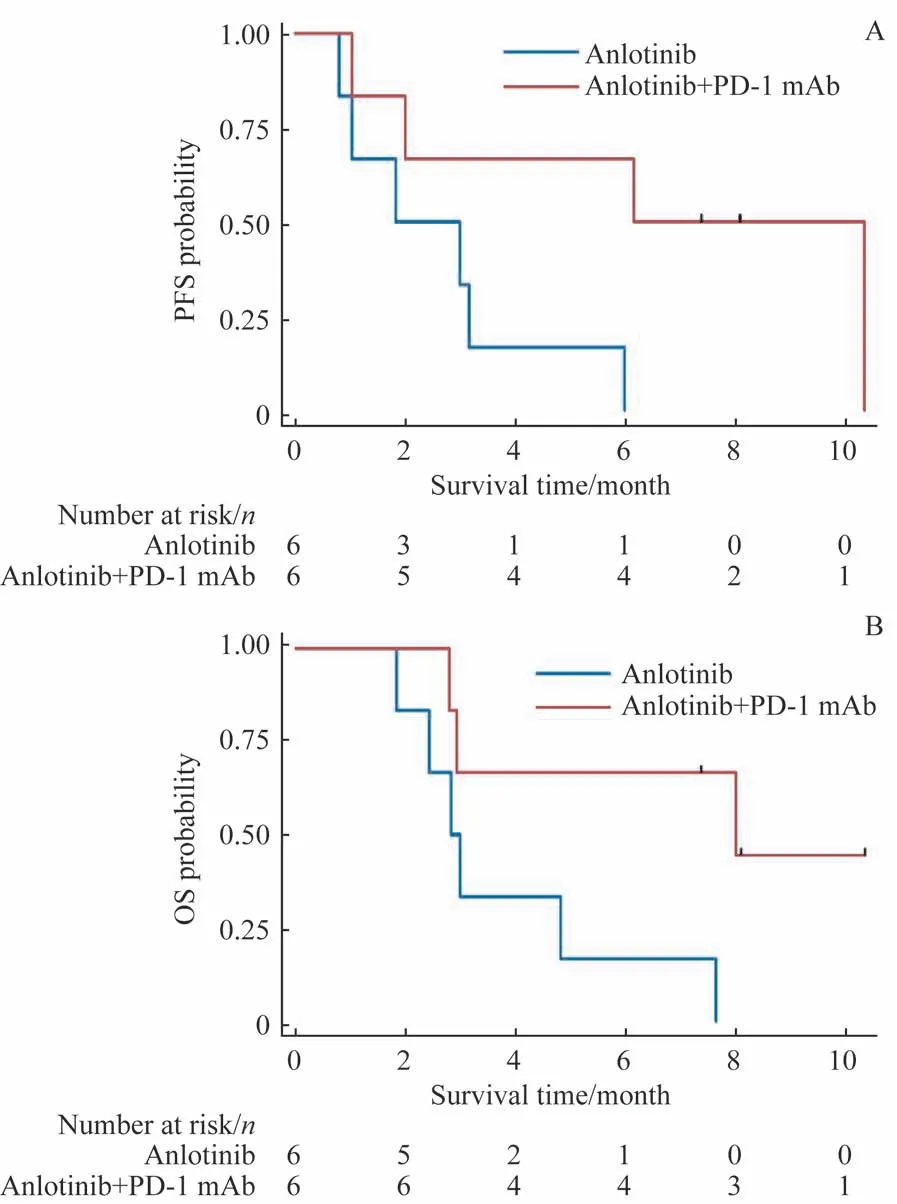
图3 接受安罗替尼单药治疗和安罗替尼联合PD-1 单抗治疗患者的PFS 曲线和OS曲线Fig 3 PFS curves and OS curves of the patients receiving anlotinib monotherapy and anlotinib combined with PD-1 mAb
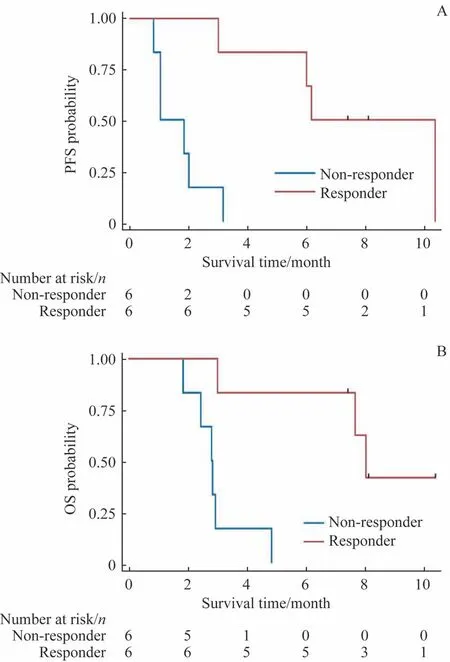
图4 接受安罗替尼治疗的应答患者和无应答患者的PFS曲线和OS曲线Fig 4 PFS curves and OS curves of the responders and non-responders to anlotinib
3 讨论
安罗替尼是我国自主研发的一种新型的多靶点酪氨酸激酶抑制剂,主要抑制VEGFR2/3、FGFR1~4、PDGFRα/β、c-Kit (stem cell factor receptor or CD117) 和 Ret(rearranged during transfection)。早期临床研究发现安罗替尼对多种复发/难治性实体瘤如结肠腺癌、非小细胞肺癌、肾透明细胞癌、甲状腺髓样癌和软组织肉瘤等具有抑制作用,但目前为止尚无关于安罗替尼治疗NKTCL 的基础或临床的研究报道。本研究将安罗替尼用于难治性NKTCL 的治疗,初步观察到了单药的有效性与安全性,以及与PD-1单抗联合用药在PD-1无应答患者中的有效性和安全性。
安全性方面,本研究观察到安罗替尼治疗期间出现的常见不良反应,主要有高血压、低钠血症、乏力、声音嘶哑、咽痛、手足皮肤反应、甲状腺功能减退等。从不良反应的类型上看,与之前的酪氨酸激酶抑制剂不良反应基本一致;这些不良反应多数在用药间歇期自发缓解,高血压和低钠血症等不良反应经对症处理后均好转。甲状腺功能减退的发生可能与患者同时联合使用PD-1 单抗有关。血糖升高考虑为PD-1 单抗相关不良反应[9]。联合用药中使用的安罗替尼剂量为10 mg/d,患者的乏力、低钠血症等表现较少。整个研究过程中无患者因药物不良反应而推迟治疗或者剂量下调,患者普遍耐受。
本研究入选受试者均为对现有经典治疗方案耐药的患者(门冬酰胺酶联合化疗、放疗),也纳入了对新药PD-1 单抗耐药的患者。在安罗替尼单药治疗的6 例受试者中出现了2 例客观应答,其中1 例受试者的PFS 长达24周,显示安罗替尼单药具有抗NKTCL的活性。由于入选患者的肿瘤负荷高,已处于疾病晚期,疾病进展较快,容易并发噬血细胞综合征而迅速危及生命,未应答患者的生存获益不明显;因此该6例受试者的中位PFS和中位OS仍较短,未显示出显著延长。
值得关注的是另6 例与PD-1 单抗联合治疗的受试者中,66.7%的患者出现了应答,而且出现了2 例CR,患者的中位PFS 和OS 与安罗替尼单药相比均延长了1 倍以上;即使这6 例患者原先对PD-1 单抗单药治疗表现出无应答,加用安罗替尼后中位OS 达到8.0 个月,超出了现有挽救治疗手段可能获得的中位OS,且已经接近于初发Ⅳ期患者的中位OS(10 个月)[1],显示PD-1 单抗与安罗替尼联合用药方案具有潜在的重要临床价值。PD-1 单抗与抗血管生成药物联合的协同增效作用在多种实体肿瘤中已有报道[10],本研究结果提示该机制可能在NKTCL亦同样存在。抗血管生成药物与免疫检查点抑制剂[PD-1/程序性死亡蛋白配体-1(PD-L1)抗体]的协同抗肿瘤效应是当前肿瘤免疫治疗中的研究热点。体外研究[10-11]发现,低剂量的VEGFR2 选择性抑制剂阿帕替尼可以改善肿瘤免疫抑制的微环境,如减少转化生长因子-β(transforming growth factor-β,TGF-β)的表达,降低肿瘤细胞PD-L1 的表达,阻碍免疫抑制性髓细胞在肿瘤组织的募集,同时可以增加CD8+T细胞在肿瘤组织的浸润,从而与PD-1 抗体发挥协同抗肿瘤效应。在早期探索性临床试验[12]中,VEGFR1~3 抑制剂仑伐替尼与PD-1 抗体联合用药也表现出了协同增效的作用,在肾癌、子宫内膜癌、黑色素瘤等多个瘤种的应答率明显高于PD-1 抗体单药。以上研究结果提示抗血管生成药物与PD-1 抑制剂可能存在广泛的协同机制。安罗替尼作为一个新型的多靶点酪氨酸激酶抑制剂,与PD-1 抑制剂的联合使用在治疗NKTCL 的初始研究中显示出可能的协同效应,其作用机制与临床效用值得进一步研究和验证。
综上,本研究观察到了安罗替尼在治疗难治性NKTCL 的单药活性和联合PD-1 抗体的潜在协同增效作用,提示安罗替尼可能是一个潜在的治疗NKTCL 的药物。无论单药或与PD-1 抗体联合使用,总体安全性良好,患者普遍耐受。考虑到复发/难治性NKTCL 的临床特征,安罗替尼单药可能不能充分控制肿瘤进展,在已经观察到该药单药活性基础上,后期临床研究应重点探索联合策略,尤其是构建包含有PD-1 单抗的联合治疗方案。本课题组已经制定出安罗替尼联合PD-1 单抗和培门冬酶治疗NKTCL 的方案,并开展了临床试验(临床试验注册号:NCT04004572)。

