小鼠持续葡萄糖监测技术的建立及其血糖时间序列的多尺度熵分析
李 成,张明亮,应令雯,苏娇溶,陶 睿,于 霞,包玉倩,周 健
1.上海交通大学附属第六人民医院内分泌代谢科,上海市糖尿病研究所,上海市糖尿病重点实验室,上海市糖尿病临床医学中心,上海200233;2.东北大学信息科学与工程学院,沈阳110819
目前, 持续葡萄糖监测(continuous glucose monitoring,CGM)已广泛应用于临床,为糖尿病及其并发症等相关研究提供了海量的葡萄糖数据[1]。基础研究中,常使用血糖仪检测等方法获取糖尿病、肥胖等代谢性疾病动物模型的血糖水平,但该方法会受到许多因素的影响,如应激反应(小鼠模型)、采血频率不一致等,难以全面反映疾病进展中血糖水平的连续变化。新近研发的以全植入式血糖遥测系统为基础的小鼠CGM 技术,可实现在小鼠自由活动的状态下,每10 s 或60 s获得1 个血糖数据并连续收集4周以上[2]。因此,该系统的应用可减少甚至解决传统采血方式存在的诸多问题。同时,该系统还可记录小鼠的体温及活动情况,被认为是代谢性疾病药理学及生理学研究的一种新方法[3]。
近年来,时间序列分析越来越广泛地被应用于生理信号分析领域。其中,多尺度熵(multiscale entropy,MSE)分析是一种分析长时间序列复杂度的方法,能够在不同时间尺度上量化时间序列的复杂性[4]。目前,该方法已应用于2 型糖尿病血糖时间序列复杂度的分析[5-6]。研究[7]显示肥胖人群是糖尿病高危人群之一,因此明确肥胖人群的糖代谢变化特征是探究肥胖和糖尿病相关机制的重要环节。采用传统的时点血糖测定或口服葡萄糖耐量试验检测发现,部分肥胖人群的血糖水平处于正常范围[8]。2014年Salkind等[8]针对血糖水平正常的肥胖人群进行研究发现,该类人群的血糖波动幅度已有明显上升,其颈动脉内膜中层厚度较非肥胖对照人群增大,提示该增厚可能与血糖波动相关。因此,应用新的监测技术及统计分析方法探究肥胖人群血糖及其波动特征,或将为糖尿病的早期防治及其与肥胖相关的作用机制研究提供新思路。
研究[9]显示,C57BL/6J 小鼠和饮食诱导肥胖(dietinduced obesity,DIO)型小鼠是研究肥胖等代谢性疾病病理生理机制的常用动物模型。而针对DIO 小鼠模型,尚未获得较为全面的血糖数据及血糖时间序列复杂度的相关信息。基于此,本研究建立以全植入式血糖遥测系统为基础的小鼠CGM技术,结合MSE分析方法,对小鼠的血糖时间序列复杂度进行分析,以期为糖尿病、肥胖等代谢性疾病的动物模型提供更为详细且准确的血糖信息,同时为糖代谢早期异常相关研究提供新思路。
1 材料与方法
1.1 研究对象及材料
1.1.1 实验动物 20 周龄SPF 级雄性C57BL/6J 小鼠3 只(对照组),体质量30~35 g;20 周龄SPF 级雄性DIO 型C57BL/6J 小鼠3 只(DIO 组),体质量45~50 g。上述2 种小鼠均购于江苏集萃药康生物科技股份有限公司,实验动物生产许可证:SCXK(苏)2018-0008。实验小鼠饲养于上海顿慧医疗科技发展有限公司动物实验中心的标准饲养笼中,动物使用许可证:SYXK(沪)2016-0015。对照组小鼠饲以普通饲料,DIO 组小鼠饲以高脂饲料(含60%脂肪)。饲养条件:温度21~24 ℃、湿度40%~70%、光照12/12 h,自由进食、饮水。本研究根据上海交通大学附属第六人民医院动物伦理委员会指导,按照《实验动物管理条例》对动物进行操作。
1.1.2 主要试剂和仪器 葡萄糖[生工生物工程(上海)股份有限公司],戊巴比妥钠(Bioszune Life Sciences DEP,美国)。血糖仪及血糖试纸(Roche,德国),小动物手术显微镜、小动物体温维持仪(上海玉研科学仪器有限公司)。医用5-0带线缝合针、医用5-0缝合线(上海浦东金环医疗用品股份有限公司)。全植入式血糖遥测系统(包括电脑终端及数据软件、Matrix 2.0数模转换装置、塑料笼接收器及HD-XG 血糖遥测植入子)(Date Sciences International,美国)。
1.2 研究方法
1.2.1 小鼠HD-XG 血糖遥测植入子植入手术 分别称量2组小鼠的体质量,并按100 mg/kg计算1%戊巴比妥钠用量,对其进行麻醉。取小鼠仰卧位,固定后对颈部手术区域进行备皮。手术区域经消毒铺巾后,于正中左侧处取约1 cm 颈动脉切口,于显微镜下钝性分离左侧颈动脉周围的脂肪及结缔组织,应避免伤及迷走神经。在左侧颈总动脉分叉处使用医用5-0缝合线结扎,并在结扎的尾端放置一根约4 cm 的手术线以备后期固定HD-XG血糖遥测植入子(图1A)。用针尖在左侧颈总动脉形成一小切口,将HD-XG 血糖遥测植入子的传感器探头部分沿着切口插入动脉,植入子前端感受器至主动脉弓2 mm(图1B),具体长度可参照植入子前端长度标记。结扎提前放置的手术线,以将传感器探头固定在动脉内。HD-XG 血糖遥测植入子信号发射器部分置于小鼠腹部右侧皮下(图1C)。缝合颈部切口,并行碘伏消毒。
1.2.2 术后护理 术后,将2 组小鼠分别置于体温维持仪(37 ℃)中保温,苏醒后行单笼饲养。DIO 组小鼠仍以高脂饲料喂养,对照组小鼠以普通饲料喂养。术后第2日,用碘伏对小鼠缝合处进行消毒,并将饲养笼置于与全植入式血糖遥测系统连接好的接收器上方。
1.2.3 全植入式血糖遥测系统的使用及校准 用磁铁靠近小鼠植入子腹侧,以启动植入子。按照Ponemah v6.41 系统操作搜寻并匹配每只小鼠对应的植入子,输入植入子对应参数,设置血糖、体温2个通道,待校准后系统将自动记录相关数据。为排除手术对血糖及体温可能造成的影响,取2组小鼠术后第10~14日的血糖和体温数据进行分析。
配置20%葡萄糖溶液,按照剂量1 g/kg 向小鼠行腹腔注射。注射前,取小鼠尾静脉血检测血糖水平,记录为参考值1;注射后15 min,再次取尾静脉血进行检测,记录为参考值2。当|参考值1-参考值2|>3 mmol/L,则校准成功。系统每7~14 d需校准1次。
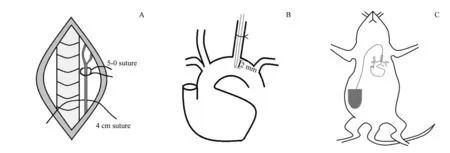
图1 HD-XG血糖遥测植入子植入小鼠的手术模式图Fig 1 Operation pattern of HD-XG glucose telemetry implant in mice
1.2.4 血糖时间序列复杂度分析 采用MSE 分析小鼠血糖时间序列的复杂度。MSE 的基本原理是对时间序列进行粗粒化,在越来越粗略的时间分辨率下分析时间序列[4]。熵值大小与时间序列的规律性相关,熵值越大则血糖时间序列的重复模式越少,表明该血糖时间序列具有较高的复杂度。利用MATLAB R2019b软件对获得的血糖时间序列进行分析,选取小鼠术后第11~17日的血糖数据,对其血糖时间序列复杂度进行MSE 分析,将2 组中的每只小鼠的血糖时间序列分解到1~10 的尺度上(对应序列的时间长度为1~10 min),计算每个尺度上对应的熵值,并进行组间比较。
1.3 统计学方法
采用SPSS 24.0 软件进行统计学分析。定量资料以x±s 表示,采用t 检验进行数据分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 全植入式血糖遥测系统监测2 组小鼠的记录时间及血糖数据
本研究中,6只小鼠均成功完成了植入手术,并顺利收集了相关数据,提示以全植入式血糖遥测系统为基础的小鼠CGM技术建立完成。经植入后,全植入式血糖遥测系统每1 min记录1次血糖数据,6只小鼠共计收集了232 887个血糖数据。6只小鼠的平均记录时间为(27.3±9.3)d,每只小鼠的系统记录时间及血糖值数量(包括有效值及无效值)如表1所示。
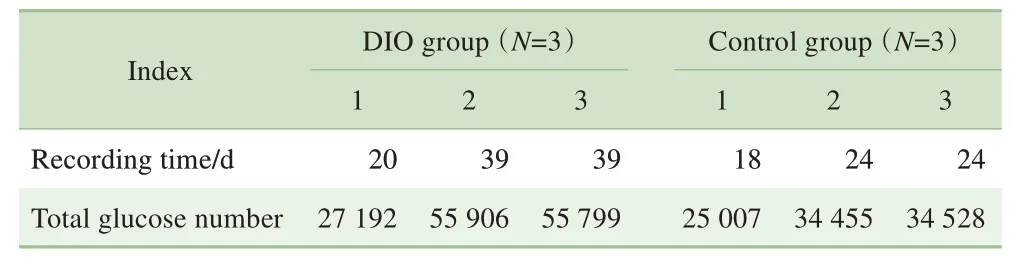
表1 全植入式血糖遥测系统监测2组小鼠的记录时间及血糖值数量Tab 1 Recording time and the number of glucose values of the two groups monitored by implantable glucose telemetry system
2.2 2组小鼠体质量、血糖及体温数据比较
DIO 组小鼠的体质量高于对照组[(45.6±1.3)g vs(31.7±2.1)g,P=0.001]。通过对2 组小鼠术后第10~14日的血糖和体温数据分析,结果显示:DIO 组小鼠5 d 的平均血糖为(7.04±0.71)mmol/L,对照组小鼠为(6.92±0.48)mmol/L,组间差异无统计学意义;DIO 组小鼠5 d的平均体温为(33.34±0.18)℃,对照组小鼠为(33.79±0.68)℃,组间差异亦无统计学意义。其中,经全植入式血糖遥测系统监测的2 组中每只小鼠第10~14 日的平均血糖和体温水平见表2,该连续5 d 2 组小鼠的血糖及体温水平图谱见图2、3。
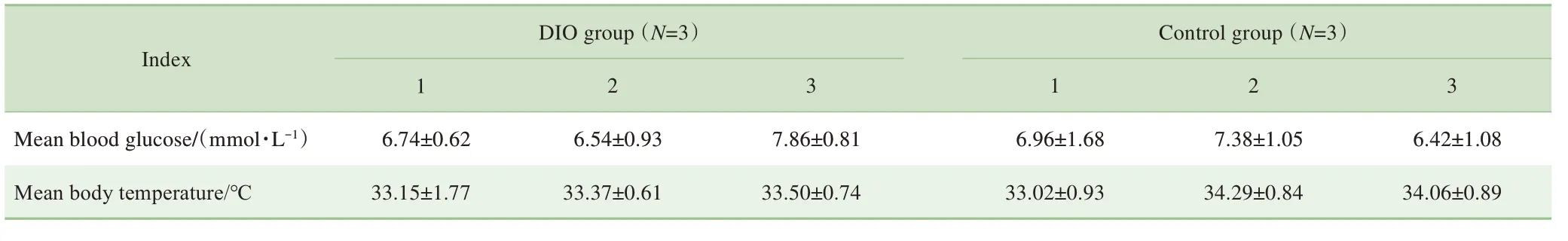
表2 2组中每只小鼠第10~14日的平均血糖和体温Tab 2 Mean blood glucose and body temperature of each mouse in the two groups from Day 10 to Day 14
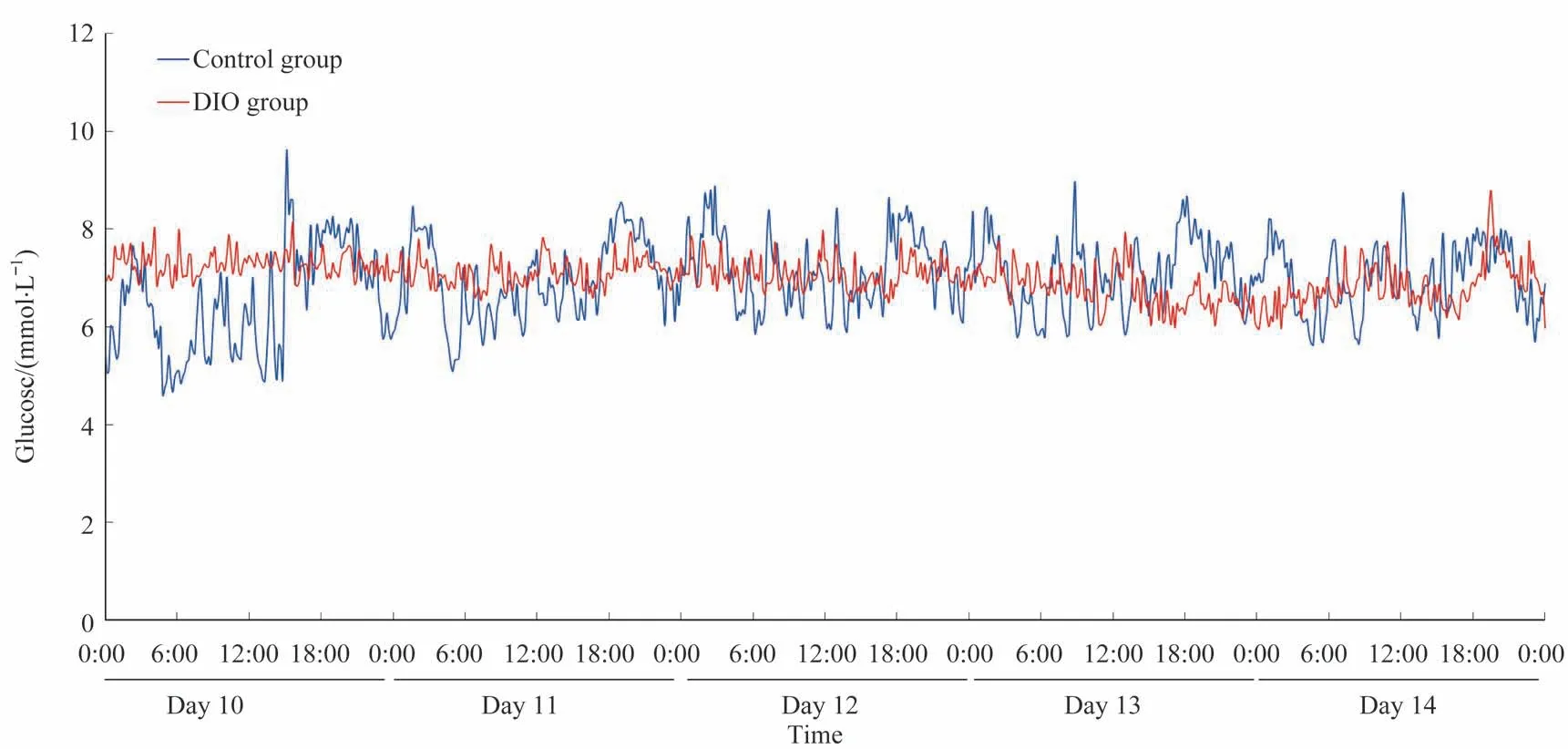
图2 2组小鼠第10~14日的血糖图谱Fig 2 Glucose profiles of mice in the two groups from Day 10 to Day 14
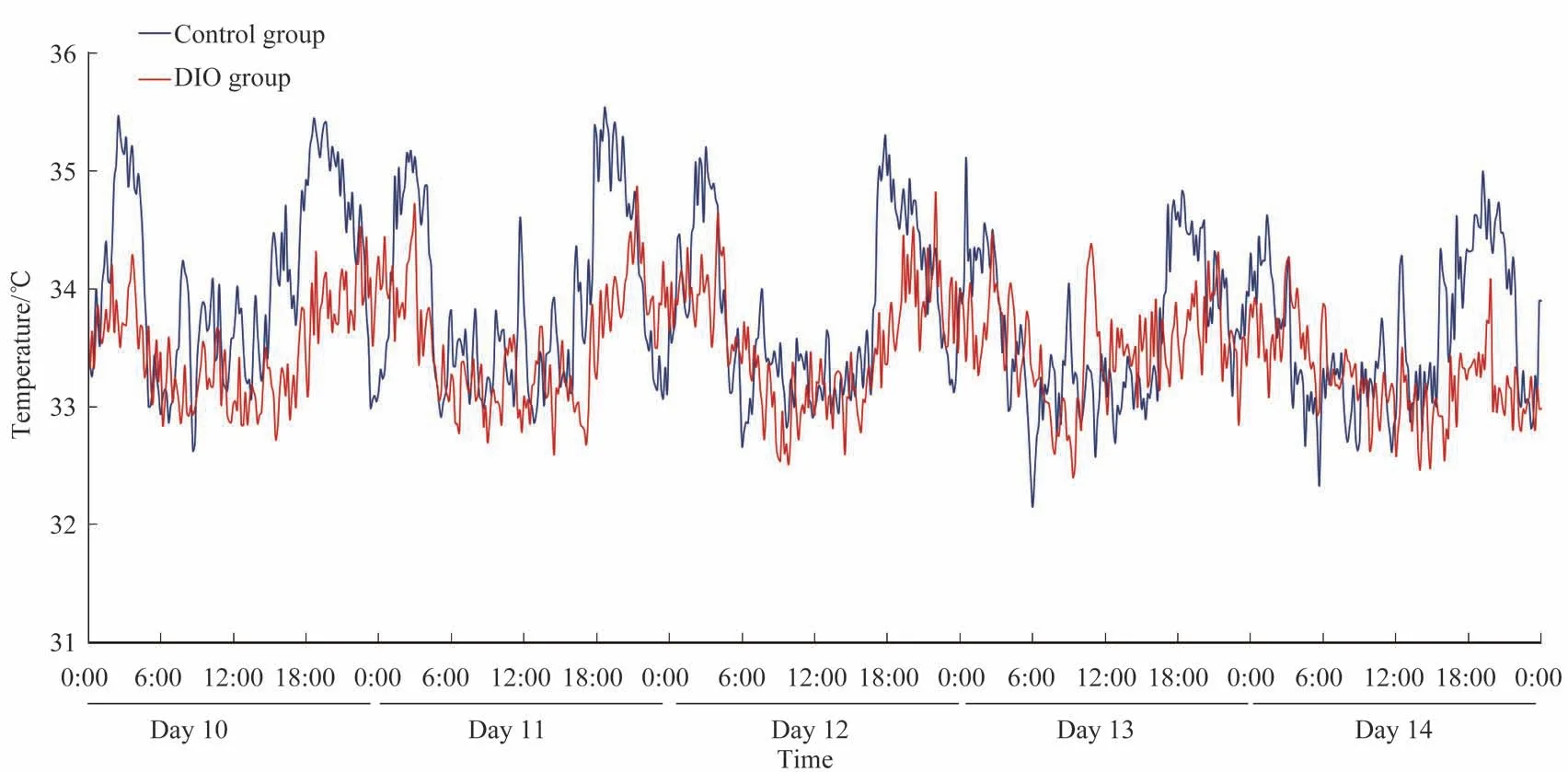
图3 2组小鼠第10~14日的体温水平图谱Fig 3 Body temperature profiles of mice in the two groups from Day 10 to Day 14
2.3 2组小鼠血糖时间序列复杂度的MSE分析
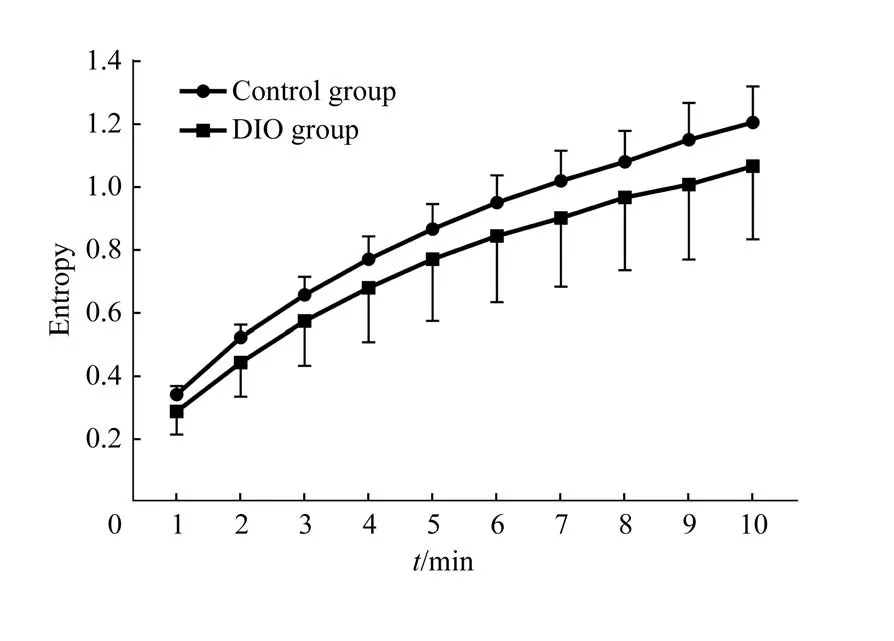
图4 2组小鼠不同时间尺度下血糖时间序列的熵值Fig 4 Entropy of glucose time series on different scales in the two groups
小鼠血糖时间序列复杂度的MSE 分析结果(图4)显示:在1~10 的时间尺度下,2 组小鼠熵值逐渐增加,即血糖时间序列复杂度增加;而在每一个时间尺度上,DIO 组小鼠的血糖时间序列复杂度均低于对照组,但差异无统计学意义。
3 讨论
目前,CGM 作为葡萄糖监测的有效工具之一,可提供连续、全面、可靠的葡萄糖谱,已逐渐在临床治疗及研究中广泛应用,但在动物模型的研究中该技术仍处于发展阶段。本研究以全植入式血糖遥测系统为基础,建立了小鼠CGM 技术,该技术不仅具有较长的使用寿命、较高的准确性,还可使动物在监测期间的活动不受限制[10]。研究[11-14]显示,该系统主要应用于大鼠、猴等模型。如在大鼠的减重手术模型中,Lu 等[13]成功应用了该技术并获得了代谢手术前后大鼠血糖的变化情况。由于在大鼠模型中葡萄糖传感器探头植入手术难度相对较低,即植入腹主动脉,而在小鼠模型中植入颈动脉,其血管相对较细,手术难度较高,需要更细致的手术操作。因此,小鼠CGM技术的建立仍待进一步优化。
实验动物模型CGM 技术的建立,使得对血糖特征的研究从“点”(各时点血糖)到“线”(持续血糖监测)成为可能。全植入式血糖遥测系统可获得大量的血糖数据(如每60 s 获得1 个血糖值,则每日可获得1 440 个),而使用常规的均值计算方法(如平均值、标准差等)对血糖波动特征进行分析则会使数据利用率较低,造成一定程度的资源浪费,且难以进一步分析血糖的波动规律。近年来,时间序列分析在代谢性疾病研究的应用逐渐增加,不仅为分析与代谢相关的生理信号提供新的方向和思路,同时也为发现如肥胖、糖尿病等临床前期的病理生理改变提供更多的可能[15-16]。
本研究结合MSE 分析方法,对小鼠血糖时间序列的复杂度进行分析。MSE 这一概念由Costa 等[17]提出,已应用于生理数据如姿势、血糖[6,18]等方面。MSE 应用于血糖时间序列分析时,不仅能够体现血糖序列在时间尺度上的规律性,提取更全面的血糖数据有效信息,还可以从不同角度分析代谢性疾病实验动物模型的血糖波动规律。Raubertas 等[19]在恒河猴糖尿病模型的研究中发现,与正常恒河猴相比,其血糖时间序列复杂度较低。一项采用全植入式血糖遥测系统并结合MSE 分析方法的研究[20]发现,在自发型肥胖型糖尿病(Zucker diabetic fatty,ZDF)大鼠出现明显血糖升高的症状之前(即糖尿病前期),血糖时间序列复杂度已经降低。DIO 小鼠是糖尿病、肥胖等代谢性疾病常用的动物模型。本研究结果显示DIO 组小鼠的血糖水平尚未达到糖代谢异常水平,即与对照组血糖的差异无统计学意义,但利用MSE 分析DIO 组小鼠血糖时间序列复杂度发现,其复杂度低于对照组且组间差异亦无统计学意义,考虑可能与样本量较小有关。
既往研究[21]发现,生物信号的复杂度可随着疾病的出现和年龄的增加逐渐下降。Chen 等[6]对2 型糖尿病患者的血糖时间序列复杂度进行分析,结果显示其较正常人群有明显降低。来云云等[22]研究显示,血糖水平控制不佳以及血糖波动大均可造成2型糖尿病患者血糖时间序列动态结构复杂度的损失。同样,利用时间序列分析对胰岛素分泌模式的研究[16]显示,糖耐量受损个体的胰岛素分泌率、血糖曲线在中餐后发生“畸变”,且缺乏“三峰两谷”的变化特征,这可能是胰岛素分泌模式复杂度降低的表现。因此,血糖时间序列复杂度可能是糖尿病或糖尿病前期的预测新指标,但仍需进一步在不同实验动物模型和人群中进行研究。
在成功建立以全植入式血糖遥测系统为基础的小鼠CGM 技术过程中,我们发现存在以下问题值得关注:首先,全植入式血糖遥测系统的使用条件之一即为植入实验动物体内,要求操作人员具有较高的手术技术水平,因此,该类人员需经专业培训并反复练习后方可进行实操;第二,术后小鼠需要恢复时间,且对饲养环境和条件有一定要求;第三,全植入式血糖遥测系统购置费用相对较高,或将给大量实验动物样本研究造成一定的经济负担,需在开展研究前进行评估。本研究尚存在部分局限性:①样本量较小,尚需增加样本数量。②由于实验条件有限,2 组小鼠的血糖监测时长存在不齐同的问题,且仅对DIO 小鼠一段时间内的血糖进行监测,未来应在不同阶段对DIO 小鼠及对照小鼠进行连续监测,同时在系统允许范围内延长监测时间,以进一步探究其糖代谢特征。③仅对DIO 小鼠的血糖及体温水平进行监测,未分析其他表型与糖代谢变化的关系,未来应对其活动量、体温与血糖变化之间的关系行进一步研究。
综上所述,本研究在国内首次成功建立了小鼠CGM技术,并结合MSE 分析方法,获得了代谢性疾病研究中常用的DIO 小鼠更为全面的血糖信息;本研究结果或将为代谢性疾病的研究技术手段提供一定的参考。

