丁苯酞对脑缺血患者的临床疗效及对血清炎症因子的影响
王军峰 杨宝
急性脑缺血早期溶栓治疗既可挽救濒临死亡的脑细胞,又可加重缺血细胞的损伤,甚至导致细胞的死亡,此称为缺血再灌注损伤。研究显示,脑缺血再灌注损伤与炎症机制有密切联系,脑缺血再灌注后梗死区及缺血半暗带恢复血流后过度的炎症反应是造成再灌注损伤的重要原因[1]。丁苯酞是我国自主研制的新型脑组织保护药物,可阻断脑缺血治疗过程中的多个病理环节,阻断脑缺血缺氧后的炎症反应,降低血清炎症细胞因子的表达水平,促进血管生成及缺血缺氧神经细胞的功能恢复,改善患者预后[2]。本研究的目的是分析丁苯酞对脑缺血患者神经功能、日常自理能力的恢复及对血清炎症因子水平的影响,现将结果报道如下。
1 资料与方法
1.1 一般资料
回顾性连续纳入2018年3月-2020年3月本院收治的急性脑缺血行阿替普酶溶栓的96例患者。纳入标准:两组患者入院后均行急诊颅脑CT或MRI检查确诊,诊断均符合中国急性缺血性脑卒中诊治指南(2018);既往无脑梗死后遗症病史、日常自理能力正常;发病4.5 h内,入院时有明显神经功能障碍(1分≤NIHSS评分<20分),符合静脉溶栓指征;住院资料完整。排除标准:病情较重,生命体征不稳定,合并重要脏器功能不全;溶栓24 h内行CT或MRI检查出现出血转化;神志不清无法配合的患者。本次研究已通过本院伦理委员会批准。根据临床用药不同分为观察组48例和对照组48例。两组性别、年龄、基础病史及发病时间等资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。

表1 两组一般资料比较
1.2 方法
入院确诊后均急诊行阿替普酶(规格:20 mg/支,生产厂家:Boehringer Ingelheim Pharma GmbH & Co,KG,进口药品注册证号S20160054)静脉溶栓治疗,根据患者体重计算阿替普酶用量(0.9 mg/kg,最大使用剂量为90 mg),其总量的10% 静脉注射1 min,余90% 持续1 h静脉泵入,同时给予活血化瘀、改善脑循环、营养神经等药物治疗。溶栓24 h内行影像学检查排除出血转化后,给予规范的抗血小板聚集、他汀类药物和抗凝等药物按中国急性缺血性脑卒中诊治指南2018治疗[3]。两组基础治疗相同,对照组未联合丁苯酞治疗,观察组溶栓后给予静脉滴注丁苯酞氯化钠注射液100 ml(规格:100 ml/瓶,生产厂家:石药集团恩必普药业有限公司,国药准字H20100041),2次/d,连续治疗14 d。
1.3 观察指标及评价标准
两组分别于溶栓前后24 h及治疗14 d,采用NIHSS评分对患者神经功能缺损情况进行评估,采用Barthel指数计分法对患者的日常生活活动能力进行评定。疗效评定标准:基本治愈,神经症状基本消失,生活基本自理,NIHSS评分减少91% ~100% ,Barthel指数100分;显效,遗留轻微神经症状,能独立完成日常生活,小部分需人帮助,NIHSS评分减少46% ~90% ,Barthel指数75~95分;有效,遗留明显神经障碍,部分生活可自理,大部分需人帮助,NIHSS评分减少18% ~45% ,Barthel指数50~70分;无效,临床症状无明显改善甚至加重,总有效率=(基本治愈+显效+有效)/总例数×100% 。
血清炎症因子检测方法:患者溶栓后即抽取静脉血3 ml及以后每周抽取患者空腹静脉血3 ml,用2 500 r/min转速离心20 min后取上部血清,储存在-30 ℃环境下以备检测,采用酶联免疫吸附试验法检测血清中hs-CRP、IL-6、TNF-α水平,采用免疫放射法检测PTX-3水平,所有检测方法及试剂盒均相同。
1.4 统计学处理
本研究数据采用SPSS 22.0统计学软件进行分析和处理,计量资料以(±s)表示,组间比较采用t检验,计数资料以率(% )表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床治疗效果比较
观察组总有效率93.75% ,高于对照组的77.08% ,差异有统计学意义(P<0.05),见表2。

表2 两组临床疗效效果比较
2.2 两组溶栓前后及治疗14 d的NIHSS评分、Barthel指数比较
两组患者溶栓前及溶栓后NIHSS评分、Barthel指数比较差异无统计学意义(P>0.05),治疗14 d,两组NIHSS评分均较前显著降低,Barthel指数较前显著升高,且观察组的NIHSS评分、Barthel指数改善明显优于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组溶栓前后及治疗14 d的NIHSS评分、Barthel指数比较 [分,(±s)]

表3 两组溶栓前后及治疗14 d的NIHSS评分、Barthel指数比较 [分,(±s)]
溶栓前 溶栓后 治疗14 d 溶栓前 溶栓后 治疗14 d观察组(n=48) 15.55±1.64 6.51±0.35 4.75±0.53 41.21±8.12 53.22±6.85 70.65±8.02对照组(n=48) 15.87±1.45 6.65±0.51 5.19±0.48 41.98±7.76 54.62±7.01 59.87±8.98 t值 1.013 1.568 4.263 0.475 0.989 6.080 P值 0.313 0.120 0.000 0.635 0.325 0.000组别 NIHSS评分Barthel指数
2.3 两组溶栓后及治疗14 d的血清炎性因子水平的比较
两组患者溶栓后血清hs-CRP、IL-6、TNF-α、PTX-3水平比较差异无统计学意义(P>0.05);治疗14 d两组患者血清hs-CRP、IL-6、TNF-α、PTX-3水平均较治疗前明显降低,且联合丁苯酞治疗组明显低于未联合组,差异有统计学意义(P<0.05),见表4。
表4 两组患者溶栓后及治疗14 d血清炎性因子水平比较 (±s)
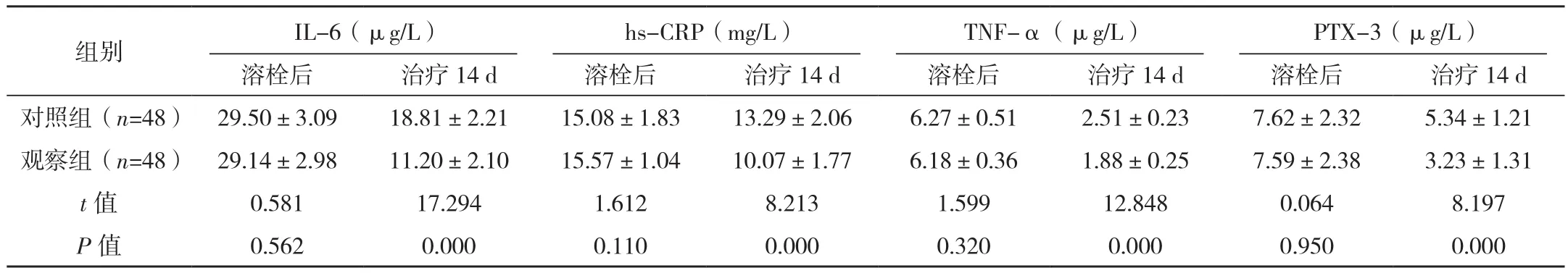
表4 两组患者溶栓后及治疗14 d血清炎性因子水平比较 (±s)
溶栓后 治疗14 d 溶栓后 治疗14 d 溶栓后 治疗14 d 溶栓后 治疗14 d对照组(n=48) 29.50±3.09 18.81±2.21 15.08±1.83 13.29±2.06 6.27±0.51 2.51±0.23 7.62±2.32 5.34±1.21观察组(n=48) 29.14±2.98 11.20±2.10 15.57±1.04 10.07±1.77 6.18±0.36 1.88±0.25 7.59±2.38 3.23±1.31 t值 0.581 17.294 1.612 8.213 1.599 12.848 0.064 8.197 P值 0.562 0.000 0.110 0.000 0.320 0.000 0.950 0.000组别 IL-6(μg/L)hs-CRP(mg/L)TNF-α(μg/L)PTX-3(μg/L)
3 讨论
急性脑缺血早期阿替普酶静脉溶栓治疗是目前最有效、最有希望使闭塞血管再通的治疗方法之一,该治疗可使缺血脑组织的血流迅速恢复,使缺血脑组织早期获得再灌注,使局部脑组织缺血、缺氧造成的神经功能损害症状和体征得到缓解[4]。但部分患者溶栓后出现临床症状加重或出现新的神经功能障碍,可能与脑缺血再灌注损伤有关[5]。急性脑缺血及脑缺血再灌注后脑组织局部的炎症反应是导致脑损伤及神经细胞死亡的主要原因,严重影响患者的神经功能和自主行为能力的恢复[6-7]。炎症因子IL-6和TNF-α在脑损伤炎症反应中发挥重要作用,TNF-α是激活细胞因子的启动因子之一,脑缺血后TNF-α分泌明显增多,TNF-α又可促进IL-6因子分泌,从而导致炎症反应增强,造成炎症区域血管通透性增加,损伤血管内皮细胞,加速脑水肿的形成,引起脑缺血、缺氧区域损伤[8]。hs-CRP与PTX-3是同源性炎性蛋白质,在急性脑缺血后血中hs-CRP与PTX-3水平急剧上升,hs-CRP主要在IL-6诱导下由肝脏细胞分泌而来,hs-CRP为脑损伤早期炎性标志物,参与脑梗死神经细胞损伤、凋亡等过程;PTX-3由中性粒细胞、成纤维细胞及树突细胞等分泌而来,PTX-3是血管损伤后炎症反应和新生内膜增厚的有效标志,有研究显示急性缺血性患者血清PTX-3水平增高程度与缺血程度呈正相关,血清PTX-3持续高水平患者预后较差[9]。文献[10]研究血清炎症因子与脑梗死的关系,结果显示炎症反应可参与脑缺血性梗死的整个治疗过程,有效地控制脑缺血再灌注后的炎症反应可能成为临床治疗的新目标。
丁苯酞属脂溶性药物,活性成分容易通过血脑屏障作用于脑缺血部位。丁苯酞通过保护线粒体结构和功能,抑制氧化应激,改善侧支循环及微循环,降低血脑屏障的通透性,抑制炎性细胞激活及炎性因子释放等,从而改善受损脑组织的能量代谢,缩小缺血灶的面积、减轻脑水肿、保护神经细胞、抑制凋亡[11]。赵雅宁等[12]发现,丁苯酞能明显降低脂多糖诱导小鼠的TNF-α、IL-6等细胞炎性因子释放,增加脑缺血再灌注大鼠皮质和海马中干细胞生长因子蛋白的表达。这也说明丁苯酞能够有效抑制急性脑缺血及再灌注后的炎症因子水平,促进血管生成及缺血缺氧神经细胞功能的恢复,从而改善患者神经功能及行为能力的恢复,改善患者临床预后。本研究结果显示,联合丁苯酞治疗14 d观察组NIHSS评分、Barthel指数改善情况均优于未联合丁苯酞治疗的对照组,差异有统计学意义(P<0.05),同时观察组血清IL-6、hs-CRP、TNF-α、PTX-3水平明显低于对照组,差异有统计学意义(P<0.05)。
综上所述,丁苯酞能明显降低急性脑缺血患者的血清炎性因子水平,进一步改善患者的神经功能恢复,提高患者的日常生活自理能力,临床疗效显著。

