基于SSR 标记的刺参不同地理群体的遗传结构分析及指纹图谱构建*
廖梅杰 王锦锦 李 彬 王印庚①荣小军 张 正 范瑞用
(1. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;2. 青岛瑞滋集团有限公司 青岛 266400)
刺参又名仿刺参(Apostichopus japonicus),广泛分 布于太平洋西部的中国、俄罗斯、韩国与日本沿海,具有很高的药用和营养保健价值,是我国海水养殖中重要的经济品种(廖玉麟, 1997; FAO, 2012)。近年来,由于过度捕捞和环境污染的加剧,野生刺参自然资源趋于枯竭,刺参已被世界自然保护联盟收录到濒危物种红色名录的濒危(EN)等级(Purcell et al, 2013)。随着刺参养殖产业和海洋牧场的快速发展,不同地区人工繁育的苗种在各养殖主产区和养殖海域跨地域使用,在自然条件下与原种群相互交配也会造成种质渗透,因此,对刺参原地理种群的种质鉴别日益迫切。
近年来,同工酶(张涛等, 2017)、微卫星DNA 标记(苗贵东等, 2011)、线粒体DNA (Sun et al, 2010;郝君等, 2013)等标记技术在水产种质研究领域被广泛应用。其中,微卫星DNA 标记又称SSR 标记,因具有多态性高、遵循孟德尔遗传规律、可重复性强、共显性、容易获得等特点,被广泛应用于遗传多样性研究中。另外,还可充分利用其高多态性的特点构建指纹图谱,用于品种之间乃至个体之间基因组序列差异解析,用于亲缘关系很近的品种或个体的准确辨别(McConnell et al, 1995; Scribner et al, 1996; Dewoody et al, 2000)。本研究利用SSR 标记技术对采自中国、韩国和俄罗斯的8 个不同地理种群刺参进行遗传结构分析及指纹图谱构建,以期为刺参种质资源现状评估和保护提供基础数据,同时,为后续种质资源鉴定、开发利用和良种选育提供依据。
1 材料与方法
1.1 实验材料
本研究所用野生刺参分别采集于中国青岛、烟台,俄罗斯符拉迪沃斯托克,韩国浦项、木浦和群山,共6 个海域,其中,韩国刺参的获取是在中国水产科学研究院基本科研业务费“中韩渔业联合研究与合作交流”项目支持下,与韩国海参产业协会合作,完成不同地理群体刺参采集,并由韩方完成DNA 提取;俄罗斯符拉迪沃斯托克地区刺参群体是通过海关相关手续引入。根据所采集刺参体色的差异,韩国浦项采集的刺参又分为红参、黄参和黑参,合计采集6 个海域8 个不同地理群体刺参225 头。不同群体的采样地点及信息见图1 和表1。
1.2 实验方法
利用OMEGA Mollusc DNA Kit 提取刺参基因组DNA,利用NanoDrop 1000 及1%琼脂糖凝胶电泳检测DNA 纯度及完整性后,稀释到50 ng/μl,置于–20℃冰箱保存备用。利用刺参13 个微卫星位点的引物进行PCR 扩增,对PCR 产物直接进行位点扫描。13 对引物序列见表2,引物由本实验室设计并验证,由青岛擎科生物公司合成。PCR 反应总体积为20 μl,包含2×TSINGKE Master Mix 10 μl、10 μmol/L 正反向引物各1 μl、模板DNA 1 μl,加ddH2O 补足至20 μl。PCR 反应扩增程序:94℃预变性5 min、94℃ 30 s、56℃ 30 s、72℃ 30 s,经30 个循环后,72℃延伸15 min,4℃保存。PCR 产物经1.5%的琼脂糖凝胶电泳检测后,送青岛擎科生物公司利用ABI3130 进行扩增片段分型和等位基因分析。
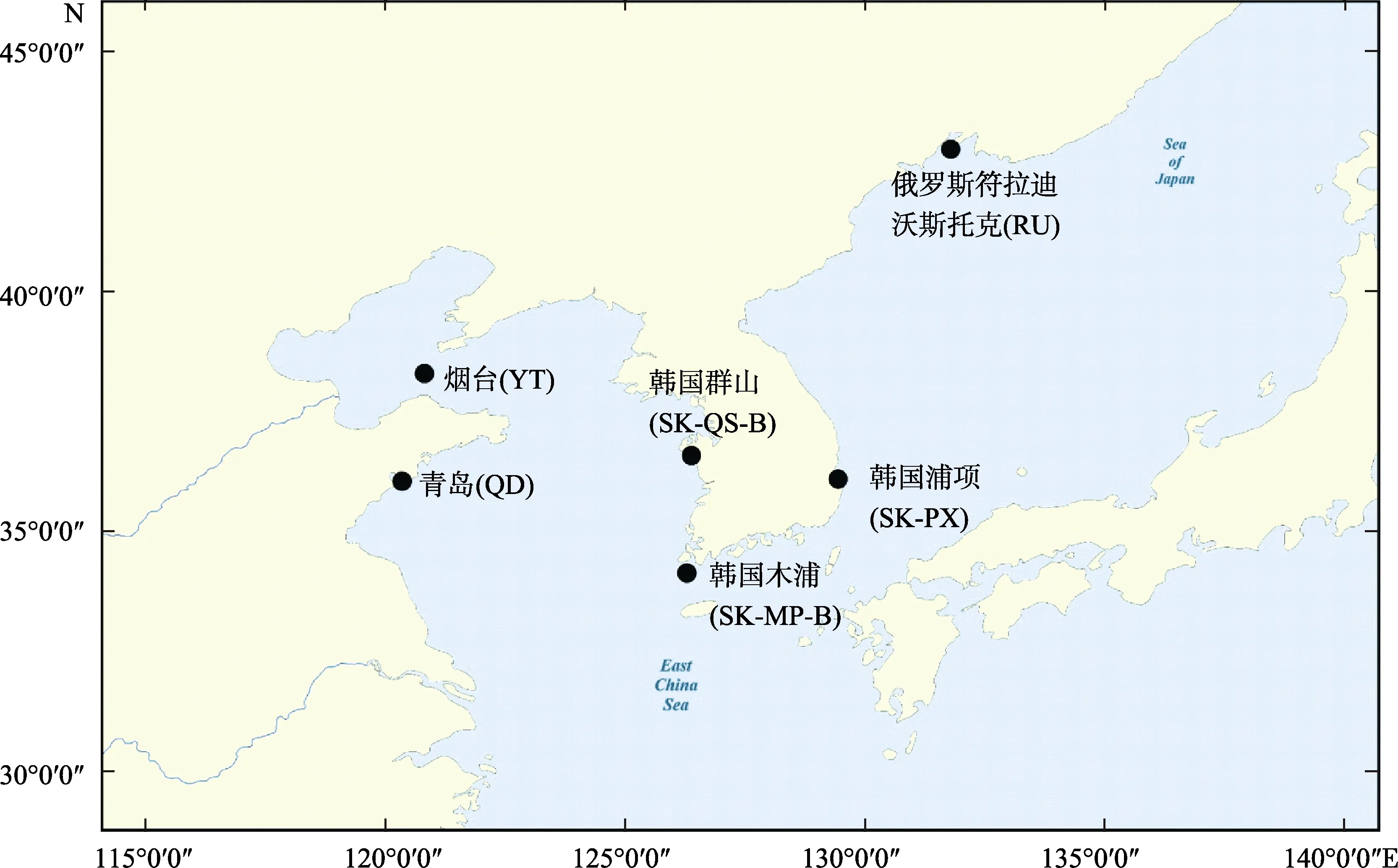
图1 刺参采样地点Fig.1 Sampling sites for A. japonicus populations

表1 刺参采样信息Tab.1 Sampling information for A. japonicus populations

表2 引物序列信息Tab.2 Information of primer sequences
1.3 数据处理
利用Popgene 软件统计整个群体及各群体的等位基因数(A)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、Neiʹs 标准遗传距离(Ds)、群体间基因流(Nm),χ2检验估计群体Hardy-Weinberg 平衡偏离(Yeh et al, 1997)。利用Cervus 软件计算各位点多态信息含量(PIC)(Jo et al, 2017),利用Arlequin 3.5 计算群体间遗传分化系数(Fst)(Excoffie et al, 2010)。采用Excel 绘制刺参8 个地理群体的指纹模式图,并根据位点特异性,构建数字化指纹图谱。使用Structure 2.3中贝叶斯聚类法对所有个体进行聚类分析,K 值设为10,首先根据个体基因型计算各可能自由交配群数K的概率L(K),再基于相邻K 概率计算第一级概率变化L′(K)=L(K)–L(K–l)和第二级概率变化L′′(K)=L′(K+l)–L′(K),获得L′′(K)绝对值,最后用L′′(K)绝对值除以L(K)标准差得到ΔK(Evanno et al, 2005)。
2 结果与分析
2.1 不同地理种群刺参的遗传多样性分析
利用13 对引物对采集的8 个地理种群进行遗传多样性分析,结果见表3。13 对引物全部扩增稳定并具有多态性,13 个位点在8 个群体中共检测出252 个等位基因,单个位点的观测等位基因数(A)为10(AJ06)~34(AJ07),平均等位基因数为19.4。各位点的有效等位基因共83.8 个,各位点的有效等位基因数的范围为1.7(AJ06)~11.8(AJ09),平均有效等位基因数为6.5。多个位点上的等位基因分布不均匀,表现为低频等位基因较多,等位基因数和有效等位基因数的差别较大。样本总的观测杂合度和期望杂合度分别为0.20(AJ05)~0.83(AJ09)和0.42(AJ06)~0.92(AJ09),平均值分别为0.47 和0.80。13 个位点的多态信息含量为0.465(AJ06)~0.909(AJ09),除AJ06 为中度多态性位点(0.25<PIC<0.5)外,其余12 个位点均为高度多态性位点(PIC>0.5)。

表3 各刺参群体在13 个SSR 位点的多样性指数Tab.3 The genetic diversity indices of 13 SSR markers for different populations of A. japonicus

续表3
不同地理群体分析结果显示,各群体平均观测等位基因数为5.5(RU)~10.2(SK-QS-B),平均有效等位基因数为3.8(RU)~4.9(SK-QS-B)。不同地理群体的观测杂合度为0.40(RU 和SK-PX-R)~0.54(SK-PX-B),期望杂合度为0.68(SK-PX-R 和SK-MP-B)~0.76(QD),8 个群体的多态信息含量(PIC)为0.6392(SK-MP-B)~0.7122(QD),各群体均显示为高度多态性(PIC>0.5),说明这几个群体均具有较高的遗传多样性。对8 个群体共104 个位点进行Hardy-Weinberg 平衡检测,结果显示,有73 个位点显著偏离Hardy-Weinberg 平衡(P<0.05),8 个群体中均有大量位点表现为杂合子缺失状态(Fis>0)。
2.2 不同地理种群刺参的指纹图谱构建
利用13 个微卫星位点在各群体中的扩增结果绘制相应群体的DNA 指纹模式图。从图2 可以看出,13 个微卫星位点均具有较高的特异性,每一位点都具有特异性等位基因,相应特异等位基因可用于不同地理群体刺参的鉴别。将这些位点所含有的228 个特异性等位基因进行计算机数字化处理,以“1”和“0”分别表示相应等位基因“有”和“无”,将这13 个微卫星标记产生的特异性多态位点依次排列构建成数字化指纹图谱(表4),可为不同地理种群刺参的种质鉴定提供参照。
2.3 不同地理种群刺参的遗传结构分析
利用Structure 软件进行群体结构分析的集群K与统计量ΔK 的关系中,ΔK 峰值出现在K=3(图3),表明8 个刺参群体的预测自由交配组数为3,因此,后续分群选择K=3。基于分子标记的个体分配模式显示(表5),中国青岛群体(95.1%)、烟台群体(96.9%)样本中90%以上个体被分配于3 号自由交配群;韩国的5 个群体在1、2、3 号自由交配群中皆有分布,其中,韩国木浦群体主要分布于3 号自由群(67.2%),其次分布于1 号自由群(31.7%);韩国群山群体则主要分布于1 号自由群(76.6%),其次分布于3 号自由群(22.1%);韩国浦项黄参群体(94.6%)和韩国浦项黑参群体(97.8%)几乎全部分布于1 号自由群;韩国浦项红参群体(97.2%)几乎全部分布于2 号自由群;俄罗斯群体在3 个自由群中皆有分布,在1 号自由群中含78.2%,2 号自由群有4.8%,3 号自由群有16.9%。当K=3 时,贝叶斯分析法的聚类结果见图4。从图4可以看出,3 个不同颜色分别代表不同的自由群,红色代表1 号自由群,绿色为2 号自由群,蓝色为3 号自由群。图4 中不同颜色分布与表5 中的分配比例相一致。自由分配模式表明,不同地理群体刺参遗传结构与其所在地理位置具有一定的相关性,但又受其他因素影响,导致这种分布模式与地理位置不完全一致。
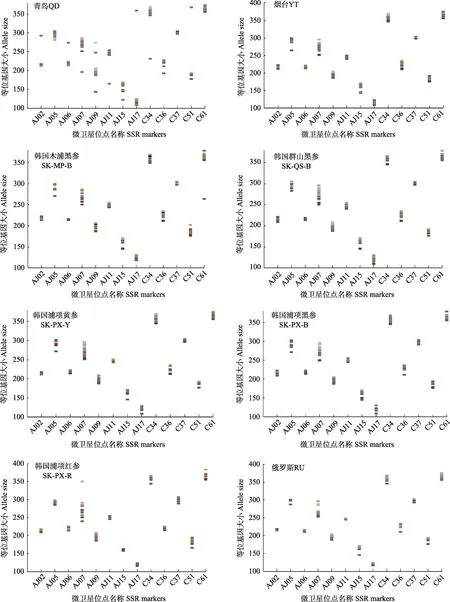
图2 8 个群体刺参的微卫星DNA 指纹模式Fig2 DNA fingerprints of eight populations of A. japonicus
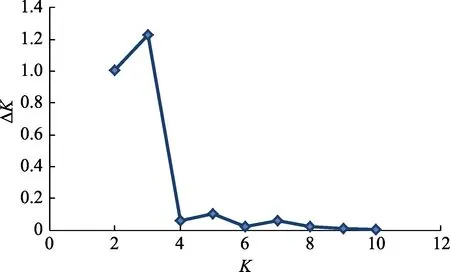
图3 集群K 与统计量ΔK 的关系Fig.3 Scatter plot of possible number of cluster
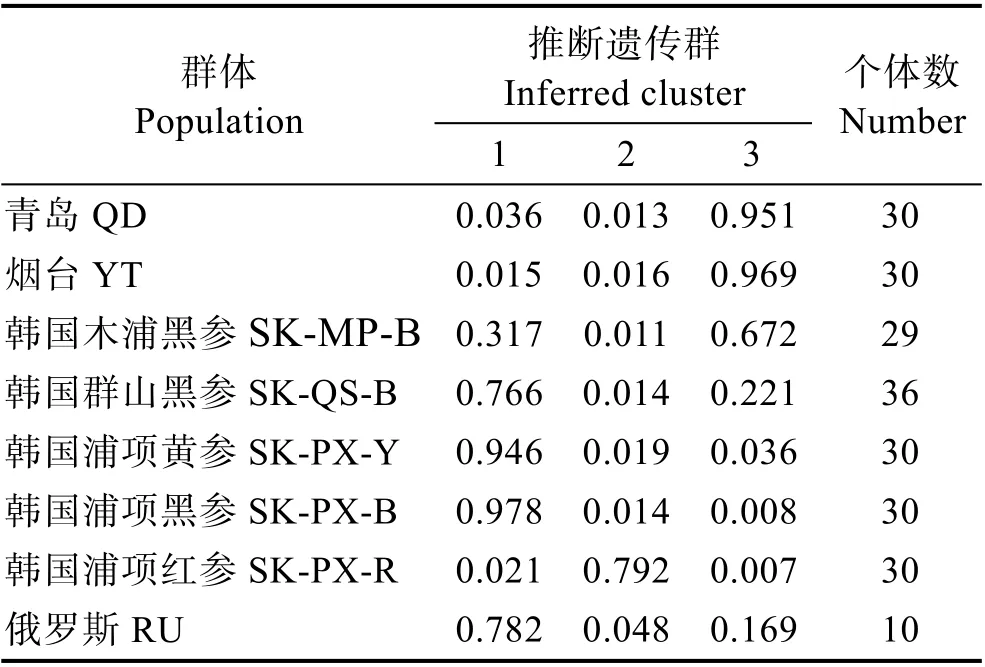
表5 分配模式检验得到的8 个地理群体刺参在3 个自由交配群中的分布比例Tab.5 Distribution proportion of eight geographical populations of A. japonicus in three inferred clusters tested by distribution pattern
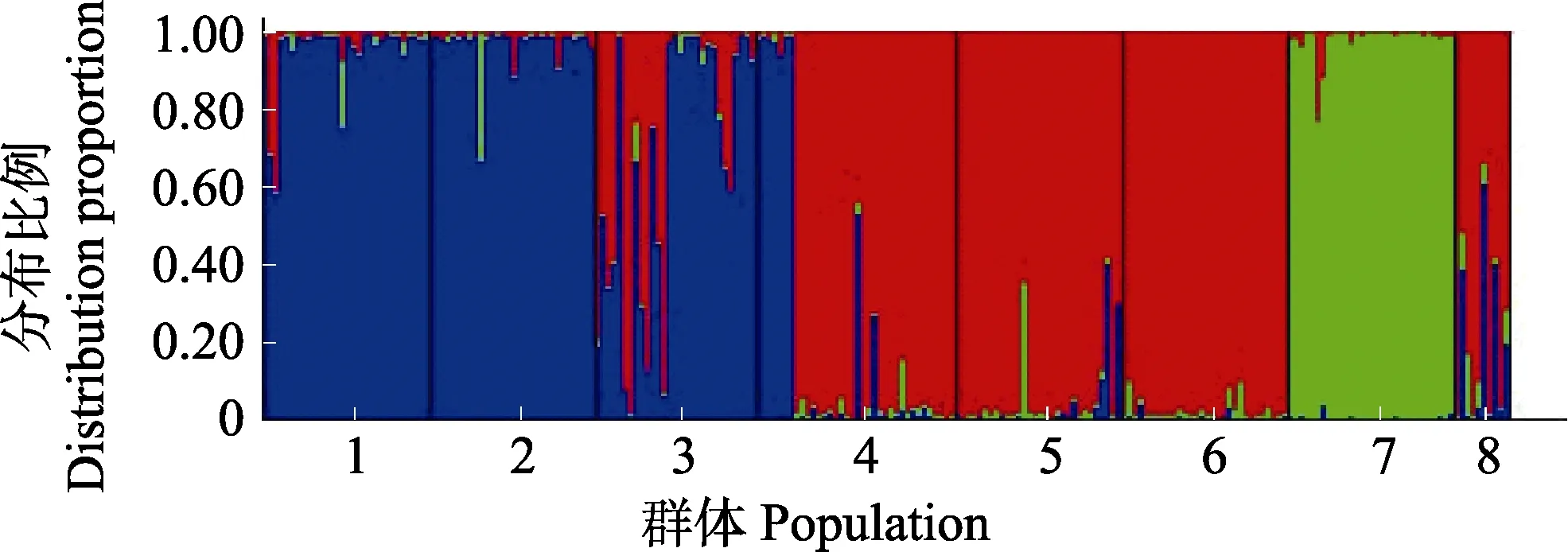
图4 K=3 时贝叶斯分析法的聚类结果Fig.4 Histogram of the Bayesian analysis with K=3
2.4 不同地理种群刺参的遗传进化分析
不同群体之间的遗传分化系数及基因流的统计结果见表6。各群体之间存在不同程度的遗传分化,青岛群体与烟台群体、青岛群体与韩国木浦黑参群体、韩国木浦黑参群体与韩国群山黑参群体、韩国群山黑参群体与韩国浦项黄参及黑参群体、韩国浦项黄参与黑参群体的群体间遗传分化系数较小(0.05>Fst>0),说明以上群体间存在轻度遗传分化;韩国浦项红参群体与其他群体间的遗传分化系数较大(Fst>0.15),说明韩国浦项红参群体与7 个刺参群体间存在高度遗传分化;青岛群体与韩国群山黑参群体、韩国浦项黄参和黑参群体、俄罗斯群体,烟台群体与韩国群山群体等存在中度遗传分化(0.15>Fst>0.05)。
不同群体间的遗传距离和遗传相似指数结果见表7,韩国浦项黑参群体与韩国群山黑参群体的遗传相似指数最高(Is=0.9279),遗传距离最近(DS=0.0749),而韩国浦项红参和烟台群体间的遗传距离最远(DS=1.3573),遗传相似度最小(Is=0.2574)。聚类分析显示(图5),烟台群体、青岛群体与韩国木浦黑参群体聚为一支,韩国浦项黄参群体、韩国群山黑参群体和韩国浦项黑参群体聚为一支,而韩国浦项红参群体作为外群,单独聚为一支。
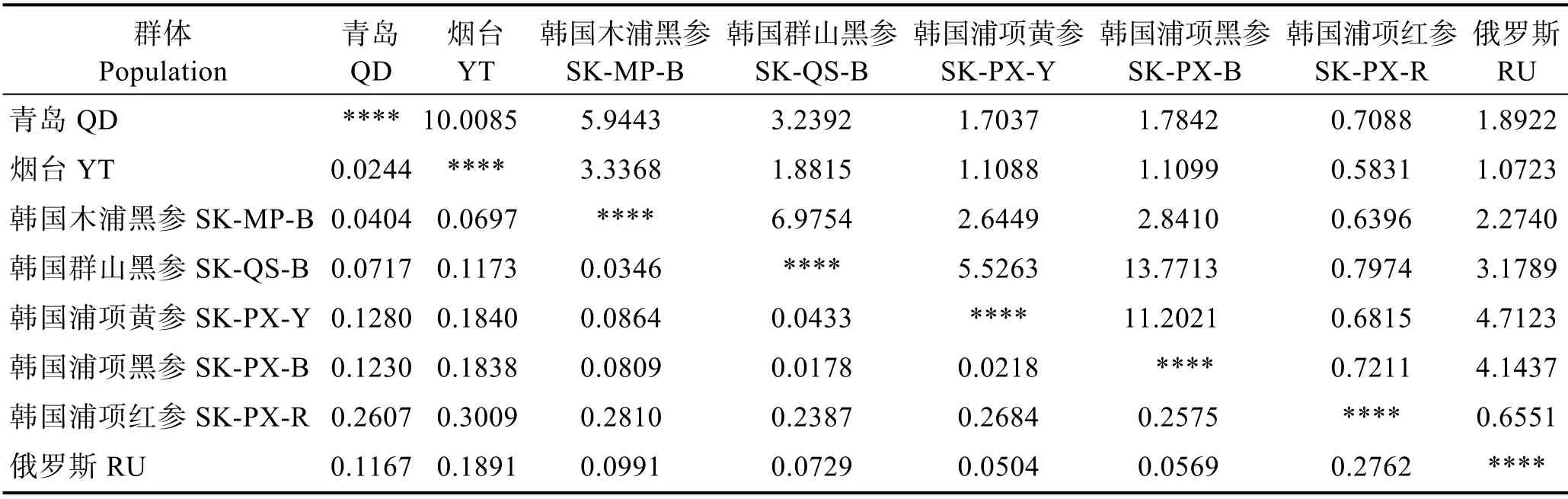
表6 不同群体间遗传分化系数值及基因流Tab.6 Genetic differentiation and gene flow between different populations
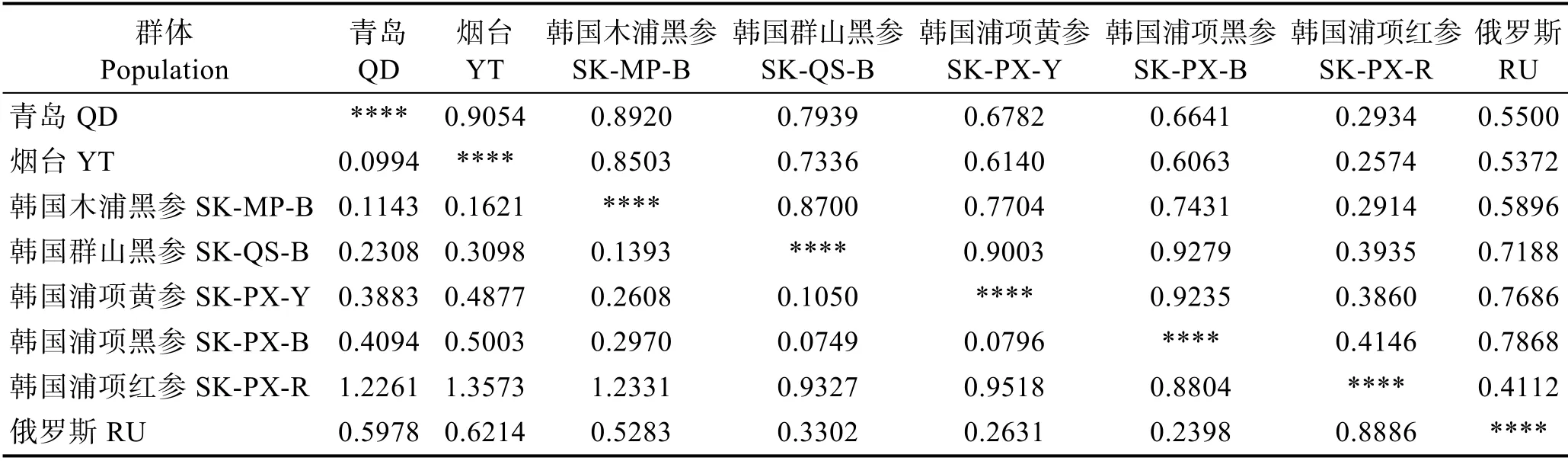
表7 不同群体间的遗传距离和相似性指数Tab.7 Neiʹs genetic identity and genetic distance in different populations
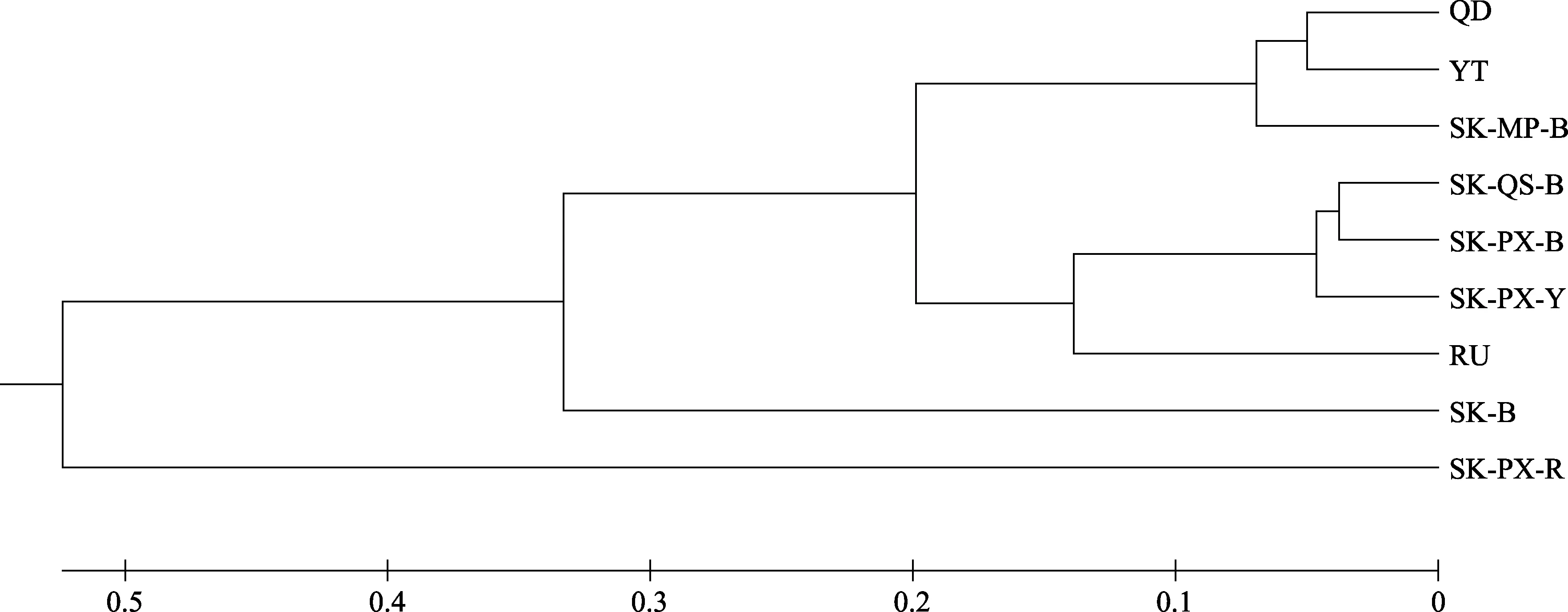
图5 不同地理群体的聚类分析Fig.5 UPGMA tree of the eight populations constructed by genetic distance
3 讨论
近年来,SSR 标记被广泛应用于水产动物养殖群体遗传变异的监测(赵哲霞等, 2014; 程珂等, 2018)、家系鉴别(李雪燕等, 2013)、地理种群遗传多样性(傅建军等, 2015)等研究中。谭杰等(2007)利用微卫星技术分析发现,蓬莱养殖刺参群体遗传多样性低于烟台崆峒岛野生刺参群体。高悦勉等(2004)研究发现,大连大孤山、旅顺塔河湾、长海县大长山、海洋岛及瓦房店复州湾海域地区野生刺参与大连金州杏树屯养殖群体遗传多样性基本无差别,这可能与该研究采样样本的地理区域过于集中有关。本研究利用13 个微卫星位点对8 个不同地理群体225 个刺参个体的遗传多样性进行分析。结果显示,13 个位点在8 个群体中均具有较高的遗传多样性,但不同位点又具有一定的差异性。对于不同位点,等位基因数目不等,其中,位点AJ07 在8 个群体中的等位基因数最多,有34 个,而位点C37 的等位基因数最少,有10 个。不同位点样本的观测杂合度和期望杂合度也具有一定的差异性,分别为0.20~0.83 和0.42~0.92。这种不同位点等位基因数、观测杂合度、期望杂合度存在较大差异的现象在刺参微卫星研究中广泛存在(Zhan et al,2007; 卢超等, 2010)。13 个位点的多态信息含量为0.465~0.909,除AJ06 为中度多态性(0.25<PIC<0.5)外,其余12 个位点均为高度多态性(PIC>0.5),说明本研究所使用的13 个微卫星位点具有良好的多态性,利用这些位点可更客观地检测出不同群体的遗传差异性。不同地理群体间的平均等位基因数也存在显著差异,韩国群山黑参平均等位基因数目(10.2)最多,俄罗斯群体最少(5.5),这可能与其采样个体较少有关。8 个刺参群体观测杂合度(Ho)范围为0.40~0.54,期望杂合度范围为0.68~0.76,8 个群体的多态信息含量范围为0.6392~0.7122,各群体均显示为高度多态性(PIC>0.5),说明几个群体均具有较高的遗传多样性。本研究使用的ABI 3730XL 测序仪对等位基因进行分型分析,与以往电泳法读带相比,获得的等位基因大小更精确,因此,每个位点所检测到的等位基因数目更多,所测定出的群体的遗传多样性也更高。
DNA 指纹图谱技术以其高灵敏度常用于近缘物种鉴别。在水产领域,已应用于罗非鱼(Oreochromis)、剑尾鱼(Xiphophorus hellerii)、鳊鲂鱼(Parabramis,Megalobrama)、大口黑鲈(Micropterus salmoides)的群体或品系的鉴定(宋红梅等, 2009; 全迎春等, 2011;张倩倩等, 2014; 樊佳佳等, 2012)。而在刺参遗传多样性研究方面,指纹图谱应用较少。本研究利用13 个微卫星位点,构建了8 个刺参群体的DNA 指纹数据库,并根据其等位基因片段大小制成了微卫星DNA指纹模式图谱,显示这13 个微卫星位点均具有特异性,可用于不同群体刺参的群体鉴定,可为杂交种和亲权鉴定提供参考。
对8 个刺参群体进行遗传结构分析发现,韩国浦项黑参群体与韩国群山黑参群体的遗传相似指数最高(0.9279),遗传距离最近(0.0749),而韩国浦项红参和烟台群体间的遗传距离最远(1.3573),遗传相似度最小(0.2574)。聚类分析结果显示,烟台群体、青岛群体与韩国木浦黑参群体聚为一支,而韩国浦项黄参群体、韩国群山黑参群体和韩国浦项黑参群体聚为一支,而韩国浦项红参群体作为外群,单独聚为一支,聚类分析与分群结果相一致。Kim 等(2008)利用9 个微卫星位点研究了韩国5 个地理种群的海参遗传进化关系,显示韩国南海海域2 个群体聚为一支,然后与西海海域群体聚在一起,最外侧是韩国东海群体,与本研究结果一致。Chang 等(2010)利用微卫星构建系统发育树发现,日本、韩国及中国大连刺参聚为一支,日本红参与俄罗斯海参聚为一支;潘传燕等(2012)研究发现,中国群体与韩国东海岸群体聚为一支,而韩国西海岸群体、俄罗斯群体和日本群体聚为另外一支。这些研究都表明,影响不同地理群体的刺参遗传分化的因素很多,除了地理位置外,还受海流、季风、气候、苗种逃逸等影响(谭杰等, 2007a、b)。对韩国浦项地区3 个不同颜色刺参的分析表明,韩国浦项红参群体的遗传分化及遗传结构与其他群体差异较大,说明体色与遗传关系具有相关性。Kanno 等(2006)利用11 个微卫星位点对日本3 个颜色刺参种群进行物种差异分析,结果显示,红色刺参与绿色、黑色刺参之间存在较大遗传差异,且在聚类分析中,红色刺参单独聚为一支,绿色和黑色刺参聚为一支,与本研究结果一致。
本研究利用13 对微卫星引物对6 个海域8 个地理群体的研究发现,各群体均具有较高的遗传多样性,并且不同群体刺参遗传分化结果与其所处的地理位置及其体色具有一定的相关性,是生态环境、海流、地理阻隔相互作用的结果,构建微卫星指纹图谱可以将8 个群体区分开,相关结果将为刺参种质资源鉴定和挖掘利用提供数据支撑。

