固体核磁共振Multiple-CP定量技术的参数优化与应用研究
张志兰,王 宁,唐丹丹,舒 婕,李晓虹
(苏州大学材料与化学化工学部,分析测试中心,苏州215123)
近年来,固体核磁共振(Solid state nuclear magnetic resonance,SSNMR)技术在结构和动态学研究中发挥着特有的优势.在对各种不溶物质或材料体系结构的研究过程中,定量信息的检测成为了SSNMR测试的主要需求之一[1,2].通过恰当地使用SSNMR定量技术,可以获取有关分子基团比例[3]、混合物组分含量[4]及多相体系相结构[5]等信息,适用的体系主要包括有机小分子、高分子、功能材料及其混合物等.SSNMR常用的定量技术为单脉冲高功率去耦(Direct polarization with dipolar decoupling,DP)技术[6],该方法主要用于自然丰度较低的S核的检测.然而对于多数样品体系,定量DP谱一般需要花费十几个小时甚至数周的时间,因此DP方法的可行性较低.与DP实验相比,交叉极化技术(Cross polarization,CP)通常可以在较短的时间里获取信噪比更高的谱图[7,8].然而,在相同的实验条件下,样品中不同S{I}体系的交叉极化效率各不相同(I为富核),即具有不同的CP动力学行为[9].因此,CP虽然可以节省时间,却不具有定量性.
基于以上问题,研究者先后提出了多种定量方法[10,11]来实现短时间内S核的定量表征,如RAMPCP[12],SD-CP-MAS[13,14],QUCP[15~17]和QUSP[18]方法.但这些方法仅对特定的样品体系适用,所测定的定量信息种类同样受到限制.2008年,Zhang等[19~22]提出了QCP/QCPRC方法,可适用于多种纯净物及混合物的基团比例、共混组分的检测.但该方法涉及多步数据处理过程,操作相对复杂.与上述几种定量方法相比,Multiple-CP表现出较高的可行性,受到了普遍的关注.该方法通过多次交叉极化过程使样品体系中不同S核的交叉极化效率逐步提升并趋于相同,从而直接实现谱图的定量性.多次交叉极化的概念由Gerstein和Dybowski[23]于1985年首次提出.1990年,Wu等[24]提出了基于多次交叉极化的定量检测技术;2014年Schmidt-Rhor等[25]将该方法命名为Multiple-CP,并系统地探讨了1H射频场强度等实验参数对定量结果的影响.2017年,他们对Multiple-CP技术进行了优化,通过使用180°补偿脉冲技术降低90°脉冲共振偏置和激发脉宽不准确所导致的信号损失.在共振偏置为±10 kHz、90°脉宽误差为20%的实验条件下,信号损失仅<3%[26].此外,Hirschinger等[27,28]根据β-甲酸钙、二茂铁和丙氨酸的Multiple-CP实验数据并结合理论计算,讨论在不同魔角转速下,Multiple-CP谱图的信噪比及测量结果的准确性.随着对Multiple-CP技术的不断探索,已实现对不同体系、不同定量信息的检测.2015年,de Azevedo等[29]应用Multiple-CP方法检测出甘蔗蔗渣中纤维素的结晶度;2016年,Martineau等[30]将该方法应用于定量检测缬氨酸/蛋氨酸混合物的组分含量;2018年,Zhang等[31]将Multiple-CP方法应用于土壤有机质中含碳官能团比例的研究,从而探讨土壤中有机碳的稳定成分随耕种时间长短及土壤类型的变化规律;2019年,Birdwell和Mao等[32]使用Multiple-CP技术分析了多种油页岩干酪根样品中含碳官能团的比例,研究杂原子浓度对其结构的影响.可见,Multiple-CP技术在分子结构、基团比例、共混组分及相成分分析等方面都有潜在的应用价值.然而,通过对上述研究工作的总结发现,Multiple-CP对于不同的样品体系,其实验参数差异较大,即对于不同种类的体系或基团,Multiple-CP所需的实验参数条件不同.因此,如何依据样品的种类和特性来准确设置实验参数是实现Multiple-CP谱图定量性的前提.此外,对于共混体系组分含量的检测,Multiple-CP的适用性同样需要深入探讨.这需要系统地掌握Multiple-CP各种实验参数与样品属性之间的关系,从而确定Multiple-CP技术可适用的体系范围以及最优的实验参数范围.
基于此,本文选择L-丙氨酸、L-缬氨酸以及二者的混合物作为模型样品,通过对比不同实验参数条件下Multiple-CP测试结果的准确性,系统地探讨了Multiple-CP实验脉冲序列中弛豫恢复时间(td)、交叉极化接触时间(tp)和交叉极化次数(n)3种实验参数对样品参数TCH(交叉弛豫时间)和(自旋锁定场下氢的自旋晶格弛豫时间)的依赖性.依据对上述实验数据的分析,总结了Multiple-CP定量技术所适用的纯净物或共混物体系的TCH和特征,并提出Multiple-CP实验参数的设置要点.同时提出了Multiple-CP技术适用样品或体系的判断依据,为使用Multiple-CP进行定量检测提供了可参考的参数设置方案.
1 实验部分
1.1 试剂与仪器
L-丙氨酸(L-alanine)和L-缬氨酸(L-valine粉末样品)均为分析纯,购于北京伊诺凯科技有限公司;L-丙氨酸和L-缬氨酸混合样品的制备:首先,分别称取17.2 mgL-丙氨酸固体粉末和23.4 mgL-缬氨酸固体粉末,然后将两种样品置于研钵中反复研磨,并使其混合均匀.将混合物样品填充在外径为3.2 mm的ZrO2转子中,均匀压实,进行SSNMR实验.
Bruker Advance III HD 400 WB固体核磁共振波谱仪(德国布鲁克公司),实验使用3.2 mm H/F/X MAS DVT三共振探头;1H和13C的共振频率分别为400.25和100.65 MHz.
1.2 实验参数
实验选择的魔角旋转速率为10 kHz,1H和13C的90°脉冲宽度为3.2μs,所对应的射频场强度均为78 kHz.所有交叉极化过程中1H的最大自旋锁定场强度为78 kHz,脉冲形状为功率由100%衰减至50%的ramp脉冲[33],采样期间使用异核偶极耦合去耦序列(TPPM)对1H去耦[34].所有的13C谱图中,13C谱峰的化学位移均以四甲基硅烷(TMS)为参比,使用金刚烷进行三次定标,其中CH谱峰13C的化学位移δ为38.484[35,36].
实验数据分析中,TCH和相对差异度ΦS=[(A1-A2)/A1]×100%,其中,A1,A2分别代表不同的TCH和值,且A1>A2.
L-丙氨酸和L-缬氨酸纯净物分子基团比例的百分误差计算方法:首先对分子内各基团谱峰积分值进行归一化,I′i=Ii/Iave,其中为含13C基团的种数,Ii为分子内某一基团的积分值.之后依据公式计算实验百分误差,其中为理论值.
混合物中各组分含量的实验偏差计算公式为ΦM=[(φexp-φ0)/φ0]×100%,其中,φexp=Ia/(Ia+Ib)为实验测得混合物含量,Ia和Ib分别代表混合物中各组分的特征峰积分值,φ0为实际组分含量.
2 结果与讨论
2.1 3种实验参数对Multiple-CP定量性的影响
Multiple-CP实验脉冲序列如Scheme 1所示.在经过初次交叉极化作用后,1H和13C的磁化矢量在90°脉冲的作用下,回到z方向(即沿B0场方向).在td期间,1H的磁化矢量通过自旋晶格弛豫作用恢复到热力学平衡态,1H的自旋晶格弛豫时间用T1,H表示.同时,已经极化增强的13C信号则会通过自旋晶格弛豫作用发生衰减,碳的自旋晶格弛豫时间用T1,C表示.因此,td的设置既需要确保大部分1H的磁化矢量恢复到热力学平衡态,同时应尽可能减小13C磁化矢量的衰减.此外,td的设置直接影响Multiple-CP的实验时间.对于n=4,累加次数为1000的13C Multiple-CP实验,当td增加1 s时,实验时间会延长51 min.因此,td的设置不可过长,仅需确保大部分1H的磁化矢量弛豫恢复即可,一般需满足1~2T1,H,此时约63%~86%的1H的磁化矢量弛豫恢复[25].此外,在逐次的交叉过程中,单次交叉极化的接触时间为tp,交叉极化总次数为n.上述实验参数均影响Multiple-CP测试结果的准确性.
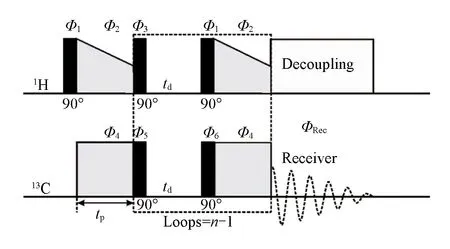
Scheme 1 Scheme of Multiple-CP pulse sequence with CP following phase cycles
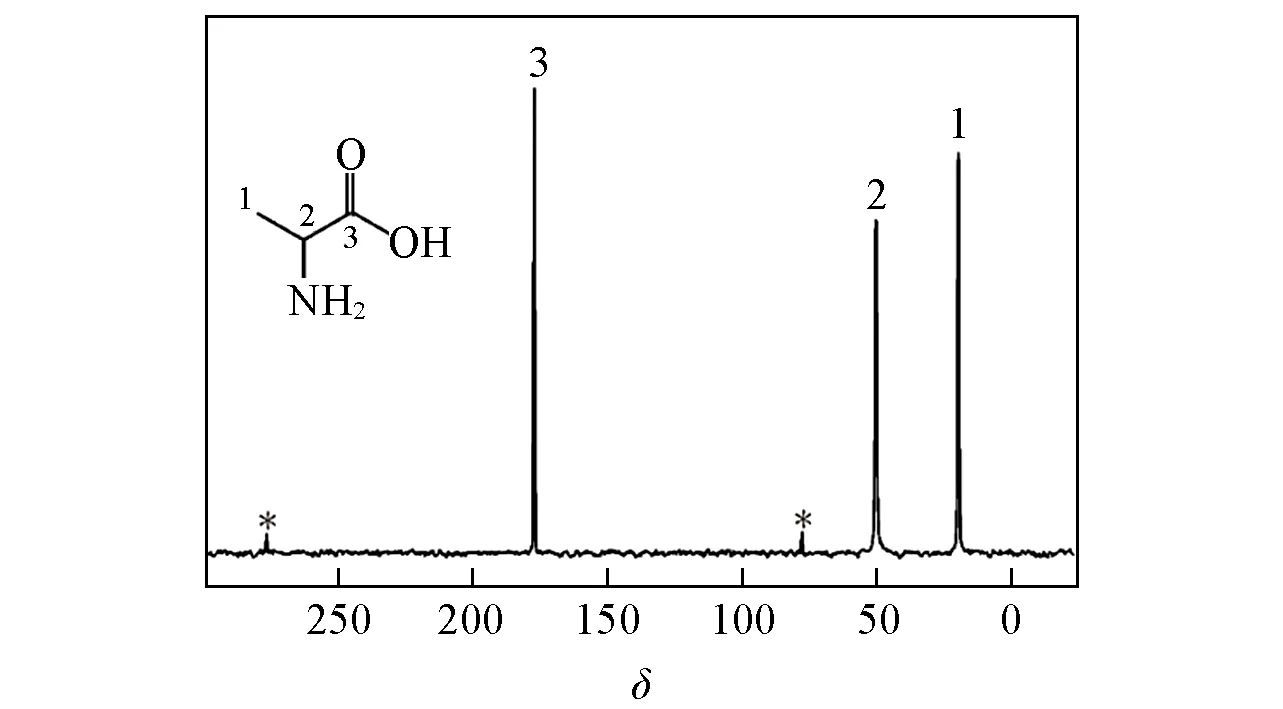
Fig.1 Structural scheme of L-alanine(inset)and the 13C Multiple-CP spectrum recorded with tp of 1.0 ms,td of 2 s and n of 4
为了探讨td,tp和n3个实验参数对Multiple-CP测试准确度的影响,首先选取L-丙氨酸为模型样品,通过改变实验参数条件,研究分子中CH3,CH和CO 3种基团谱峰强度的变化规律.L-丙氨酸分子结构及13C Multiple-CP谱图如图1所示.通过改变实验参数tp,初步探讨Multiple-CP定量性对接触时间的依赖性.同时,对比CP以及Multiple-CP条件下,各基团信号强度随交叉极化时间tp的变化关系.由于L-丙氨酸的自旋晶格弛豫时间T1,H=0.977 s,因此实验将td设为2 s.n分别为1,2,4,8,td为2 s时,CO,CH,CH3的谱峰强度随tp变化的动力学曲线如图2(A)~(D)所示.可见,当交叉极化次数n=1时,即普通的CP实验,在0 ms<tp<2.0 ms的范围内,3个基团的交叉极化效率在任何接触时间均不相同,3种基团的交叉极化动力学曲线受基团TCH和TH1ρ等参数的调制,CP无法实现定量.n=2时的交叉极化动力学曲线与CP不同,但仍无法实现定量检测.而当n=4时,各基团信号强度在1.0~1.3 ms期间内趋于一致,且该区间内基团积分比值相对于理论值的百分误差小于5%.当n=8时,可定量的tp范围扩大至0.8~1.3 ms.以上实验数据表明,Multiple-CP的动力学曲线与常规CP不同,谱峰强度明显受到tp的影响,且受到交叉极化次数n的调制.通过对CO,CH和CH3基团TCH和TH1ρ的测定,发现3种基团的TCH值差异较大,具体数据列于表1.其中,TCH的差异性致使3种基团交叉极化效率在0~1.0 ms区间差异较大.此外,L-丙氨酸的TH1ρ仅为1.7 ms,说明在接触时间为0.5~2.0 ms范围内,1H的磁化矢量由于TH1ρ作用衰减了20%~69%,因此,随着接触时间的增加,谱峰强度均表现出衰减的趋势(图3).依据上述实验数据可知,对于L-丙氨酸样品,Multiple-CP谱图的定量性对实验参数tp的依赖性较大,当n=4,td=2 s时,仅在tp处于1.0~1.3 ms范围内获取定量结果.

Fig.2 Normalized peak-intensities of L-alanine recorded as a function of contact time tp using Multiple-CP scheme
此外,探讨了Multiple-CP定量性对交叉极化次数n的依赖性.图3(A)~(D)分别为td=2 s,tp=0.5,1.0,1.5和2.0 ms时,n值从2变化到11时绘制的各基团信号强度随n的变化关系图.由图3可见,随着n值的增加,CO,CH和CH3的交叉极化效率逐渐增大,所采集的三者的信号逐渐增强.当tp=0.5,1.5和2.0 ms时,三者交叉极化效率在任一交叉极化次数n下都不能达到一致;而当tp=1.0 ms,n≥4时,交叉极化效率基本一致,定量结果的实验百分误差小于5%.
为了更系统地探讨Multiple-CP测试结果的准确度对td,tp及n的依赖性,测试了L-丙氨酸中CO,CH和CH3信号强度分别随tp,td和tp,n的变化关系,并绘制了相应的信号强度投影图和实验百分误差投影图,并用不同颜色表示不同的强度或百分误差值(图4和图5).首先,当交叉极化次数n=4时,通过逐次改变tp和td2个实验参数,来研究该组实验参数对谱峰强度和测试准确度的影响[图4(A)~(C)].可见,3组谱峰信号的强度随td和tp的增加,表现出较明显、且各不相同的变化趋势,这主要是由于各个基团的TCH差异较大,且TH1ρ的影响较明显.为了评估Multiple-CP方法在各个实验参数条件下,测试L-丙氨酸基团比例的准确性,实验计算了定量结果的实验百分误差,对应的误差投影图如图4(D)所示.其中,深紫色区域的误差值小于5%.依据误差投影图的颜色信息可知,td对于测试准确度的影响较低,实验中仅需满足td≥1.0 s.与之不同,tp的变化对测试准确度有较大的影响,仅当tp处于1.0~1.3 ms范围内时,Multiple-CP表现出较高的定量性,相应的实验百分误差小于5%;对于其它的tp参数区间,百分误差值较大,Multiple-CP不具有定量性.此外,实验将td定为2 s,通过逐次改变实验参数tp和n来进一步探讨Multiple-CP定量性对交叉极化次数n的依赖性,所绘制的信号强度投影图及对应的误差投影图如图5(A)~(D)所示.通过对该组数据的分析,发现当交叉极化次数n≥4时,Multiple-CP方法的tp最优范围大致相同,并且随着n的增大,适用于定量CP的tp范围略有增宽.n=4时,误差小于5%的tp范围为1.0~1.3 ms;n=8时,可定量tp范围增至0.8~1.3 ms;而当n=11时,误差小于5%的tp范围为0.6~1.2 ms.

Table 1 TCH,T1,H and T H1ρvalues of L-alanine and L-valine

Fig.3 Normalized Multiple-CP peak-intensities of L-alanine as a function of the number of CP contacts with td of 2 s and tpof 0.5 ms(A),1.0 ms(B),1.5 ms(C)and 2.0 ms(D)
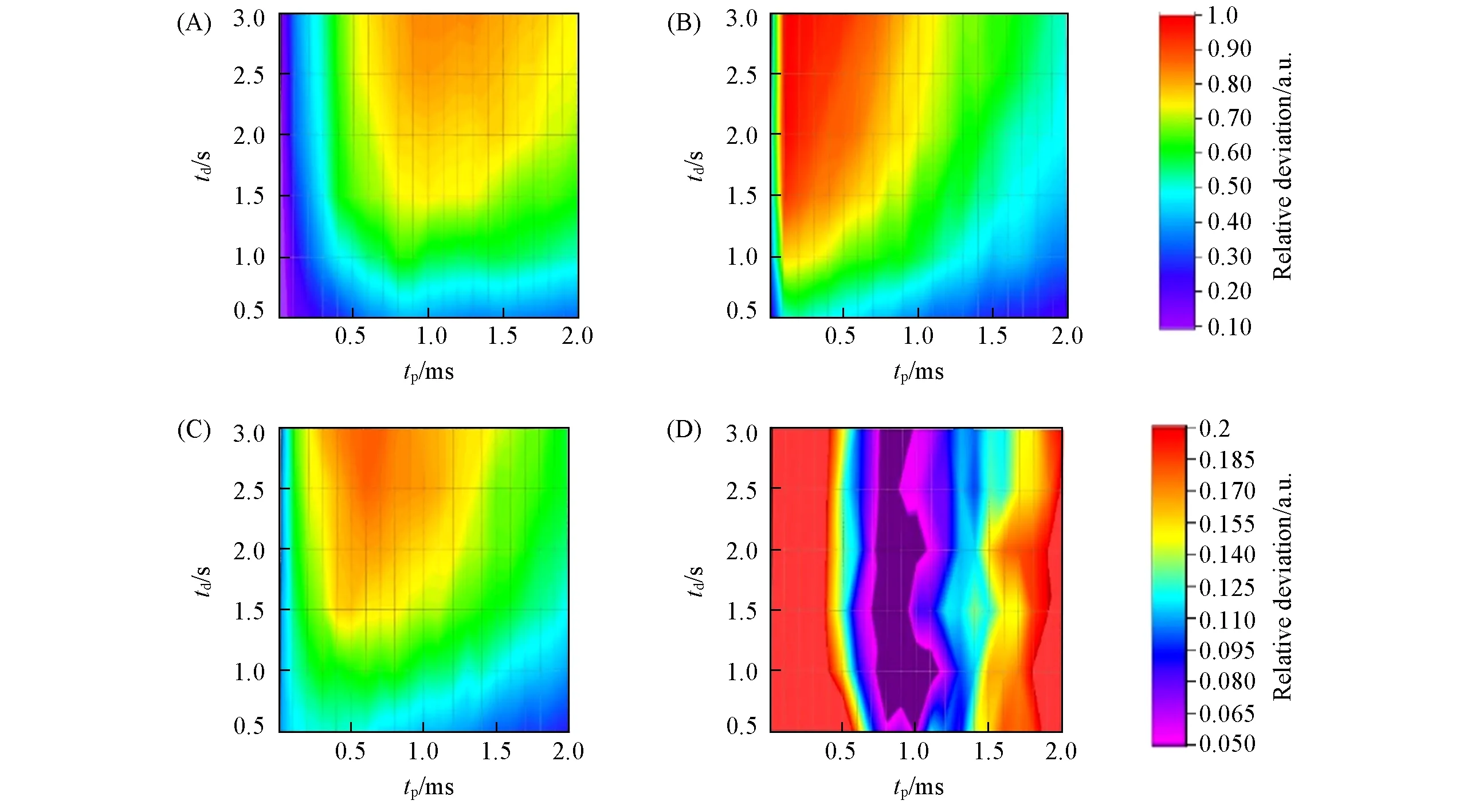
Fig.4 Two dimentional projections of peak intensity modulated by Multiple-CP experimental parameters of tp vs.td for CO(A),CH(B)and CH3(C)in L-alanine and the two dimentional projection of the corresponding percentage errors(D)

Fig.5 Two dimentional projections of peak intensity modulated by Multiple-CP experimental parameters of tp vs.n for CO(A),CH(B)and CH3(C)in L-alanine and the two dimentional projection of the corresponding percentage errors(D)
2.2 样品TCH和的差异度对Multiple-CP定量实验参数的影响
通过对L-丙氨酸的研究可知,在满足td和n的设置条件下,Multiple-CP测试结果的准确性受单次交叉极化接触时间tp的影响较大.而tp在固定范围内,影响谱峰强度的因素主要包括TCH和TH1ρ.对于具有不同TCH和TH1ρ的体系或基团,其对应单次CP谱峰的交叉极化动力学曲线不同,因而谱峰积分不具有定量性.而通过对L-丙氨酸样品的研究发现,Multiple-CP的多次极化传递动力学过程同样受到TCH和TH1ρ的影响,但与单次CP实验相比,Multiple-CP的交叉极化动力学过程对TCH和TH1ρ的宽容度更高.
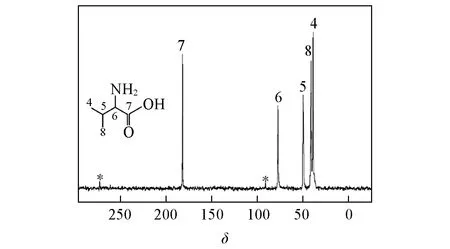
Fig.6 Structural scheme of L-valine(inset)and 13C Multiple-CP spectrum recorded with tpof 1.0 ms,td of 2 s and n of 4
为了探讨样品的TCH和TH1ρ的差异度对Multiple-CP测试准确度的影响,选取了L-缬氨酸进行实验.L-缬氨酸的分子化学结构较L-丙氨酸复杂,其分子内同时存在TCH值相近和差异较大的基团,可以作为Multiple-CP方法评估的模型样品.L-缬氨酸的分子化学结构示意图、13C Multiple-CP谱图和谱峰归属如图6所示.L-缬氨酸分子内各个基团的TCH和值如表1所示.其中,相同种类基团之间的TCH值相近,如同为CH基团的C5,C6和同为CH3基团的C4,C8,而不同种类基团之间的TCH值相差较大;如分别为CO,CH和CH3的C7,C5和C6.实验首先设定n=4,td=2 s,通过改变tp,得到L-缬氨酸中各基团谱峰的动力学曲线图,如图7(A)所示.通过对各基团谱峰比例的计算,得到相对理论值的实验百分误差[图7(B)].依据测试结果可知,当tp为1.0~1.3 ms时,实验误差小于5%,与L-丙氨酸Multiple-CP的定量区间一致.通过对比表中2种氨基酸的TCH和发现二者的TCH和虽然不同,但相同种类基团的TCH和接近.基于此,L-缬氨酸的Multiple-CP实验参数与L-丙氨酸基本一致.此外,L-缬氨酸中的C5和C6,C4和C8的Multiple-CP谱峰强度随tp变化的动力学曲线几乎一致,其中C4和C8的TCH相差6%,而C5和C6的TCH相差8%.由此可见,与CP相比,Multiple-CP的极化传递动力学过程受TCH和差异度的影响较低.图8对比了C5和C6,C4和C8,C5和C8,C6和C7 4组碳谱峰的积分比值相对于理论值的误差.对于均相的纯净物体系,各个基团的相同,但TCH往往不同.其中,C5和C6,C4和C8 2组基团的TCH最大相差约8%[图8(A)和(B)];而C5和C8,C6和C7 2组基团的TCH相差分别78%和88%[图8(C)和(D)].由图中数据可见,对于TCH差异性较小的C5和C6,C4和C8,其Multiple-CP定量结果在tp为0.1~2.0 ms时,百分误差均小于5%;而对于TCH差异性较大的C5和C8,C6和C7,其获取Multiple-CP定量结果的tp范围逐步减小,当TCH相差88%时,仅在0.9~1.4 ms范围内时,误差小于5%.由此可见.对于TCH差异较大的基团,其Multiple-CP的定量准确度受实验参数tp的影响较大.

Fig.7 Normalized peak intensities of L-valine recorded as a function of contact time tp using Multiple-CP scheme(A)and the corresponding percentage errors modulated by tp(B)

Fig.8 Percentage errors of the group ratio as determined using Multiple-CP with the variation of tp for L-valine
为了进一步探讨Multiple-CP对于共混体系组分含量测定的可行性,选取L-缬氨酸和L-丙氨酸的混合物作为模型样品,通过分析几组TCH和差异度不同的基团的实验数据,总结Multiple-CP定量分析的实验策略.图9为L-缬氨酸/L-丙氨酸摩尔比1∶1的混合物的13C Multiple-CP谱图.混合物谱图中,L-丙氨酸的C2,C3和L-缬氨酸的C5,C6,C7原子核谱峰基本没有重叠,可以通过Multiple-CP谱图中每个组分的特征峰强度来计算混合组分的摩尔比.为了对比TCH和TH1ρ的差异度对定量准确度的影响,实验选取4组不同的基团作为研究对象,包括2组TCH差异较小的CH基团:C2和C5,C2和C6,相对差异度为21%;以及2组TCH相差较大的CH,CO基团:C3和C6,C2和C7,相对差异度为91%.与L-缬氨酸和L-丙氨酸纯净物相同,实验参数:td=2 s,n=4,通过改变tp由0.1 ms至2.0 ms,采集一系列Multiple-CP谱图,计算各tp下实验结果的误差,绘制的误差图如图10所示.对于TCH差异较小的2组基团C2和C5,C2和C6,Multiple-CP在tp为0.1~2.0 ms时均表现出很高的测试准确度,实验误差小于5%[图10(A)和(B)];而对于TCH差异较大的2组基团C3和C6,C2和C7,Multiple-CP的定量性对tp实验参数的依赖性较大,仅当tp为0.9~1.2 ms时,组分比例的测试结果与理论结果接近[图10(C)和(D)].
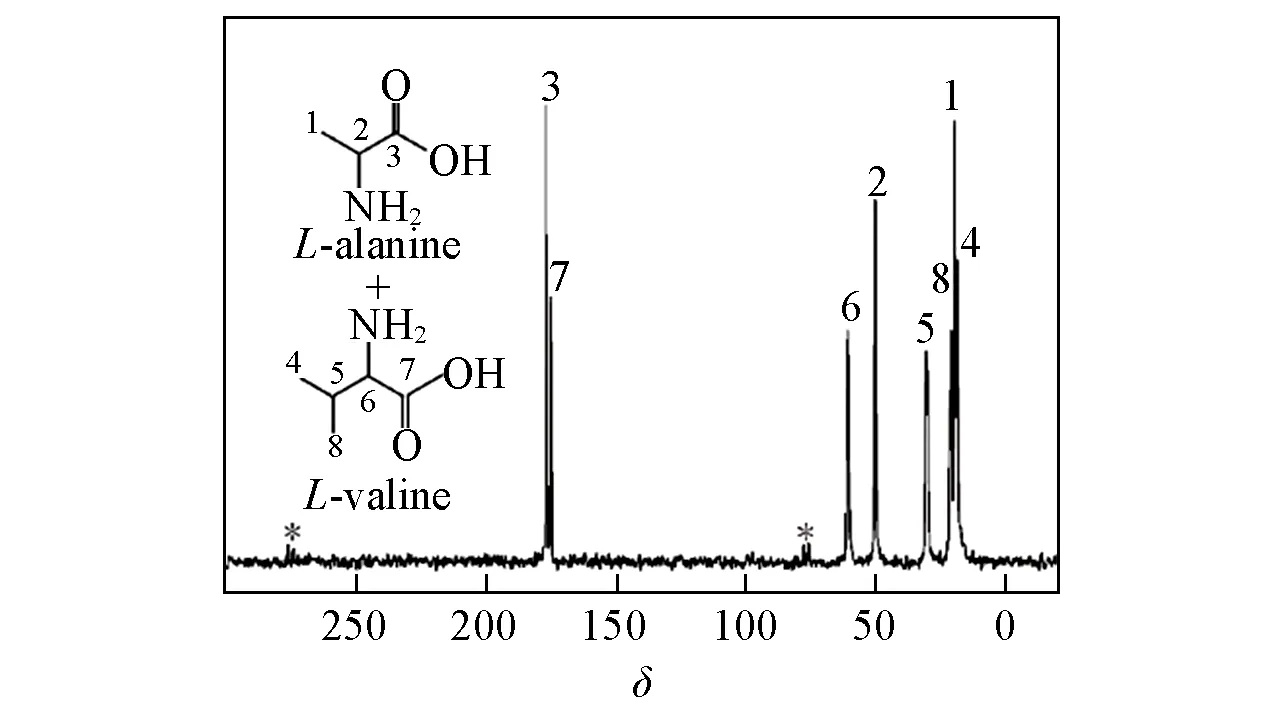
Fig.9 Structural scheme of L-alanine and L-valine(inset)and the 13C Multiple-CP spectrum recorded with tpof 1.0 ms,td of 2 s and n of 4

Fig.10 Percentage errors of the group ratio as determined using Multiple-CP with the variation of tp for L-alanine and L-valine mixture
依据对L-丙氨酸、L-缬氨酸和L-缬氨酸/L-丙氨酸混合物的研究数据,可以看到分子基团的TCH和对Multiple-CP实验参数的设置影响较大.对于常规SSNMR实验条件下的纯净物或均相体系,由于氢原子核间的自旋扩散作用,使得各个基团的基本一致.此时,TCH是影响tp参数设置的关键.依据L-缬氨酸分子内基团比例的实验数据,可以看到当2种基团的TCH差异度为8%时,Multiple-CP对tp参数的宽容度较高.而当2种基团的TCH差异度达到88%时,实现Multiple-CP定量检测的tp参数范围较窄.此时,对于13C Multiple-CP谱图信噪比较差的样品体系,tp的优化存在困难.此外,应用Multiple-CP测试混合物的组分含量时,同样需要考虑各个组分TCH和的差异性.首先,混合物中各组分的需相近,实验选取的L-丙氨酸和L-缬氨酸的差异度为32%;此外,对于各组分的特征峰,需尽量选取种类相同的基团,这样确保TCH的差异度不大.对于L-缬氨酸和L-丙氨酸的混合物样品,当TCH的差异度为21%时,Multiple-CP仍可在较宽的tp范围内实现定量.
3 结 论
通过Multiple-CP定量技术对L-丙氨酸、L-缬氨酸及二者共混物的定量检测,研究了在该方法中实验参数td,tp和n对样品属性参数的依赖性,并总结了Multiple-CP方法适用的样品属性参数特征.研究结果表明,在3种实验参数中,tp对样品属性的依赖性最强,该参数的设置受样品的TCH和的影响最大.对于纯净物和均相体系而言,不同基团的TCH的差异度是影响实验参数tp设置的关键;而对于混合物体系或多相体系,需同时考虑各个基团的TCH和各组分的对实验参数tp的影响.对于各组分的特征峰,需尽量选取种类相同的基团,可确保TCH的差异度不大.还需进一步通过改进Multiple-CP实验脉冲序列简化Multiple-CP的优化过程,提高实验对样品属性TCH和的宽容度.

