具有超高阳离子染料去除能力的磺酸功能化球形共价有机框架
颜艳红,吴锶敏,严逸伦,汤西豪,蔡松亮,郑盛润,章伟光,顾凤龙
(华南师范大学化学学院,环境理论化学教育部重点实验室,广州510006)
随着有机染料在工业上的广泛应用,大量染料废水的排放对环境和人类健康构成了严重威胁[1].这些染料通常有毒甚至致癌并难以降解,对热、光和氧化剂具有良好的稳定性,并在水中具有较高的溶解能力[2].通常,吸附被认为是一种简单、有效且无损的方法.到目前为止,活性炭、沸石、黏土等传统吸附剂发展得较成熟,但因其容量有限、吸附动力学和选择性差等缺点限制了它们的广泛应用[3].因此,探索具有快速吸附动力学和高吸附容量的新型吸附剂用于染料的去除具有重要的研究意义且富有挑战性.
共价有机框架(COFs)是一类由有机构筑单元通过共价键连接形成具有周期性的多孔晶态高分子聚合物.由于COFs具有密度低、稳定性好、比表面积高、易于功能化等特点,使它们可应用于气体存储分离[4]、化学传感[5]、色谱分离[6,7]、药物运输[8]和催化[9]等不同领域.近年来,COFs已被证实可作为吸附剂用于有机染料的去除[10~19].如一种掺入双吡啶鎓的聚阳离子COF,由于静电相互作用,对水中多种阴离子有机染料污染物呈现出高吸附能力[12].Loh等[11]设计合成了一种水杨醛缩苯胺类COF,通过改变溶剂发生可逆互变异构.并在尺寸排斥、选择性离子结合或官能团的基础上进行染料分离.Yan等[10]通过一锅法合成羧基功能化COF用于三苯甲烷染料吸附,其引入的羧基可与阳离子有机污染物发生强相互作用,能快速、高效地去除三苯基甲烷染料.研究发现,含磺酸基的改性材料,如纤维素[20]、复合材料[17,21]和金属有机框架[22],因为其静电相互作用位点,可以提高染料的吸附能力.因此,若在COFs框架结构中引入磺酸基,所得阴离子型COFs因其能与阳离子型染料发生较强的静电相互作用从而提高其吸附能力.
本文用三醛基间苯三酚(TFP)与2,2′-联苯胺二磺酸(BDSA)通过席夫碱反应制备了一种磺酸功能化的COF(TFP-BDSA),研究了其对亚甲基蓝(MLB)、结晶紫(CV)、罗丹明B(RhB)、甲基橙(MO)和荧光素钠(FS)的吸附能力,并对其吸附机理进行了探讨.
1 实验部分
1.1 试剂与仪器
三醛基间苯三酚(TFP)购于上海腾骞生物技术有限公司;2,2′-联苯胺二磺酸(BDSA)、亚甲基蓝(MLB)、结晶紫(CV)、罗丹明B(RhB)、甲基橙(MO)和荧光素钠(FS)购于阿拉丁试剂有限公司;N,N′-二甲基乙酰胺(DMAC)、N,N′-二甲基甲酰胺(DMF)、叔丁醇(BuOH)、四氢呋喃(THF)、甲醇和丙酮购自天津市致远化学试剂有限公司;以上试剂均为分析纯.
UltimaⅣ型X射线粉末衍射仪(PXRD,日本Rigaku公司);Spectrum Two型傅里叶变换红外光谱仪(FTIR,美国Perkin-Elmer公司);STA 409型热重分析仪(德国耐驰公司);ZEISS Gemini 500型扫描电子显微镜(德国Zeiss公司);UV-2700型紫外-可见分光光度计(UV-Vis,日本岛津公司);ASAP 2460型比表面积仪(美国麦克公司);Zetasizer Nano ZS90型电位分析仪(英国Malvern公司).
1.2 TFP-BDSA的合成
将TFP(8.4 mg,0.04 mmol)和BDSA(20.6 mg,0.06 mmol))置于反应瓶中,加入0.1 mL DMAC和0.9 mL BuOH后超声10 min使其分散均匀,然后加入0.1 mL 6 mol/L乙酸溶液.对混合物进行冷冻-脱气-解冻循环3次后置于120 °C恒温烘箱内反应72 h,取出反应管冷却至室温后过滤,依次用DMF、THF和丙酮洗涤,真空干燥后得到TFP-BDSA红色固体粉末(产率为72%).
1.3 染料吸附分离实验
为了探究磺酸功能化COF对不同染料的吸附性能,选择阳离子型的MLB,CV,RhB及阴离子型的FS和MO作为研究对象.
将5 mg活化处理的TFP-BDSA粉末置于离心管中,加入10 mL 20 mg/L不同的染料水溶液进行吸附动力学实验.在给定时间收集2 mL上层清液并通过0.22μm水系滤膜进行UV-Vis吸光度测试,测试后立即倒回原始环境中.该方式同样可用于混合染料的分离测试,配制MLB/RhB,MLB/MO,RhB/MO,MLB/FS,CV/FS和MLB/CV/RhB/MO/FS的混合染料,将5 mg TFP-BDSA添加到10 mL混合染料溶液中.为了确定材料的最大吸附量,将3 mg COF分散在12 mL不同初始浓度的染料中,并置于黑暗环境于室温下搅拌48 h,离心收集上层清液,通过UV-Vis测试吸光度.
平衡吸附量的计算公式如下:

式中:V(L)是溶液的体积;c0,ct和ce(mg/L)分别为反应初始时刻、给定时刻(t)和反应平衡时染料溶液的浓度;m(g)是吸附剂质量;qt(mg/g)为反应t时刻的吸附量;qe(mg/g)为平衡时的吸附量.
2 结果与讨论
2.1 TFP-BDSA的表征
TFP-BDSA是由TFP和BDSA在溶剂热条件下发生缩合反应得到(Scheme 1).从图1(A)谱线c可见,2种单体的PXRD衍射峰完全消失,证实了两者发生缩合反应.所得产物在2θ=4.8°,6.8°,11.7°和24.5°处呈现出较弱的衍射峰,说明形成了具有一定结晶度的磺酸基功能化TFP-BDSA COF材料,这与无定形多孔聚合物不同[17].由于磺酸基团具有较大空间位阻和静电排斥作用,在一定程度上阻止了COF层与层之间有效的π-π堆积而导致结晶性偏低[23,24].为了进一步确定TFP-BDSA的晶体结构,利用Materials Studio软件模拟了几种结构模型[25](图S1,见本文支持信息).如图1(A)所示,所得实验的PXRD谱图与AA斜堆积模式较吻合.晶胞参数分别为a=2.764 nm,b=2.978 nm,c=0.655 nm;α=36.98°,β=91.29°和γ=118.79°(表S1,见本文支持信息).如图1(B)和1(C)所示,二维TFP-BDSA层与层之间的堆叠发生了位移,这种由于引入侧链基团而导致层与层之间堆积方式发生改变的现象与已报道的其它含侧链COFs中所观察到的现象相类似[26].
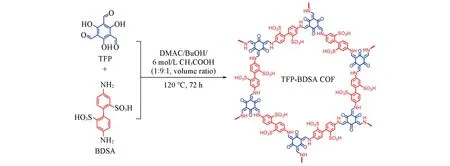
Scheme 1 Synthesis of TFP-BDSA COF

Fig.1 PXRD patterns of TFP(a),BDSA(b),TFP-BDSA(c)and TFP-BDSA with inclined structure(d)(A),top view(B)and side view(C)of the simulated inclined structure of TFP-BDSA
如图2(A)所示,与单体TFP和BDSA的红外光谱相比,TFP-BDSA在氨基(3200~3400 cm-1)和醛基(1644 cm-1)处的伸缩振动信号明显减弱,说明2种单体之间发生了席夫碱反应.同时,由于C=C(1598 cm-1)和C—N(1226 cm-1)伸缩振动特征峰的出现,表明在TFP-BDSA中形成了烯醇-酮互变异构结构.此外,1100和1043 cm-1处的信号峰可归属为—SO3H基团,这证实TFP-BDSA含有—SO3H功能基团[23,27].图2(B)的热重分析结果显示,TFP-BDSA在270℃左右仍表现出良好的稳定性.TFP-BDSA的Zeta电位分布图如图2(C)所示,说明该磺酸基功能化COF带负电,有利于与带正电荷的染料分子相互作用.SEM表征结果表明,TFP-BDSA呈尺寸较为均一的球形形貌[图2(D)],这与无定形TpBd-(SO3)2的形貌不同[17].
在77 K下测试了COF完全活化后的氮气吸附-脱附等温线,结果如图S2(A)所示(见本文支持信息),TFP-BDSA对氮气的吸附等温线属于Ⅳ型,表明了介孔结构的存在.TFP-BDSA的BET比表面积仅为12 m2/g,可能是由于COF结晶度低以及孔道被大量的磺酸基团占据所导致,这与已报道的功能化COFs相类似[8,28].比表面积小的COF材料也能表现出优良的吸附性能,如Li等[28]合成的酰胺基COF其比表面积仅为3.5 m2/g,但其对金属铅(Ⅱ)吸附容量达185.7 mg/g.此外,利用非局域密度泛函理论计算孔径分布,结果见本文支持信息图S2(B),TFP-BDSA的孔径分布主要集中在2.3 nm.同时,孔径分布图还含有9.4和37.2 nm处的弱峰,这可能是由于该球形COF聚集时产生的空隙所引起的.

Fig.2 FTIR spectra of TFP(a),BDSA(b)and TFP-BDSA(c)(A),TGA curve(B),zeta potential(C)and SEM image(D)of TFP-BDSA
2.2 TFP-BDSA对染料的吸附和分离
为了更好研究TFP-BDSA的吸附性能,选用具有不同电荷和尺寸大小的有机染料,即带正电的MLB,CV,RhB和带负电的FS,MO,如表S2(见支持信息)所示.
时刻t(min)时的染料去除效率(Removal efficiency,RE,%)可以使用以下式计算:

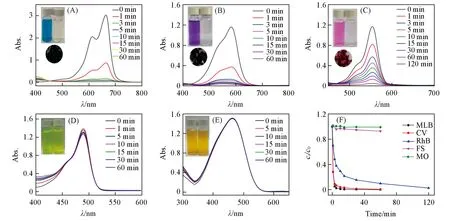
Fig.3 UV-Vis spectra of MLB(A),CV(B),RhB(C),FS(D),MO(E)and dye adsorption as a function of time by TFP-BDSA(F)in aqueous solutions at different times during the adsorption process with TFP-BDSA as the host
如图3所示,所有带正电荷的染料均能被TFP-BDSA COF迅速吸附.其中MLB和CV在10 min内去除率高达98.8%和96.0%[图3(A)和(B)].吸附前后染料溶液颜色的变化[图3(A)和(B)的插图]也表明这些染料几乎被吸附完全.而分子空间尺寸较大的RhB,在120 min后去除率为97.3%[图3(C)].这些结果表明TFP-BDSA COF可有效去除水中的阳离子染料.对比图3(F)和表S2,阳离子染料MLB,CV和RhB的去除率在相同条件(60 min)下分别为99.9%,99.4%和90.2%,去除率随着染料尺寸的增大而减小,说明对染料具有尺寸效应[29,30].而对于阴离子染料,MO和FS的去除率仅有0.9%和7.2%[图3(D)和(E)].可能是MO的静电排斥作用使其难以被吸附,而FS仍有7.2%被吸附则可能是其共轭结构和更多的氧原子使TFP-BDSA与FS分子之间存在较强的氢键和π-π堆积作用.
通过单组分染料吸附实验中阴阳离子染料显著性差异,多组分吸附实验进一步验证了阳离子染料的选择性吸附.结果如图4所示,MLB/RhB的混合溶液在第10 min从蓝色变为浅红色,相应吸收强度变化更为明显,MLB有关的吸收峰强度急剧下降,与RhB有关的吸收峰强度呈缓慢下降趋势.经过较长时间,RhB被进一步吸附,60 min后仍未去除完全[图4(A)],同时也验证尺寸选择性差异.对于MLB/MO和RhB/MO混合染料[见图4(B)和本文支持信息图S3(A)],MLB和RhB可以被吸附,而MO几乎未被吸附.对于MLB/FS和CV/FS混合染料[见图4(C)和本文支持信息图4(C)和图S3(B)],FS吸收强度明显降低,可能是由于阴阳离子染料吸引聚集发生共吸附[31],但TFP-BDSA框架与FS分子之间强的静电排斥作用导致最终只有少量的FS被吸附.溶液的颜色也从混合后的绿色和褐色变为FS自身的荧光黄色[见图4(B)和(C)].通常,实际的水污染中是会同时存在多种染料,故将上述染料混合在一起,加入TFP-BDSA粉末进行吸附实验.显然MLB/CV/RhB/FS/MO混合染料的颜色从暗绿蓝色变为橙色[见图4(D)插图].在UV-Vis光谱中,MLB,CV和RhB所属的吸收峰强度明显下降,并且在90 min后MLB和CV吸收峰几乎消失.而FS和MO的吸收峰强度则变化不大[图4(D)].由此说明不仅能从水溶液中去除污染物染料,而且还可实现不同类型染料的有效分离.
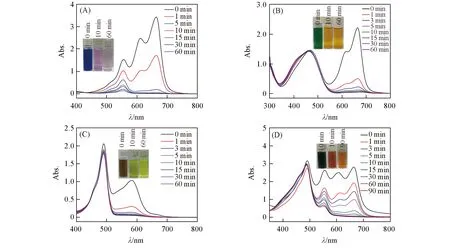
Fig.4 UV-Vis spectra of the mixed dye aqueous solution containing MLB/RhB(A),MLB/MO(B),CV/FS(C)and MLB/CV/RhB/MO/FS(D)at given times during the adsorption process with TFP-BDSA as the adsorbent
2.3 吸附等温线和动力学
吸附过程的动力学研究可以用于评估吸附剂吸附溶质的速率快慢,通过动力学模型对实验数据进行拟合,从而探讨其吸附机理.本文通过拟一级和拟二级方程研究了所有阳离子染料的吸附动力学数据(见本文支持信息表S3).结果见表1、表S4、图S4和图S5(本文支持信息),所有的阳离子染料的相关系数(R2)皆高于0.999,并且理论与实验平衡吸附容量相当,表明数据与拟二级方程具有更好的一致性,说明染料吸附过程受化学吸附的控制,这种吸附涉及电子共享或电子的得失[32].k2是拟二级吸附的速率常数,可用来评估吸附剂吸附溶质的速率快慢,速率常数的大小顺序为k2(MLB)>k2(CV)>k2(RhB).这里,MLB和CV具有较小的分子和较低的分子量可以以较小的传质阻力更快地移动使其更快被吸附[33].尽管RhB吸附速率不及尺寸较小的染料快,但仍显示出其良好的吸附能力.

Table 1 Kinetic parameters of the Pseudo-second-order model for MLB,CV and RhB adsorption on TFP-BDSA
为了进一步考察TFP-BDSA的染料吸附能力,使用不同初始浓度的染料进行吸附实验,得到如图5(A)所示的吸附等温线.采用Langmuir,Freundlich和Themkin 3种方程来拟合实验数据[30],结果如表S3所示.拟合结果的详细信息见本文支持信息表S5和图S6,MLB,CV和RhB在TFP-BDSA上的吸附最符合Langmuir等温模型,相关系数R2的值分别为0.99582,0.99776和0.98909,表明MLB,CV和RhB的吸附属于单分子层吸附.实验结果表明,TFP-BDSA对MLB,CV和RhB的最大吸附容量分别高达1116,1429和1638 mg/g[图5(A)].与其它已报道的COFs材料相比(表2),TFP-BDSA对CV和RhB的吸附能力是迄今最高的.

Fig.5 Adsorption isotherms(A)and Langmuir isotherms(B)of MLB,CV and RhB on TFP-BDSA
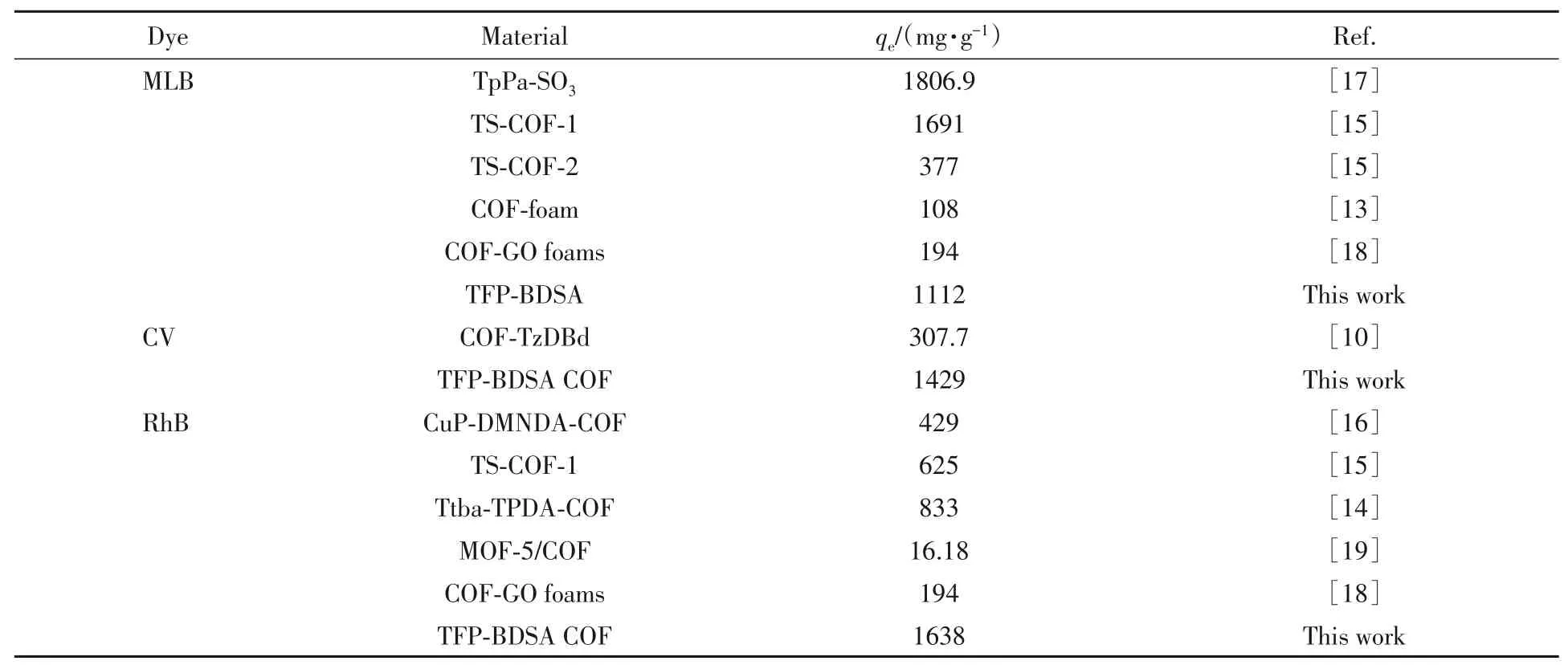
Table 2 Comparison of MLB,CV and RhB adsorption capacity in different crystalline COFs
2.4 吸附机理
阐明吸附机理至关重要,通过合理设计和功能化以增强主体框架与客体分子相互作用来提高对染料分子的捕获和分离性能[10~12].如图6(A)所示,对于TFP-BDSA@MLB,归属于MLB的1398和1339 cm-1特征峰在被吸附后蓝移至1391和1333 cm-1,表明COF与有机染料之间存在π-π堆积等作用[33].而吸附CV后,TFP-BDSA@CV上出现了来自于CV的1635和1169 cm-1处的特征峰[图6(B)],吸附RhB后,TFP-BDSA@RhB上出现了归属于RhB的1412,1338,1238和1179 cm-1特征峰[图6(C)],也表明TFP-BDSA成功捕获了目标染料分子[30,33].TFP-BDSA@dye在1297 cm-1(苯环骨架)和1226 cm-1(C—N键)处的特征峰发生改变,是由于COF框架与染料分子相互作用引起的[33].此外,TFP-BDSA中1200~1000 cm-1范围内的特征峰(—SO3H基团)在吸附染料后中变宽变弱,表明COF框架中的磺酸根与染料之间发生静电等作用.
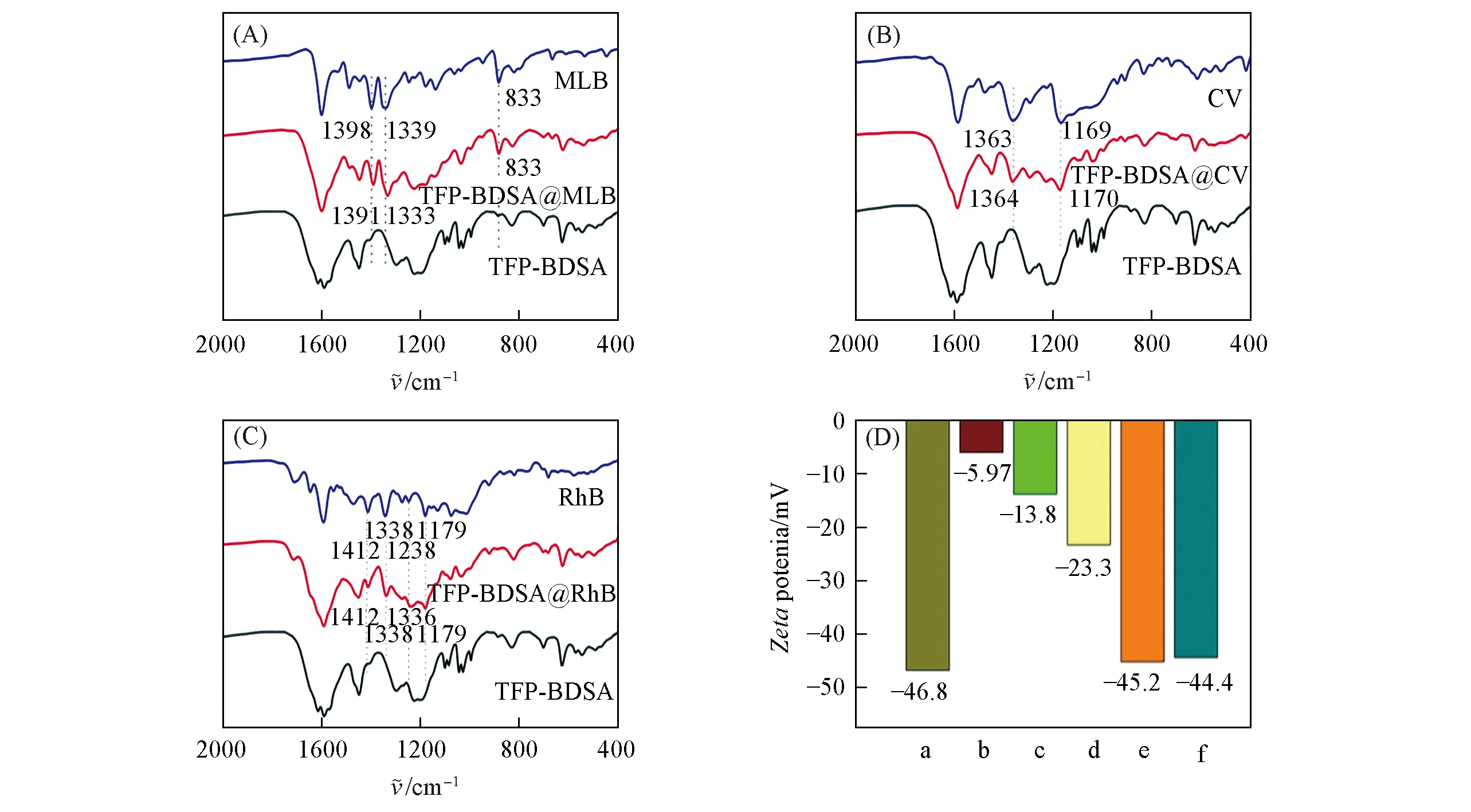
Fig.6 FTIR spectra of dyes,TFP-BDSA before and after adsorption of MLB(A),CV(B)and RhB(C),zeta potential of TFP-BDSA before and after adsorption of different dyes(D)
如图6(D)所示,TFP-BDSA在染料吸附之前具有较高的负zeta电位(-46.8 mV),表明其更倾向于吸附阳离子染料.同时,TFP-BDSA孔径约为2.3 nm,可以让目标染料进入骨架并与孔壁上的磺酸基相互作用.随后测试了TFP-BDSA@dye的电位,吸附阳离子型染料后COF的zeta电位明显增加而吸附阴离子型染料后电位无明显变化,进一步说明COF材料和阳离子染料之间存在较强的静电作用.同时Zeta电位仍为负值,证明存在离子交换过程[32].以上结果表明,TFP-BDSA对阳离子染料的吸附是由静电作用、π-π堆积作用和离子交换等多种因素共同作用的结果[10~12,17],而对阴离子染料的吸附则会受到静电排斥力的影响.因此,TFP-BDSA对阴离子、阳离子染料的吸附动力学和容量有明显差异,这可以促进不同电性染料的分离.
2.5 解吸附和循环实验
吸附材料的可重复使用性对实现其工业应用具有重要意义,因此,还探究了TFP-BDSA对不同阳离子型染料的吸附-解吸循环实验.将负载有染料的TFP-BDSA在5 mL含HCl(质量分数为0.1%)饱和氯化钠乙醇溶液中搅拌直至染料完全释放,然后离心收集粉末,使用甲醇进行活化、真空干燥后再次进行染料吸附.如图S7(见本文支持信息)所示,TFP-BDSA对3种不同的阳离子型染料MLB,CV和RhB的吸附表现出良好的可重复性,重复使用3次后其去除率仍保持90%以上.
3 结 论
通过溶剂热法合成了一种磺酸基功能化球形TFP-BDSA COF材料.用制备的TFP-BDSA COF可作为吸附剂用于水中染料的去除.实验结果表明,该材料能选择性吸附和分离阳离子染料.制备的TFP-BDSA对染料分子MLB,CV和RhB表现出优异的吸附能力,其最大吸附容量分别高达为1116,1429和1638 mg/g,表明磺酸功能化COFs材料能高效地去除目标污染物,是一类有巨大潜力的吸附材料.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200443.

