不同催化体系下制备四氧化三锰的实验研究
黄文杰,毛耀清,冯树兵,张 敬,木宗云,刘维荣,银 瑰
(湖南特种金属材料有限责任公司,湖南 长沙 410013)
0 前 言
四氧化三锰(Mn3O4)是生产软磁铁氧体材料和微波铁氧体材料的主要原料,在电子、电器、电力等工业部门中有着广泛的用途。目前市场上销售的四氧化三锰90%都是以电解锰片为原料,通过悬浮氧化法(湿法)制备。
在湿法制备四氧化三锰的过程中,催化剂一般有两类,一类是铵盐,也是目前工业化生产中用得最为广泛的,另一类为酸[1]。但无论使用哪种催化剂,金属锰的氧化过程都分为以下3个反应[2]。
Mn→Mn2+
(1)
Mn2+→Mn(OH)2
(2)
Mn(OH)2→Mn3O4
(3)
四氧化三锰的总反应速率与上述3个反应速率密不可分。当单独使用酸做催化剂时,反应(1)速率比较快,但是整个反应均在pH=6的条件下进行,使得反应(2)速率比较慢。当单独使用铵盐做催化剂时,虽然反应(1)比较慢,但是反应(2)因PH值较高而比用酸时快得多。本实验采用电解锰片为原料,对比了采用铵盐、盐酸、盐酸+铵盐三种催化体系制备的四氧化三锰的粒度、反应周期、收率以及生产成本,旨在为工业生产提供技术支持。
1 实验及结果分析
实验采用广西中信大锰生产的电解锰片为原料,原料成分见表1。将锰片采用高锰低铬磨球磨碎后,过-0.075 mm(-200目)筛网,单次实验均取原料200 g,反应釜采用水浴加热,反应过程水温稳定在75℃。为使得不同体催化系制备的四氧化三锰在物理化学性能指标上具有可比性,制备的产品比表面积都控制在5~6 m2/cm3,不同催化体系的催化剂用量如表2,其中盐酸为分析纯,浓度30%。

表1 电解锰片元素含量

表2 催化剂用量
图1为不同催化反应体系下制备四氧化三锰的到位时间,从图中可以看出采用NH4Cl+HCl作为催化剂时反应到位时间最短,只需要12.5 h,采用HCl作为催化剂时反应到位时间最长,达到16.7 h,采用NH4Cl作为催化剂时反应到位时间介于前面两者之间,为14.2 h。

图1 不同催化体系反应到位时间
采用HCl作为催化剂时,虽然H+与锰片产生化学反应会立即消耗完,变为MnCl2,但随着Mn2+离子的氧化沉淀,重新生成的H+继续与锰片产生反应,整个反应的速度取决于Mn2+离子的氧化沉淀速度,因体系中没有NH4+与Mn2+离子形成络合离子,锰离子的氧化速度较慢,使得整个反应进程较慢。采用NH4Cl+HCl或者NH4Cl作为催化剂时,因NH4+离子的存在使得Mn2+离子的氧化速度得到较大提高,使得整个反应过程缩短。采用NH4Cl+HCl时因Cl-离子浓度较高,因此Mn→Mn2+的氧化速度较快,因此单一采用NH4Cl催化体系的反应时间比NH4Cl+HCl催化体系要长。
图2为3种催化反应体系下制备四氧化三锰的升温速度曲线。
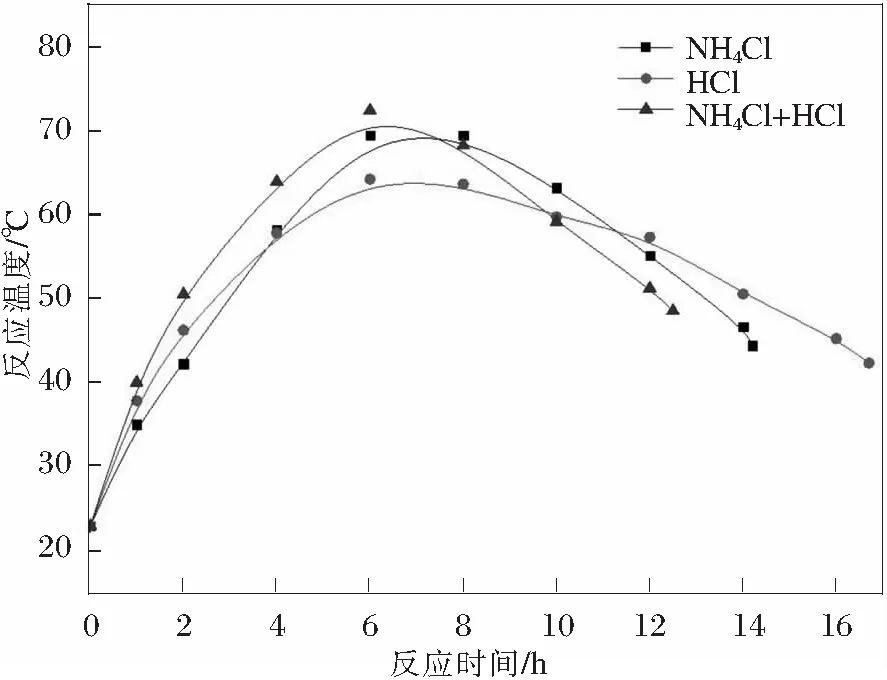
图2 不同催化体系升温过程
从图中可以看出采用NH4Cl+HCl作为催化剂时温度上升最快,在6 h时达到最高温度72.5℃,随后快速下降直到反应完全。主要因为前期反应较快,在达到最高温度后,后续未氧化锰浆较少,因此温度下降较快。采用HCl作为催化剂时其升温速度有所降低,在第6 h达到最高温度64.3℃后缓慢下降,因反应过程较慢,在后期还有较多锰浆继续进行氧化放热反应,因此使得整个反应体系温度下降比较缓和。采用NH4Cl作为催化剂时其初始的升温速度最慢,主要是因为NH4Cl催化反应过程中溶液呈弱碱性(其他两种催化剂在反应过程中溶液呈中性或若酸性),Mn→Mn2+在碱性环境下进行的较慢,导致初始阶段反应较为温和,最高温度为69.5℃。因Mn2+→Mn3O4的反应较快,所以反应过程较HCl体系时间缩短,降温速度介于另外两种催化体系之间。
3种不同催化体系制备的四氧化三锰浆料经抽滤后,在烘箱100℃烘干后检测所含杂质元素,包括C、S、Mg、Ca、Cl,含量如表3所示,同时检测其粒度分布情况。从表3可以看出C、S元素的含量都基本相当,可以认为不同催化体系对这两种元素的含量没有明显影响。但是对Mg和Ca元素的含量有影响较大,当采用氯化铵体系时Mg和Ca含量均为最高,分别为62×10-6、23×10-6,采用盐酸催化体系时Mg、Ca含量最低,分别为27×10-6、12×10-6,采用氯化铵+盐酸催化体系时Mg、Ca含量处于两者之间,分别为38×10-6、15×10-6。主要是因为当采用氯化铵体系时,反应过程呈碱性,pH值大约在9左右,碱性体系使得溶于母液中的钙镁离子大量沉淀从而进入产品中,且后端无法分离,因此使得钙镁杂质含量均较高。当采用盐酸体系时,反应过程溶液基本呈中性,钙镁离子难以沉淀,因此产品中杂质含量较低。采用氯化铵+盐酸催化体系时,溶液pH值介于上述两种体系之间,因此产品中的钙镁杂质含量也处于两者之间。而产品中Cl根的含量依次为氯化铵体系<盐酸体系<氯化铵+盐酸体系,基本与催化剂中Cl根的含量成正比。

表3 杂质含量
表4为3种反应体系制备的四氧化三锰粒度分布结果。从表可看出采用盐酸体系时产品的粒度最细,D10、D50、D90分别为0.87,2.56,8.44 μm,图3为3种不同催化剂体系下四氧化三锰产品的SEM形貌,从图中可看出HCl催化体系得到的产品颗粒最粗,NH4Cl+HCl催化体系的产品颗粒最细,NH4Cl体产品粒度居于前面两者之间。这和前面表4的粒度分析结果完全一致。上述粒度分布特征和不同催化体系的反应速度有很大关系。采用HCl作催化剂时,由于反应时间过长,四氧化三锰晶核形成以后在不断的长大,使得最终产品粒度最粗。NH4Cl+HCl作催化剂,由于反应最剧烈,形成的晶核较多,且长大时间有限,使得制备的产品粒度最细。采用NH4Cl体系时反应速度和反应剧烈程度处于另外两种之间,最终产品的粒度分布也是如此。

表4 产品粒度对比

(a) HCl体系;(b) NH4Cl体系;(c) NH4Cl+HCl体系图3 不同催化体系产品的SEM图片
表5为不同催化体系下母液中Mn元素的含量对比表,从图中可以看出氯化铵体系的母液中Mn含量最低,只有421×10-6,盐酸体系和盐酸+氯化铵体系的母液中Mn含量都很高,分别达到了1 390×10-6、1 170×10-6,说明Mn的损失较大,主要原因有两点,一是含盐酸的两种体系在反应过程中溶液几乎呈中性,锰离子溶解度较大,难以沉淀;二是盐酸与锰反应放出H2后生成MnCl2,需消耗部分金属锰浆,因此会导致母液中的二价锰离子含量较高。而氯化铵体系则不存在上述问题,因此Mn的收率最高,有利于降低生产成本。

表5 母液中锰含量
对于上述3种不同催化体系制备的四氧化三锰均能满足锰锌铁氧体要求,但制备的生产成本有所差别。采用HCl作催化剂时不仅反应时间长,消耗的盐酸成本高,而且反应后母液中存留的Mn离子含量最高,产品收率最低,生产成本最高。采用NH4Cl+HCl体系时因反应时间最短,所以电耗最低,但复合催化剂的成本较高,且母液中Mn离子含量高,收率较低。采用NH4Cl体系时,电耗居于前两者之间,但催化剂成本最低,且母液中Mn离子含量最低,产品的收率最高。在工业生产过程中,到底哪种催化体系生产成本最低,需综合考虑生产的电耗、催化剂成本、锰的损失以及电解锰片价格等诸多因素。
2 结 论
1)采用盐酸催化体系时,反应时间最长,四氧化三锰产品粒度最粗,且原料收率最低,生产成本最高,但Ca、Mg离子进入产品最少;
2)采用氯化铵催化体系时,反应时间较长,产品粒度较细,但原料的收率最高,产品Cl根最少;
3)采用盐酸+铵盐联合催化体系时,反应时间最短,粒度最细,但原料收得率偏低,且产品Cl根最高。

