血清胃泌素-17、胃蛋白酶原、肿瘤标志物及幽门螺杆菌感染与胃癌的相关性分析
张芳芳
胃癌是临床常见的恶性肿瘤之一,我国胃癌病死率占恶性肿瘤死因的第3位,且发病率呈逐年上升趋势[1]。尽管胃癌的治疗手段不断提高,但晚期胃癌患者的临床疗效仍不理想,五年生存率较低[2]。因此,早期发现对于胃癌的临床治疗具有重要意义。目前,胃镜检查和上消化道造影检查是临床用于诊断胃癌的普遍方法,但是这两种检查方法均需要专业的设备和技术人员,检查繁琐、费用高,且患者有一定的排斥感[3]。肿瘤标志物癌胚抗原(CEA)及糖抗原 19-9(CA19-9)是胃癌常用的肿瘤标记物,但特异性均不强[4];研究证实,血清胃泌素-17、胃蛋白酶原可用于胃癌的早期筛查[5];幽门螺杆菌感染与胃癌的发生关系密切,其是胃癌发生发展的重要因素[6]。因此,本研究旨在探讨血清胃泌素-17、胃蛋白酶原、肿瘤标志物及幽门螺杆菌感染与胃癌的相关性,以期为胃癌的早期诊断提供一定的参考。
1 资料与方法
1.1 一般资料 收集浙江省余姚市人民医院2018 年10 月到2019 年10 月收治的197 例胃癌患者和142 例胃炎患者,胃癌患者均经组织病理学检查确诊,胃炎患者均经临床检查确诊,入组患者于采集血液标本前一周未接受任何临床药物治疗,且无胃部手术史。胃癌患者中男114 例,女83 例;年龄37 ~72 岁,平均(58.3±11.6)岁;TNM 分期Ⅰ期23例,Ⅱ期69 例,Ⅲ期72 例,Ⅳ期33 例。胃炎患者中男87 例,女55 例;年龄35~71 岁,平均(57.1±8.3)岁;包括非萎缩性胃炎83 例,萎缩性胃炎59 例。另同期选取健康体检者96 例为对照组,男57例,女性39 例;年龄35 ~71 岁,平均(56.9±9.2)岁。本研究得到本院伦理学会批准,且入选者知情同意。
1.2 方法 采集各组晨起空腹静脉血5ml,室温静置30min,以3000r/min离心20min,提取血清,置于-80℃冰箱中保存待检,整个过程避免溶血。采用酶联免疫吸附法检测各组血清样本中胃泌素-17 和胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ水平,试剂盒均购自芬兰BIOHIT 公司;采用酶免疫微粒子分析法检测CEA 及CA19-9 水平,试剂盒购自美国Abbott 公司;采用14C 尿素呼吸试验检测各组的幽门螺杆菌感染情况。
1.3 统计方法 采用SPSS 22.00 软件软件进行分析,计量资料以均数±标准差表示,采用t检验;计数资料采用2检验;危险因素分析采用多元Logistic 回归模型。P <0.05 为差异有统计学意义。
2 结果
2.1 各组血清胃泌素-17、胃蛋白酶原及肿瘤标志物水平比较 胃癌组血清胃泌素-17、CEA、CA19-9 水平显著高于非萎缩性胃炎组、萎缩性胃炎组、对照组(均P<0.05),胃蛋白酶原Ⅰ、胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ水平显著低于非萎缩性胃炎组、萎缩性胃炎组、对照组(均P <0.05),胃蛋白酶原Ⅱ水平显著低于萎缩性胃炎组(P <0.05)。萎缩性胃炎组血清胃泌素-17、胃蛋白酶原Ⅱ水平显著高于对照组(均P<0.05),胃蛋白酶原Ⅰ、胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ水平显著低于对照组(均P <0.05)。非萎缩性胃炎组血清胃蛋白酶原Ⅰ水平显著低于对照组(P <0.05),见表1。
2.2 各组幽门螺杆菌感染情况比较对照组幽门螺杆菌抗体阳性率为19.79%(19/96),非萎缩性胃炎组阳性率为40.93%(34/83),萎缩性胃炎组阳性率为86.44%(51/59),胃 癌 组 阳 性 率 为 84.77%(167/197),胃癌组幽门螺杆菌感染阳性率显著高于对照组和非萎缩性胃炎组(2=7.87、8.96,P<0.05),与萎缩性胃炎组相比无显著性差异(2=0.012,P >0.05)。
2.3 胃癌幽门螺杆菌感染阳性者和阴性者血清胃泌素-17、胃蛋白酶原及肿瘤标志物水平比较 胃癌幽门螺杆菌阳性组血清胃泌素-17、胃蛋白酶原Ⅰ、胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ、CEA 及CA19-9 水平显著高于阴性组(均P <0.05),胃蛋白酶原Ⅱ显著低于胃癌幽门螺杆菌阴性组(P <0.05),见表2。
2.4 不同胃癌分期患者血清胃泌素-17、胃蛋白酶原、肿瘤标志物及幽门螺杆菌感染阳性率的比较 胃癌临床分期越高,血清胃泌素-17、CEA、CA19-9 水平越高,胃蛋白酶原Ⅰ水平越低(均P<0.05),但胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ、幽门螺杆菌阳性率在不同胃癌分期患者中差异均无统计学意义(均P >0.05),见表3。
2.5 多元Logistic 回归模型分析胃癌的独立危险因素 多元Logistic 回归模型分析结果显示,胃泌素-17、胃蛋白酶原Ⅰ及幽门螺杆菌阳性是胃癌的独立危险因素(均P <0.05),见表4。
3 讨论
本研究结果表明血清胃泌素-17、肿瘤标志物水平升高、胃蛋白酶原水平降低及幽门螺杆菌感染与胃癌的发生及分期有一定关系,而非萎缩性胃炎与萎缩性胃炎上述指标仅存在些微差异。同时胃癌临床分期越高,血清胃泌素-17、胃蛋白酶原Ⅰ水平越低,血清 CEA、CA19-9 水平越高(均P<0.05),但胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ及幽门螺杆菌阳性率在不同胃癌分期患者中差异无统计学意义(P >0.05),这可能是由于肿瘤细胞浸润破坏B淋巴细胞导致胃酸分泌减少,进而反馈性引起胃泌素-17 分泌增加[7]。多元Logistic 回归模型分析结果显示,胃泌素-17、胃蛋白酶原Ⅰ及幽门螺杆菌阳性是胃癌的独立危险因素(均P <0.05)。研究发现,进展期胃癌患者可能因胃蛋白酶原Ⅰ基因受损突变增加,而引起胃蛋白酶原Ⅰ水平明显降低[8];非萎缩性胃炎发展为萎缩性胃炎在发展为胃癌过程中,胃泌素的水平逐渐升高,高水平的胃泌素-17 是预测胃癌发生的危险因素[9];幽门螺杆菌感染是导致胃癌的重要因素。与本研究结果相符,这表明高水平的胃泌素-17、低水平的胃蛋白酶原Ⅰ及幽门螺杆菌阳性感染可提升胃癌的发生风险。
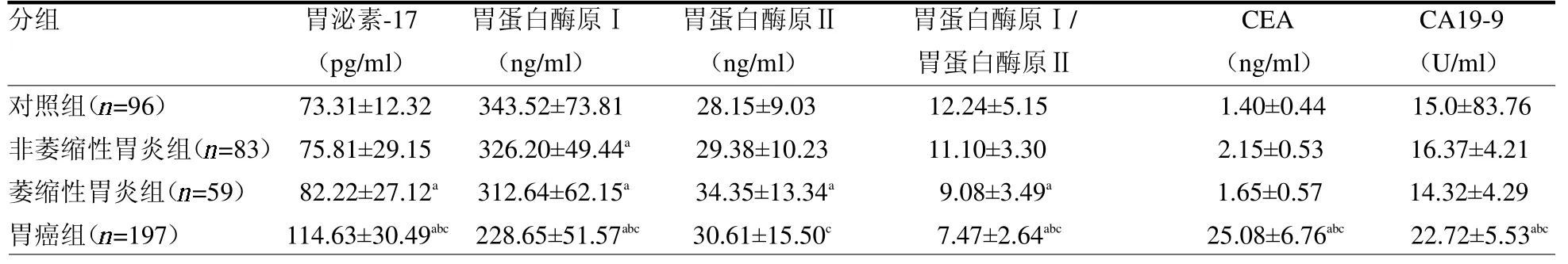
表1 各组血清胃泌素-17、胃蛋白酶原及肿瘤标志物水平比较
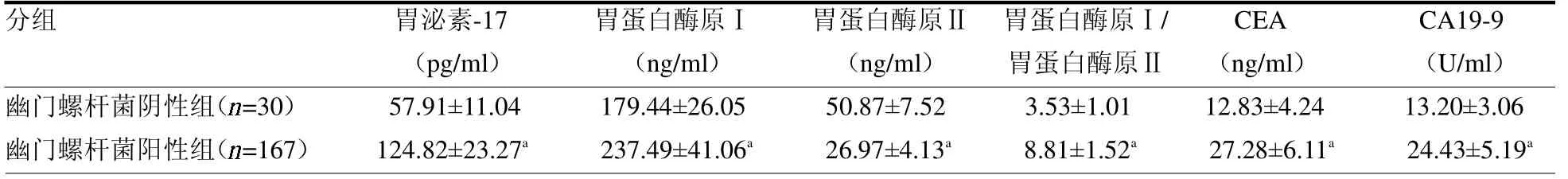
表2 胃癌幽门螺杆菌感染阳性者和阴性者血清胃泌素-17、胃蛋白酶原及肿瘤标志物水平比较
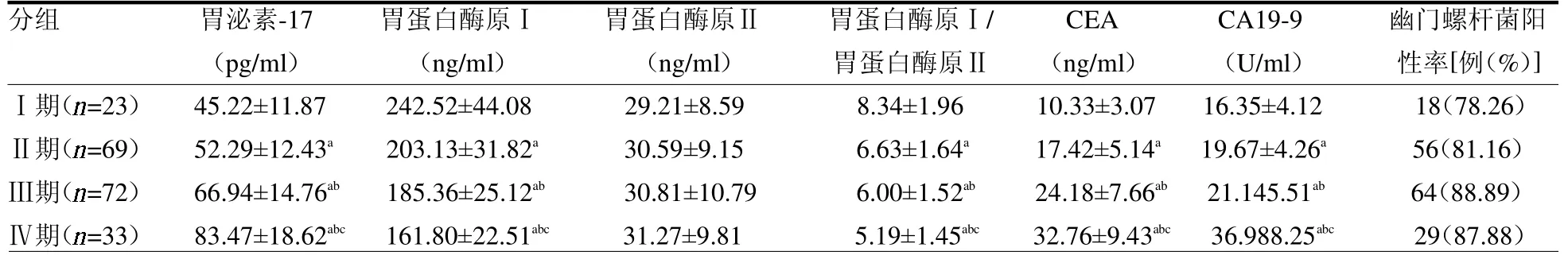
表3 不同胃癌分期患者血清胃泌素-17、胃蛋白酶原、肿瘤标志物及幽门螺杆菌感染阳性率的比较
综上所述,血清胃泌素-17、肿瘤标志物水平升高、胃蛋白酶原水平降低及幽门螺杆菌感染与胃癌的发生及分期有一定关系,其中高水平的胃泌素-17、低水平的胃蛋白酶原Ⅰ及幽门螺杆菌阳性感染可提示胃癌风险。

表4 Logistic 回归模型分析

