生物免疫疗法联合放疗对小细胞肺癌患者肿瘤标志物及T淋巴细胞亚群水平的影响
李龙,郑振东,刘渤娜,高霄丽,芦洪波
小细胞肺癌是特殊类型肺癌,占所有肺癌类型20%左右,其病情发展速度快且易发生转移。临床上治疗小细胞肺癌方法以手术、放疗及化疗为主[1-2]。化学治疗及放射治疗受小细胞肺癌独特生物学行为影响,近期治疗效果较好,但容易复发及转移,且由于患者过度接受放化疗使其机体免疫能力下降,加速死亡[3]。近年来,生物免疫疗法越来越多应用于临床治疗,通过提取患者血清单核细胞,经相关技术进行体外培养,获得具有识别和杀灭肿瘤功能的细胞,通过静脉注射进行回输,达到更好的治疗效果,同时还可激发机体产生抗肿瘤免疫反应,对肿瘤复发可以进行有效免疫监控[4-6]。现观察生物免疫疗法联合放疗对SCLC患者的治疗效果及对T淋巴细胞亚群的影响,报道如下。
1 资料与方法
1.1 临床资料 选取2018年12月—2019年12月北部战区总医院肿瘤科治疗小细胞肺癌患者62例,根据随机数字表法分为放疗组、联合治疗组(联合组),每组31例。放疗组男17例,女14例,年龄44~57(50.5±5.2)岁;病程2~8 (5.1±2.5)个月;TNM分期:Ⅰ~Ⅱ期7例,Ⅲ期12例,Ⅳ期12例。联合组男13例,女18例,年龄47~63(55.0±6.4)岁;病程3~8 (5.5±2.1)个月;TNM分期:Ⅰ~Ⅱ期5例,Ⅲ期14例,Ⅳ期12例。2组患者性别、年龄、病程、分期比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,患者及家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:经影像学、细胞学检查确诊为小细胞肺癌患者,且首次接受治疗。(2)排除标准:①病例资料不全患者;②患有先天性疾病;③精神疾病患者;④合并心脑血管、肝肾等原发性疾病。
1.3 治疗方法 放疗组:放射前对患者采用CMS治疗计划系统进行CT定位,以Varian2100C/D直线加速器6MV-X射线对肺部原发病灶、肺门及纵隔采用胸部照射野,剂量DT=40 Gy/20次,每次2 Gy,1次/d,1周5次;4周后局部加量,追加DT 10~30 Gy 1~3周,总量DT为50~70 Gy。锁骨淋巴结转移照射6周,DT=60 Gy。联合组:在放疗组治疗基础上联合生物免疫疗法,放疗结束后,对患者采用多种细胞因子诱导的杀伤细胞(CIK)生物免疫法。采取静脉血50 ml,分离单核细胞,0.9%氯化钠洗涤3次。使用RPMI1640培养基密度调节为2×106/ml,于第1天加入2 000 U/ml重组干扰素,常温环境下进行培养。第2天加入浓度为1 000 U/ml白介素2及5μg/ml抗CD3单抗。每3天更换营养液,补充白介素,测定单个核细胞。用自体血清培养皿培养后,收集CIK,洗涤后加入5%人白蛋白、白介素2。静脉滴注定容250 ml氯化钠溶液,每次回输细胞109个,每次间隔1 d,3次为1个疗程。回输前均进行无菌检测,达标后回输。
1.4 治疗效果评价标准[7]CR:肿瘤组织完全消失;PR:肿瘤直径缩小50%;SD:肿瘤组织得到一定的缩减但没有达到部分缓解的程度,或有一定的增加且增加不明显;PD:肿瘤组织增长25%或出现新肿瘤组织。总有效率=(CR+PR)/总例数×100%。
1.5 观察指标与方法
1.5.1 血清细胞角蛋白19片段抗原(CYFRA21-1)、癌胚抗原(CEA)水平测定:采用免疫透射比浊法检测,治疗前后抽取患者空腹肘静脉血6 ml,离心分离上层血清,-70℃环境中保存待检。标记3个试管为空白管、测定管和标准管,分别加入蒸馏水、血清、 LIF标准液各25 μl,均加入缓冲液350 μl并摇晃均匀,常温下静置5~10 min,随后使用SR-722型分光光度计(上海舍岩仪器有限公司生产)对其进行比色,在500 nm波长处以空白管凋零为准,记录吸光度,计算血清CYFRA21-1、CEA水平[8]。
1.5.2 血清VEGFR1、VEGFR2、VEGFR3水平检测: 治疗前后分别抽取患者清晨空腹肘静脉血4 ml,采用酶联免疫吸附法对VEGFR1、VEGFR2、VEGFR3水平进行检测。
1.5.3 T淋巴细胞亚群水平检测:对待测标本做抗凝处理,分为2管,分别加入CD8+、CD4+、CD3+单克隆抗体20 μl,室温环境下孵育30 min后在各管中加入溶血剂,待其完全溶血后进行离心处理, 弃上清液,使用洗涤液对其进行洗涤后在各管中加入固定剂150 μl,使用0.5 ml PBS混合均匀制备为悬液,使用流式细胞仪检测T细胞亚群CD4+、CD25+水平。
1.5.4 不良反应发生情况:对治疗过程中出现的白细胞减少、食管炎、骨髓抑制等不良反应进行统计比较。

2 结 果
2.1 2组治疗效果比较 联合组患者治疗总有效率为80.65%,高于放疗组的54.84%,差异有统计学意义(P<0.05),见表1。
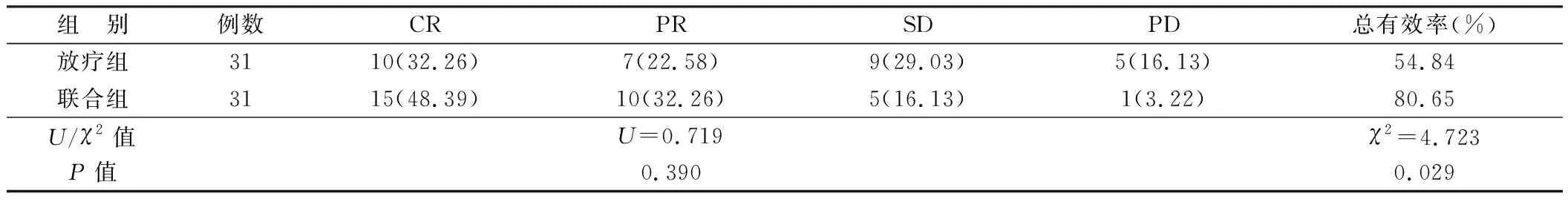
表1 2组患者治疗效果比较 [例(%)]
2.2 2组治疗前后血清CYFRA21-1、CEA水平比较 治疗前2组血清CYFRA21-1、CEA水平比较,差异无统计学意义(P>0.05);疗程结束后,2组血清CYFRA21-1、CEA水平均降低,且联合组低于放疗组(P<0.01),见表2。

表2 2组患者治疗前后血清CYFRA21-1、CEA水平比较
2.3 2组治疗后血清VEGFR水平比较 治疗前,2组血清VEGFR水平比较,差异无统计学意义(P>0.05);疗程结束后,2组血清VEGFR水平均降低,且联合组低于放疗组(P<0.01),见表3。

表3 2组患者治疗前后血清VEGFR1、VEGFR2、VEGFR3水平比较
2.4 2组治疗前后血清T淋巴细胞亚群水平比较 治疗前,2组T淋巴细胞亚群水平比较,差异无统计学意义(P>0.05);疗程结束后,2组CD4+水平升高,CD8+水平降低,且联合组升高/降低较放疗组更明显(P<0.01),见表4。

表4 2组患者治疗前后血清CD4+、CD8+水平比较
2.5 2组不良反应发生率比较 放疗组患者不良反应率为35.48%,高于联合组的12.90%,差异有统计学意义(χ2=4.039,P=0.037),见表5。

表5 2组不良反应发生情况比较 [例(%)]
3 讨 论
小细胞肺癌是一种起源于支气管黏膜或腺体的一种恶性肿瘤,小细胞肺癌的胞质具有神经分泌颗粒,其能够分泌激肽、组胺等物质。支气管镜下的小细胞肺癌浸润生长最为明显,病变侵及范围广,与正常组织之间的边界极其模糊,导致支气管表面肿胀,有时可见血性分泌物[9-10]。小细胞癌的增长速度极快,该病的发病病因和发病机制目前还没有明确,目前研究表明,与空气污染、吸烟、饮食和遗传基因有关[11]。生物免疫疗法由患者静脉采集外周血,经过体外分离后培养,获得更加有效和特异性抗肿瘤杀伤细胞,在实验室进行培养后,分次进行回输,有效杀死肿瘤情况下,保证机体免疫系统结构及功能不受损伤,提高机体免疫能力。生物免疫疗法是近几年来发现的一种治疗肿瘤的方法,其可以控制肿瘤细胞,增强患者的免疫功能[12-14]。
相关资料显示,作为肿瘤标志物的CYFRA21-1在小细胞肺癌患者血清中表达出现异常,其水平变化与小细胞肺癌分期及肿瘤组织大小等具有密切联系,具有重要诊断价值。CYFRA21-1异常表达与小细胞肺癌患者预后密切相关,对CYFRA21-1水平检测能够有效对患者治疗效果进行评价。CEA属于光谱血清肿瘤标志物,是具有抗原特性的糖蛋白,肿瘤组织的发生发展与其水平表达关系密切。CEA进入血液导致其血清浓度增加,最终导致机体脏器中细胞发生癌变,对CEA水平进行检查可以辅助对小细胞肺癌的诊断[15]。本研究结果显示,通过生物免疫疗法联合放疗对SCLC患者进行治疗,可有效调控肿瘤标志物CYFRA21-1、CEA水平,对诊断及预后具有重要作用。
VEGF是一种具有高度生物活性的二聚体阳离子糖蛋白,特异性作用于血管内皮细胞,有效提升机体血管通透性、促进血管形成。VEGF作为促进血管内皮细胞生长的重要因子对肿瘤细胞增殖具有重要作用,因此对VEGF进行检测可以有效直观的对治疗效果进行评价。VEGFR1、VEGFR2、VEGFR3属于VEGF受体,对癌组织新生血管形成具有重要影响,与癌细胞的生长具有密切联系[16-17]。本研究结果显示,通过生物免疫疗法联合放疗对SCLC患者进行治疗,血清VEGFR水平降低,对癌组织的发生发展具有明显抑制作用。
T细胞在免疫系统中扮演重要角色,临床与研究证明,小细胞肺癌的发生发展会对机体免疫功能造成损伤[18]。CD4+是T细胞辅助细胞,对体液免疫和细胞免疫功能具有明显辅助效果。作为细胞毒T细胞或T抑制细胞,CD8+主要作用包括抑制细胞毒作用及免疫作用。相关研究资料显示,通过治疗对小细胞肺癌患者T淋巴细胞亚群水平进行调控,能够有效提高免疫功能[19]。本研究结果显示,通过生物免疫疗法联合放疗对SCLC患者进行治疗,能够有效调控T淋巴细胞亚群水平,达到改善免疫功能的治疗效果。
综上所述,通过生物免疫疗法联合放疗对SCLC患者进行治疗,可有效调控肿瘤标志物CYFRA21-1、CEA水平,提高自身机体免疫能力,有效抑制癌组织及癌组织细胞新生血管的生长,治疗效果显著,对小细胞肺癌的诊断及预后具有一定参考价值。
利益冲突:所有作者声明无利益冲突
作者贡献声明
李龙:设计研究方案,实施研究过程,论文撰写;郑振东:提出研究思路,分析试验数据,论文审核;刘渤娜:实施研究过程,资料搜集整理,论文修改;高霄丽:进行统计学分析;芦洪波:课题设计,论文撰写

