猪源大肠杆菌黏附素相关基因检测和耐药性分析
冯茜茜 , 陈 革 , 张清一 , 王鹏勇 , 杨跃飞 , 王彦红
(1.扬州大学兽医学院 , 江苏 扬州 225009 ; 2.江苏省动物重要疫病与人兽共患病防控协同创新中心 , 江苏 扬州 225009)
大肠杆菌(Escherichiacoil,E.coli)是人和动物肠道内常见菌之一,正常情况下为非致病性共生菌,在特殊条件下会导致大肠杆菌病的发生[1]。致病性大肠杆菌会引起仔猪黄痢、白痢、猪水肿和败血症等疾病。有些猪源致病性大肠杆菌具有一些黏附素相关毒力基因(如fimH和pap),能增加尿路感染的机会,称为尿路致病性大肠杆菌(UropathogenicEscherichiacoil,UPEC),这些菌株可能引起人致病,是潜在的人兽共患病病原。能够促使UPEC入侵尿道细胞的重要毒力因子是黏附素,主要包括I型菌毛、P型菌毛、S型菌毛和FIC型菌毛。Ⅰ型菌毛由1个操纵子编码,包括fimB、fimE、fimA、fimI、fimC、fimD、fimF、fimG和fimH共9个基因;P型菌毛由pap操纵子编码,存在papA、papC、papGalleleⅠ、papGalleleⅢ等基因;FIC型菌毛由focA和focG等基因编码;S型菌毛基因由sfaS等基因编码。UPEC表达黏附素(如I型和P型菌毛)使细菌易于结合并侵入尿道内的宿主细胞和组织[3]。
大肠杆菌感染是猪生产中重要疾病之一,能引起重大的经济损失,随着我国养猪规模化工业化的发展,猪场大肠杆菌的暴发呈上升趋势。人和猪分离的大肠杆菌菌株之间的相似性表明,大肠杆菌存在不同宿主之间交叉感染的可能性[4]。因此,本试验选择8种黏附素相关基因进行检测,以期探讨本地区猪源大肠杆菌黏附素部分毒力基因的携带情况,同时进行耐药性分析,为猪大肠杆菌病的防控提供依据。
1 材料与方法
1.1 菌株来源 以本课题组2017年7—12月从扬州大学动物医院就诊的病死猪脾、肝等组织作为病料。
1.2 主要试剂与仪器 琼脂粉、氯化钠,均购自国药集团化学试剂有限公司;麦康凯琼脂粉,购自杭州微生物试剂有限公司;生化鉴定管和药敏试纸片,均购自杭州微生物试剂有限公司;PCR试剂盒,购自宝生物工程(大连)有限公司。
超净工作台(型号为SW-CJ-IL),购自苏州净化工作台设备有限公司;恒温培养箱(型号为GNP9080),购自上海精宏试验设备有限公司;DNA扩增仪(型号为4484073),购自北京智杰方远科技有限公司;凝胶电泳仪(型号为DYCP-31DN),购自北京六一生物科技有限公司。
1.3 细菌分离鉴定 将采集的样品无菌操作接种于麦康凯平板,37 ℃培养24 h,挑取典型的单菌落再纯化分离。挑取麦康凯琼脂上粉红色单菌落进行革兰染色镜检,观察细菌的形态及生物学特性。将纯化的细菌进一步进行生化鉴定。
1.4 药敏试验 通过Kirby-Bauer(K-B)纸片琼脂扩散法测定15种抗菌药物的耐药性,无菌操作将25株分离菌的纯培养物均匀涂抹于营养琼脂平板,置于37 ℃培养箱中培养18~24 h。根据美国临床和实验室标准协会(Clinical and Laboratory Standards Insitute,CLSI)(2009年)标准判定其耐药性。
1.5 提取DNA 采用煮沸裂解法提取细菌的DNA。大肠杆菌分离株在血平板上纯培养,挑取适量细菌,混入2 mL离心管中,充分混合均匀。离心管放入沸水中煮沸10 min,取出。冷却至室温后,放入-20 ℃保存,备用。
1.6 大肠杆菌黏附素相关基因检测 利用PCR技术对黏附素相关基因进行检测,待检测基因有Ⅰ型菌毛相关基因fimH,P型菌毛相关基因papA、papC、papGalleleⅠ、papGalleleⅢ,FIC型菌毛基因focA、focG,S型菌毛基因sfaS。相关基因引物根据参考文献[5-8]合成(表1),引物均由生工生物工程(上海)股份有限公司合成。

表1 大肠杆菌黏附素相关基因PCR扩增引物Table 1 PCR amplification primer targeting Escherichia coli adhesion-related genes
2 结果
2.1 细菌分离鉴定 2017年7—12月,采集25份病死猪样品,其中7份脾脏、12份肝脏和5份心脏以及1份肺脏组织作为病料。经细菌分离,在麦康凯培养基上形成中等大小、表面光滑、边缘整齐的红色菌落。生化鉴定结果显示,25株分离得到的菌株均能够发酵葡萄糖、乳糖、麦芽糖、果糖,少数能发酵蔗糖,并且都不能够使甘露糖发酵;吲哚试验为阳性,枸橼酸盐利用试验、硫化氢试验均为阴性,均符合大肠杆菌的生化特性。
2.2 药敏试验 结果见表2,25株猪源大肠杆菌对多西环素、卡那霉素、复方新诺明、氟苯尼考等10种药物有较强的耐药性,对丁胺卡那敏感。

表2 药敏试验结果Table 2 Drug sensitivity testing results
2.3 大肠杆菌黏附素相关基因检测 PCR扩增后,通过琼脂糖凝胶电泳PCR产物,将目的片段送至南京金瑞斯生物公司测序,测序结果上传GenBank进行序列比对,基因确认后的菌株作为阳性对照。25株菌黏附素相关基因检测结果显示,部分菌株检测出fimH、papC和focG基因,检测率分别为40%、8%和4%,papA、papGalleleⅠ、papGalleleⅢ、focA、sfaS基因均未被检测出。部分基因的电泳结果见图1~3。同时携带fimH和papC基因的仅有1株。
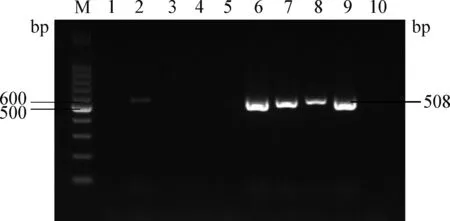
图1 fimH基因的PCR扩增Fig.1 PCR amplification of fimH geneM:100 bp DNA相对分子质量标准; 1~8:样品; 9:阳性对照; 10:阴性对照M:100 bp DNA marker; 1-8:Samples; 9:Positive control; 10:Negative control
3 讨论
本试验共分离出25株猪源大肠杆菌,对15种临床常用药敏试验结果显示,从临床病例分离的大肠杆菌耐药比较严重,多西环素耐药率最高,多西环素抗菌谱广,养殖过程中大量使用此类药物用于预防和治疗疾病,是导致耐药的一种原因,另一种原因可能是耐药基因的水平传播。除多西环素外,25株菌对喹诺酮类、磺胺类、氯霉素类抗菌药耐药,对美洛西林、环丙沙星、链霉素的耐药率也超过50%,此耐药情况与国内其他大肠杆菌耐药情况类似[9]。

图2 focG基因的PCR扩增Fig.2 PCR amplification of focG geneM:100 bp DNA相对分子质量标准; 1:阴性对照; 2:阳性对照; 3~19:样品M:100 bp DNA marker; 1:Negative control; 2:Positive control; 3-19:Samples

图3 papC基因的PCR扩增Fig.3 PCR amplification of papC geneM:100 bp DNA相对分子质量标准; 1~13:样品; 14:阳性对照; 15:阴性对照M:100 bp DNA marker; 1-13:Samples; 14:Positive control; 15:Negative control
25株菌检测8种黏附素相关基因结果显示,菌株携带fimH、papC和focG基因,携带率分别为40%、8%和4%,此外,仅1株细菌同时携带fimH和papC。UPEC致病的第1步是定植到宿主细胞上,黏附素的表达增强了细菌的毒力。较多的肠外致病性大肠杆菌携带有Ⅰ型菌毛基因fimH,Ⅰ型菌毛是肠外大肠杆菌进行黏附的重要毒力基因,fimH蛋白能够暴露于细菌表面,介导与D-甘露糖受体的特异性结合[10]。可赋予Ⅰ型菌毛结合D-甘露糖,并结合许多类型的真核细胞(包括肠、肺、膀胱、肾上皮和各种炎症细胞)的能力对保护大肠杆菌免受吞噬有直接或间接的作用[11]。P型菌毛主要由pap(Pyelonephritis-associated pili)基因簇表达蛋白共同组装构成,介导尿道致病性大肠杆菌的黏附定植,与动物的泌尿道感染有着密切关系。在UPEC的流行病学中发现,70%的肾盂肾炎病例表达P菌毛,膀胱炎病例和无症状尿道感染分离的UPEC分别有36%、24%菌株携带该菌毛。FIC菌毛foc和S菌毛sfa这2种黏附素具有高度同源性,FIC型菌毛主要黏附远端小管和集合管上皮细胞。Zhu等[12]对猪源大肠杆菌毒力基因研究发现fimH、papC、papA、sfaS基因的检测率分别为81.3%、21.9%、4.7%和1.6%。Tan等[13]的研究显示,fimH基因在猪分离株中检出率高达85.4%。Khan等[14]的研究中fimH、sfaS、focG基因的检出率均在50%以上,papA、papC基因的检出率均在40%以上。通过上述研究可知,较多猪源大肠杆菌与UPEC具有相似的黏附素相关基因,是一种潜在的人兽共患病病原,加强猪大肠杆菌感染的防控具有一定的公共卫生安全意义。
本试验结果显示,从动物医院临床病料中分离得到的猪源大肠杆菌对喹诺酮类和磺胺类药物的耐药性比较严重,尽管分离到的肠外致病性大肠杆菌携带有Ⅰ型菌毛基因(fimH)、P型菌毛基因(papC)以及FIC菌毛基因(focG),与尿路致病有着密切关系,但菌株的毒力与基因型之间的关系以及尿道致病机制无法确定,还需进一步研究。

