血清脂肪细胞型脂肪酸结合蛋白对非酒精性脂肪性肝病的预测价值
汶倩 王晓叶 赵丽 张哲 李武良 赵曙光 陶梅
非酒精性脂肪性肝病 (non-alcoholic fatty liver disease,NAFLD)已成为我国第一大慢性肝病和健康体检肝酶异常的首要原因[1]。肝组织活检是 NAFLD诊断的“金标准”,但因其有创且昂贵,临床应用并不普遍[2]。目前常用的筛查技术有腹部B超、CT、MRI等,也都存在不同的局限[3]。因此,寻找一种简便、准确的血清标志物预测NAFLD成为研究热点。本文拟通过研究NAFLD患者血清脂肪细胞型脂肪结合蛋白(A-FABP)水平的变化,提出A-FABP预测界值,评价血清A-FABP预测NAFLD的价值及效能,为A-FABP的临床应用提供依据。
资料与方法
一、研究对象
选择2019年6月至2019年7月西安交通大学医学院附属西安市第九医院健康体检发现的NAFLD患者86例。入选标准:根据中华医学会肝病学分会2010 年《非酒精性脂肪性肝病诊疗指南》临床诊断标准[4]。NAFLD超声标准:肝区近场回声弥漫增强,肝肾脾回声差异,肝回声>肾脾回声;远场逐渐衰减;肝内静脉结构模糊不清;肝脏轻度或中度肿大,边缘圆钝;肝内血流信号减少或不易显示。肝右叶包膜及横隔回声显示不清。并排除病毒性肝炎、自身免疫性肝炎、药物性肝损伤、肝硬化、胆道梗阻、严重感染、糖尿病、长期饮酒者及遗传疾病等。同时选取86例年龄、性别相匹配的体检健康者为对照组。
二、研究方法
(一)超声检查 选用PHILPS EPIQ5型号超声诊断仪,探头频率设置在2.0~5.0 MHz,所有研究对象检查前至少禁食8 h,仰卧位和左侧卧位接受腹部超声扫描,观察受检者肝脏外形、肝实质回声、脉管系统等。所有入选对象超声检查均为同一医生操作。
(二)体格数据测定 测量所有研究对象的身高、体重、腰围,并计算体质量指数(BMI)=体重/身高(kg/m2)。腰围的测量分别在肋骨下缘和髂前上嵴的中间水平。
(三) 生化指标的测定 所有研究对象禁食12 h,次晨采静脉血,分离血清。空腹血糖(FPG)、甘油三酯(TG)、总胆固醇 (TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇 (HDL-C)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(γ-GT)和尿酸(UA)均采用东芝X8仪器,美康生物科技有限公司试剂盒测量。超敏C反应蛋白(hsCRP)采用西门子BNII仪器及其提供的试剂盒进行测量,hsCRP<3.0正常,hsCRP≥3.0 偏高。
(四)血清中 A-FABP和 TNF-α测定 采用ELISA法检测定血清中 A-FABP 和 TNF-α,试剂盒购自伊艾博科技有限公司。
三、统计学分析

结 果
一、两组一般情况比较
NAFLD组体重、BMI、腰围均显著高于对照组(P<0.01,表 1)。
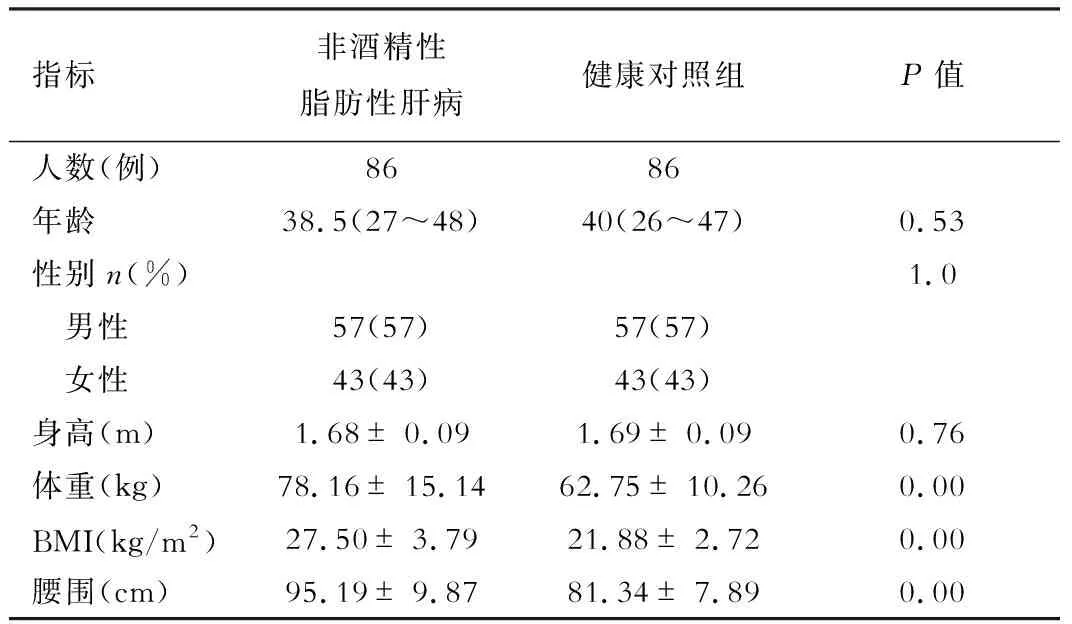
表1 非酒精性脂肪性肝病和对照组一般指标比较
二、两组间生化指标的比较
NAFLD组血清ALT、AST、UA、γ-GT、FPG、TG、TC、LDL-C、hsCRP 、TNF-α、A-FABP均显著高于对照组,而 HDL-C显著低于对照组 (P<0.05,表2)。

表2 非酒精性脂肪性肝病和对照组生化指标比较
三、A-FABP为诊断NAFLD的ROC曲线
ROC曲线下面积为0.989(95%CI0.979~1),A-FABP分界点82.43 pg/mL对应的正确诊断指数最大,因此,可以把它作为最佳诊断分界点(图1)。
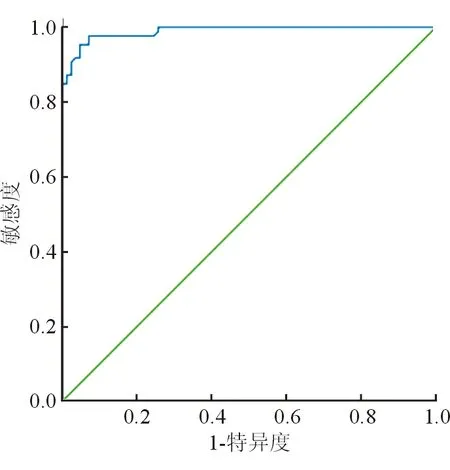
图1
四、A-FABP分界点下预测NAFLD的效能
预测NAFLD的灵敏度97.7%,特异度为93.0%,阳性预测值93.3%,阴性预测值97.6%,总的符合率95.3%,一致性检验的统计量Kappa为0.907。
五、NAFLD组血清A-FABP与各指标相关分析
Pearson或Spearman相关分析显示A-FABP和BMI、TNF-α、UA呈现正相关,和HDL-C呈负相关,相关系数分别是0.296、0.274、0.370、-0.250(表3)。
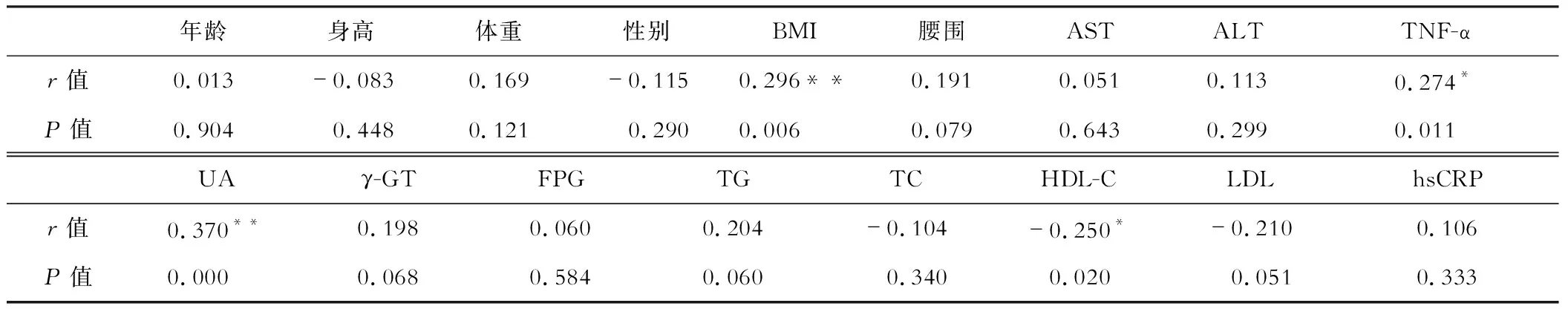
表3 非酒精性脂肪肝患者血清A-FABP与临床指标的相关性分析
六、NAFLD组血清A-FABP与相关因素多元线性回归
以A-FABP为因变量,对其各种可能的影响因素(BMI、TNF-α、UA和HDL)进行多元线性回归分析显示 TNF-α及UA进入最后方程,成为影响A-FABP的主要因素(表4)。

表4 A-FABP与相关指标的线性回归分析
讨 论
肝脏脂肪变与肝脏炎症损伤和纤维化密切相关,并可预测MS和2型糖尿病的发病风险[5-6]。B超临床应用最多,但诊断轻度脂肪肝敏感性低,特异性亦有待提高。受控衰减参数(controlled attenuation parameter,CAP)较B超容易高估脂肪变的程度,其区分不同程度脂肪变的诊断阈值及其动态变化的临床意义尚待探索[7]。磁共振波谱分析能够检出>5%的肝脂肪变,准确性很高,但因花费高而难以普及[8]。应用BMI、腰围、血清TG和γ-GT水平等指标组合的肝脂肪变指数、脂肪肝指数等,对脂肪肝的诊断性能存在种族群体、年龄等差异[9],因此,寻求血清学标志物预测NAFLD一直是研究热点。A-FABP作为联系代谢紊乱与炎症反应的关键因素,而受到研究者的重视。
A-FABP又称 aP2 或 FABP4,属于小分子量细胞内脂肪酸结合蛋白超家族,主要表达于脂肪组织、巨噬细胞、树突状细胞及内皮细胞等。A-FABP通过调节炎症反应、能量稳态、代谢平衡等不同的作用来调节MS各组分的发展。本研究发现NAFLD患者血清A-FABP明显增高,与Xu等[10]研究结论相似。NAFLD作为MS的一个临床特点或者肝脏表现,本研究发现NAFLD组中作为MS的重要指标的TG、TC、LDL-C、HDL-C、UA、FPG与对照组均存在显著差异,这和以往研究相同[6, 11, 12]。研究证明轻中度肝酶的升高常常是NAFLD临床症状还未出现前唯一异常的指标,可作为NAFLD独立预测因素[13],我们的研究显示NAFLD组AST、ALT、γ-GT 均明显升高。根据A-FABP诊断NAFLD的ROC曲线,得出其分界点为82.43 pg/mL,在此分界点下得出诊断NAFLD灵敏度为97.7%,特异度93.0%,总的符合率95.3%,一致性检验的统计量Kappa为0.907。因此,可以把A-FABP=82.43 pg/mL作为最佳诊断分界点。当然,还需要通过更大的样本量来验证其可靠性。
本研究发现NAFLD患者血清A-FABP及TNF-α水平明显高于对照组,在单因素相关分析及多元线性回归分析中,A-FABP水平与TNF-α、UA正相关,与Kim等[14]研究结论一致。肝脏库普弗细胞(Kupffer cell, KC)是防治 NAFLD 的重要靶细胞[15]。KC是肝内唯一产生 A-FABP 的细胞,动物实验表明A-FABP通过增强代谢性LPS增高诱导KC的炎症反应,分泌炎症介质如 TNF-α和白细胞介素IL-1β等, 导致NAFLD 的发生和进展,A-FABP 抑制剂 BMS309403 对急慢性肝损伤有治疗作用[16]。因此, NAFLD患者血清A-FABP 表达上调,且与TNF-α、UA正相关体现了其在代谢紊乱及炎症间的重要中介。
综上所述, A-FABP作为联系代谢紊乱与炎症反应的关键因素,其血清水平>82.43 pg/mL作为NAFLD预测指标具有良好的预测价值,其预测价值是否在更大样本的人群中依然良好需要进一步研究。

