代谢相关脂肪性肝病的诊断与评估现状
韩琳 谢欢 孙颖 邹正升
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)包括从单纯脂肪肝(Simple steatosis)到非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis ,NASH)和NASH相关肝硬化及肝细胞癌的广泛疾病谱[1]。2020年4月,国际脂肪肝专家小组发表共识[2],将NAFLD正式更名为代谢相关脂肪性肝病(Metabolic-Dysfunction-Associated Fatty Liver Disease,MAFLD),对于NASH及非NASH,共识认为该分类方法不能涵盖MAFLD的全部疾病谱,认为MAFLD的疾病过程最好用活动度和纤维化程度来描述。因国际脂肪肝专家小组发表的共识中并未提出针对NASH的新概念,本文仍沿用NASH的概念。肝纤维化的出现是影响MAFLD患者预后的重要风险因素[3]。单纯性脂肪肝如得不到有效控制,其纤维化程度每14年可进展一期,而NASH患者的纤维化程度每7年即可进展一期[4],这意味着MAFLD患者如不能得到及时控制,其病情将不断进展而出现肝硬化,甚至有发生肝硬化并发症及肝细胞癌的风险。MAFLD,尤其是NASH的诊断具有重要的临床意义,本文将从MAFLD的诊断及评估方法进行综述。
一、MAFLD的现状
随着国家经济水平、人民生活水平和交通便利程度的提高以及网上购物等线上服务的盛行,一些日常所需的基本运动量不断减少,世界各地MAFLD的患病率均呈急剧上升,在健康人群中,每年约有3%~4%的人发生MAFLD[5], 目前全球MAFLD的患病率达25%[6], 而在超重和肥胖的人群中MAFLD的患病率已升高至39%;在亚洲,MAFLD的患病率超过全球水平,为29.62%[7],而在超重和肥胖的人群中MAFLD的患病率高达52.27%;目前我国的数据显示,全国MAFLD的患病率达29.2%[8],已超过全球水平,MAFLD的发病情况令人担忧。以往的观点认为MAFLD是一种良性病变,但目前大量的数据显示MAFLD不仅影响肝脏,它所带来的临床风险可延伸至肝脏以外,与糖尿病、心脑血管事件、肾功能损伤、肝外肿瘤、多囊卵巢综合征、阻塞性睡眠呼吸暂停综合征、骨质疏松等密切相关,因此MAFLD已严重影响人类健康,成为全球重要的公共健康问题之一。
二、MAFLD的诊断
NAFLD的概念是1980年由Jurgen等首次提出,但以往认为“脂肪肝”为良性病变,因此对该疾病的诊断及评估缺乏深入研究。近20年对NAFLD,尤其是NASH的诊治研究取得了很多突破性进展[9](图1),2000年开始逐渐发现NASH与胰岛素抵抗密切相关,2005年美国 NASH 临床研究网络提出了NASH的组织学评分和评估系统,2020年国际脂肪肝专家小组发表的共识将NAFLD更名为MAFLD, 并认为MAFLD的诊断应基于代谢功能障碍的存在,可以与其他肝病共存,而不是排除其他肝病。

图1 MAFLD 关键研究事件时间轴
目前国际上针对MAFLD提出了多项诊断标准(表1),主要涵盖了3方面内容:(1)影像学及组织学脂肪肝证据;(2)排除导致肝脂肪变的其他原因;(3)排除大量或持续饮酒因素[10]。2020年的专家共识在确定更名后,提出了全面的MAFLD诊断标准,与饮酒量无关,且适用于所有临床环境[2](图2)。
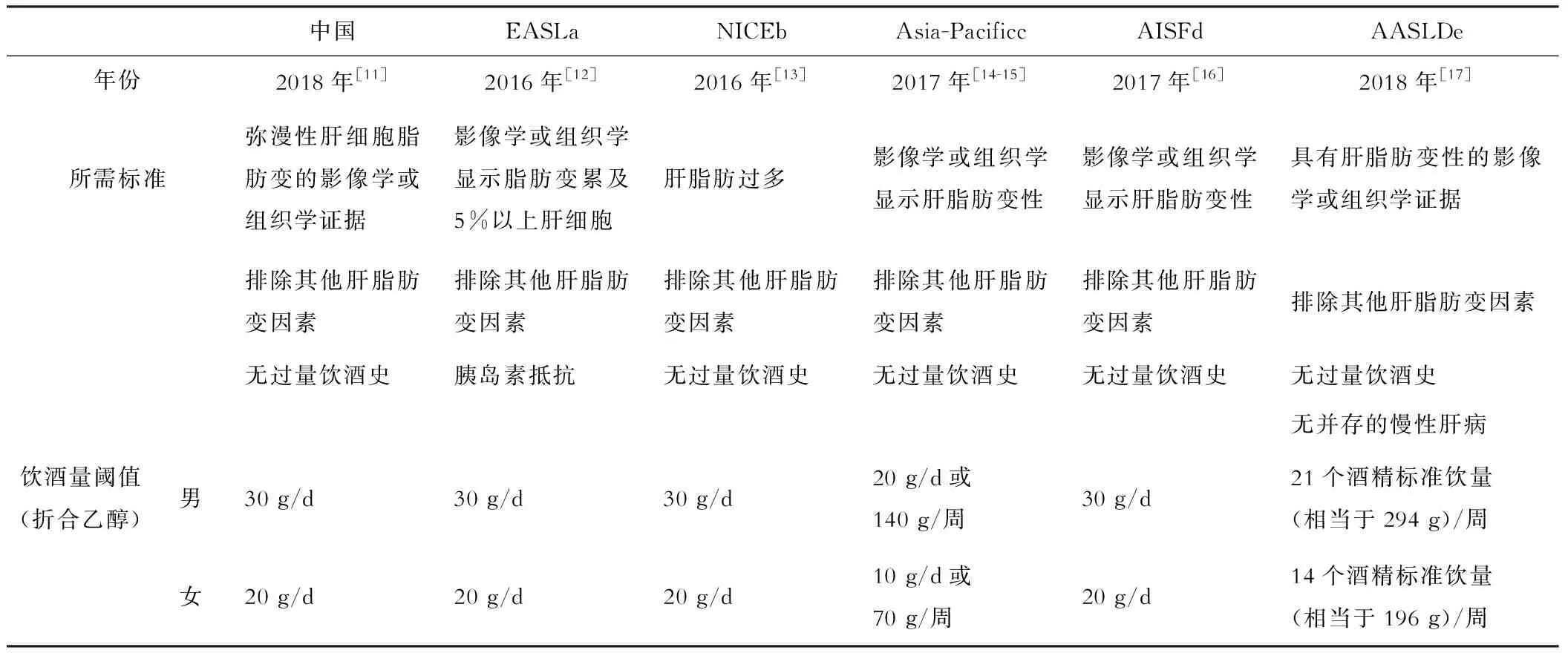
表1 国际上MAFLD的诊断标准

图2 2020年的国际专家共识提出的MAFLD诊断流程图[2]
(一)MAFLD是包含性疾病 以往认为MAFLD诊断需排除其他原因所致的脂肪性肝病,但2020年的国际专家共识认为MAFLD是一种代谢性相关肝损伤,可与其他病因所致肝病重叠发生,且MAFLD和酒精性肝病的患者代表了一个庞大而重要的群体,需要进一步研究和鉴定。在我国,慢性乙型肝炎基础上合并MAFLD患者较为常见,也引起了研究人员的关注,有调查显示,亚洲慢性乙型肝炎病毒(HBV)感染患者MAFLD患病率为14%~67%不等[5]。
(二)临床特征 MAFLD患者临床特征缺乏特异性,一旦发展至肝硬化失代偿期将同样面对各种并发症。肝纤维化的严重程度与肝病相关死亡正相关[18],有研究预计2030年,中国成人MAFLD患者发生失代偿期肝硬化、肝癌及肝病相关死亡人数分别可达751 190例、12 780例(较2016年增长82%),103 840例[19]。现已证明MAFLD是一种全身性疾病,除了肝脏表现,还可并发多种肝外疾病[20]。肥胖、2型糖尿病、血脂异常和代谢综合征是MAFLD最重要的危险因素[17]。
非肥胖相关的 MAFLD在亚洲人群较为常见。非肥胖为体质量指数小于25 kg/m2,一般有近期体质量和腰围增加的病史。多项研究表明,在BMI正常的人群中,MAFLD发生率不同,从7%~21%均有报道[21]。出现该现象的原因可能与亚洲人群较高的体脂比有关。非肥胖患者在肝脏组织学方面具有较低的脂肪变分级和纤维化分期[22]。Wong 团队研究发现,在非肥胖 MAFLD患者中通过减轻体质量可使脂肪肝得到改善,体质量减少量与脂肪肝恢复相关。与肥胖患者相比,非肥胖的MAFLD患者,不需要减掉过多的体质量即可获益。因此认为生活方式干预在非肥胖 MAFLD患者中仍然发挥作用,建议非肥胖 MAFLD患者仍要健康饮食和常规锻炼[23]。
(三)影像学诊断
1 .常规影像学诊断
当肝脏出现脂肪变时,超声检查存在特征性改变:肝实质回声强度超过肾回声;肝前后的回声差异,近场回声密集增强而远场回声衰减;肝内管道尤其是肝静脉变细显示不清;肝脾肿大。超声诊断是MAFLD首选影像学诊断方法,但超声在诊断肥胖患者时其敏感度下降,而在肝脏脂肪<20%的患者也同样难以检出[10]。
CT诊断较超声诊断更为敏感,肝脏出现脂肪变时肝脏CT 值下降,当比值在0.7~1.0之间考虑为轻度脂肪肝,比值0.5~0.7之间为中度脂肪肝,比值≤0.5为重度脂肪肝。但CT对轻度脂肪肝检出率同样较低。
MRI诊断脂肪肝更具精确性。肝脂肪变时T1W1同相位表现为稍高信号或等信号,而反相位则表现为低信号。磁共振质谱分析(1H-MRS)可准确定量评估肝脏脂肪含量,与病理诊断具有较高的相关性。此技术可用于不同程度肝脂肪变的随访及诊断,准确性高。但存在耗费时间长、设备要求高、且存在取样误差的缺点。
2 .弹性成像技术
弹性成像技术目前包括基于超声的瞬时弹性成像(Transient Elastography,TE)及基于磁共振成像的磁共振弹性成像(Magnetic Resonance Elastography,MRE)。TE可评价肝脏纤维化程度和脂肪含量。目前市场常用仪器FibroScan(FS),已投入临床10余年。FS易受外界因素影响,2010年由清华大学参与研制开发了国内首台肝脏硬度弹性检测仪Fibro Touch(FT),与FS具有较好的一致性和相关性,且FT稳定性及检测效能略高于FS[24]。MRE被认为是“影像触诊”,可准确预测MAFLD肝纤维化进展情况,肝纤维化程度越高,弹性值越高。
3 .常规影像学技术在MAFLD诊断中的不足。
常规影像学技术在MAFLD诊断中发挥重要作用,但仍存在不足。如超声检查对脂肪变可进行不定量评估,但无法评估肝纤维化,且无法鉴别单纯脂肪肝及NASH;CT检查可定量评估肝脂肪变,但仅能半定量评估肝纤维化程度;MRI检查可定量评估肝脂肪变,但仍无法评估肝纤维化程度。以上三种常规影像学检查手段均对肝硬化诊断具有较高敏感性,但缺乏鉴定单纯脂肪肝及NASH的能力。利用弹性成像技术的TE/CAP,可评估肝脂肪变及进展期肝纤维化,但目前尚无公认的阈值用于确诊肝纤维化及肝硬化。MRE对肝脂肪变评估的敏感度及特异度均较高,同时可评估进展期肝纤维化,鉴别单纯脂肪肝及NASH ,但受其价格及技术要求,我国现阶段仅用于科研[25]。
(四)组织学诊断 肝活检是MAFLD诊断的“金标准”,也是对患者预后进行判断的重要手段。对于通过无创检查手段预测显著肝纤维化的患者,需行肝脏活检进一步明确患者肝病病因。
1 .MAFLD的病理表现
MAFLD的病理表现主要包括脂肪变、炎症坏死及纤维化等。根据MAFLD 不同的病理特征,可区分非酒精性肝脂肪变(单纯性脂肪肝)、NASH及NASH肝硬化。非酒精性肝脂肪变病理表现为:肝腺泡3区肝细胞脂肪变≥5%;无肝细胞损伤(或仅有气球样变),有或无肝小叶和汇管区炎症及坏死;无肝纤维化。NASH则在肝腺泡3区出现肝细胞脂肪变(≥5%)基础上,出现肝细胞损伤,有肝小叶和汇管区炎症及坏死,早期NASH纤维化程度为F0~F1,纤维化性NASH为F2~F3。NASH肝硬化常出现或曾出现肝腺泡3区肝细胞脂肪变、肝细胞损伤、肝小叶和汇管区炎症及坏死,纤维化程度为F4[26]。肝脂肪变、肝细胞气球样变和肝脏炎症同时存在是诊断NASH的必备条件。
2 .NASH的组织学评价系统
NASH的组织学评价系统可减少病理观测者之间的误差,增加诊断NASH的一致性。常用的NASH组织学评价系统有Brunt系统,但仅适用于成人MAFLD;美国NASH临床研究网络评分系统(NASH Clinical Research Network,NASH-CRN)适用于成人及儿童MAFLD;欧洲脂肪肝进展阻断组织学评分系统(Steatosis、Activity、and Fibrosis,SAF)仅适用于成人MAFLD。
美国NASH-CRN方案目前在临床上应用较为广泛,其将MAFLD活动积分(NAFLD/MAFLD Activity Score,NAS)及NASH纤维化分期作为评价标准,用于NASH的诊断和评价。CRN方案与Brunt系统的最大不同是将窦周或汇管区周围纤维化分期进行细化(表2)。当NASH的临床研究中,常采用NAS≥4分(肝脂肪变≥1;小叶炎症≥1;肝细胞气球样变≥1)及肝纤维化程度≥F2作为临床试验研究的组织学评价终点[27]。
(五)血清学诊断 血清学检测可用以识别其他导致肝脂肪变的病因,对MAFLD患者具有重要的诊断价值。在肝酶学检查中,MAFLD患者的ALT及AST升高通常在1.5~2倍正常值上限(ULN),且常伴有GGT升高。如无其他原因,ALT或AST升高至2~3ULN者应考虑 NASH可能,但肝酶学检查作为NASH炎症活动的诊断和监测具有一定的局限性,AST/ALT>1常提示肝纤维化进入F4期[28]。目前用于肝纤维化诊断的血清学指标在临床上已普遍开展。研究表明aCK-18片段水平与纤维化程度呈正相关,临床上可通过对血清细胞角蛋白-18(CK-18)片段检测来预测纤维化程度。血清铁蛋白也可间接评估纤维化程度,血清铁蛋白水平>1.5 ULN,提示NASH纤维化程度≥F2;血清铁蛋白水平>2.5 ULN,提示NASH纤维化程度≥F3[29]。此外与MAFLD密切相关的各种代谢性疾病也可结合血清学进行初步诊断和筛查,从而发现高风险MAFLD患者。

表2 美国NASH临床研究网络评分系统(NASH-CRN)
(六)基于血清标志物的NASH无创纤维化评估模型(表3) 肝活检作为有创操作具有很大的局限性,现已证实,由无创血清生物标志物测定的晚期纤维化可预测肝病相关性并发症和死亡率,且可作为识别显著纤维化低风险患者的一线方法[30]。

表3 基于血清标志物的NASH纤维化模型
三、MAFLD的筛查
非酒精性脂肪性肝病目前已成为我国体检肝功能指标异常的首要病因。对于存在2型糖尿病的高风险人群和肥胖人群应进行MAFLD筛查,超声检查及肝弹性检查是常用的筛查工具。对于确诊为MAFLD的患者应评估其肝病是否已发展至较为严重的程度,是否存在NASH,同时需进一步筛查患者是否存在代谢综合征的其他组分(如肥胖、高脂血症、糖尿病及胰岛素抵抗)。对于MAFLD已进展至NASH肝硬化的患者,应每半年完善腹部超声检查进行肝癌初步筛查[14]。对于疑似MAFLD患者,建议按照初步筛查及专科就诊两部分进行无创肝纤维化评估[31]。(图3)
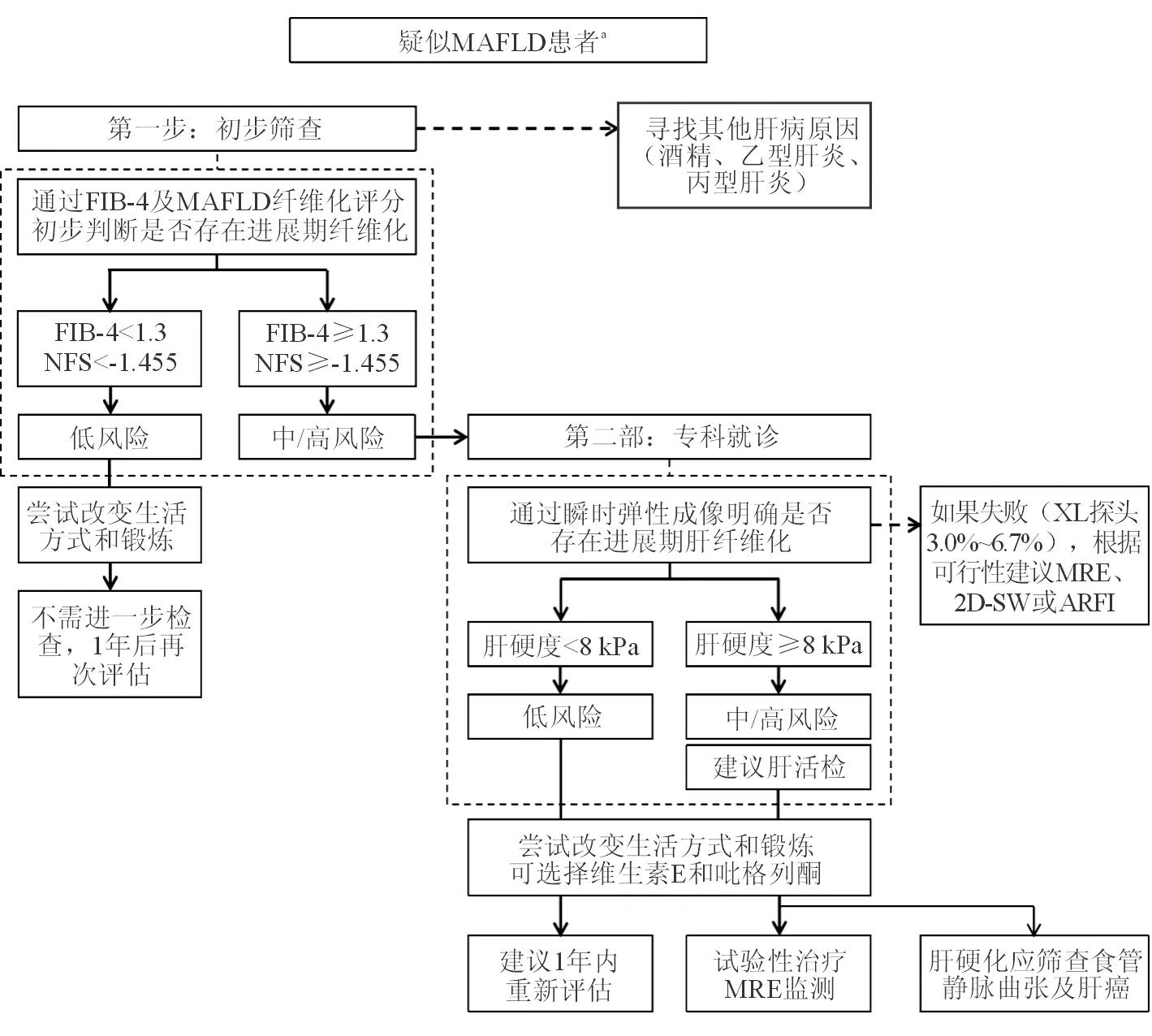
a疑似MAFLD患者:超声显示肝脂肪变或有危险因素(肥胖、2型糖尿病或代谢综合征)且肝功异常的患者
(一)NASH风险筛查:年龄、肥胖、患有糖尿病、高血压病以及异常的AST、NFS和FIB-4是NASH发生及肝纤维化进展的重要风险因素,NASH纤维化进展根据上述情况的有无及存在的程度分为低风险、中风险及高风险[27](表4)。由于NASH是单纯性脂肪肝进展为肝硬化的必经阶段,因此筛查NASH极为重要,对于存在NASH发生和进展风险的人群需要给予及早干预治疗。

表4 NASH或纤维化风险进展风险
(二)肝外并发症筛查 对于MAFLD患者每年需筛查疾病主要包括:2型糖尿病、慢性肾病、心血管疾病,对于已进展为NASH的患者每年需进行结肠癌、骨质疏松、甲状腺功能减退及阻塞性睡眠呼吸暂停综合征的筛查,对于具有月经不调、不育症、多毛症的育龄女性应进行卵巢超声检查及血清雄激素水平的检测。
(三)代谢综合征筛查 对MAFLD患者应进行代谢综合征及其组分的筛查,定期检测体质量、腰围、血压、血糖、血脂谱等[28]。对于不明确是否存在MAFLD者,如出现胰岛素抵抗或具有代谢危险因素(肥胖或代谢综合征)的人群,如果确诊2型糖尿病和/或出现肝酶异常,应及时行MAFLD无创筛查。
四、展望
MAFLD的发病率逐年攀升,但临床症状较为隐匿,如何早期诊断及筛查成为临床医生急需解决的问题,随着人们对MAFLD的认识程度提高,以及多种无创、简便的诊断方法和评估模型的研发,广大的MAFLD患者有望被早期诊断,并得到更加精确的病情评估及预后判断,从而指导下一步干预治疗。

