屋尘螨致敏小鼠鼻炎模型建立及其免疫学评价
张影,徐颖华,江霞云,鲁旭,杨蕾,於洋,王斌,赵爱华,李丽莉
过敏性疾病是由变应原引起的全球性高发病,其临床症状包括过敏性结膜炎、鼻炎、哮喘和皮炎等[1],不仅降低了人们的生活质量,也耗费了大量的医疗资源[1-2]。20世纪70年代以来,过敏性疾病的发病率持续上升,全世界患过敏性疾病的人口数约占15%~30%[2]。尘螨(House Dust Mite, HDM)作为最主要引起易感人群过敏的环境变应原之一,可导致多种过敏性疾病,包括过敏性哮喘[3-4]。
迄今为止,过敏性疾病的发病机制及脱敏治疗的免疫耐受机制尚不完全清楚,而受包括伦理在内等因素限制,直接在患者体内进行相关研究还存在困难,因而建立变应原特异性过敏动物模型对于变应原的致敏机制探索、变应原制品开发及质量评价具有重要意义。小鼠过敏模型因具有与人类过敏反应相似的病理生理学特征,以及具有丰富的高质量免疫学检测试剂,目前常被用于变应原致敏机制研究。屋尘螨变应原提取物的蛋白组分非常复杂,其中相对分子质量为36 078.4的第1组变应原(Der.p1)被认为是屋尘螨变应原提取物中最重要的过敏蛋白[5-6],但文献报道所建立的尘螨变应原致敏小鼠模型均以变应原提取液的总蛋白定量,Der.p1在过敏动物模型的建立是否起关键作用,尚未见报道[7-10]。不同生产厂家的变应原提取物的蛋白组成差异非常大,利用这些组分差异较大的屋尘螨抗原所建立的动物模型间是否具有可比性,也未见研究报道。
Der.p1是屋尘螨变应原提取物中的关键成分,本研究目的旨在探索Der.p1剂量与屋尘螨过敏动物模型建立效果之间的关系。依据屋尘螨变应原提取物中Der.p1的含量设置免疫剂量、免疫次数,比较不同免疫程序对过敏小鼠模型建立效果的影响,并进一步比较不同来源屋尘螨变应原提取物对过敏动物模型建立效果的影响,为深入研究变应原的致敏机制及屋尘螨变应原特异性免疫治疗制剂临床前药理药效评价体系的建立奠定基础。
1 材料与方法
1.1 仪器试剂
ELISA酶标仪Spectra MaxI3,Molecular Devices公司产品;流式细胞计数仪 Guava eastCyte8HT,密理博公司产品;酶联斑点分析仪 Analyzer3,Thermo公司产品;6孔自动洗板机Wellwash Versa,Thermo公司产品。恒温培养箱RCO3000T,Thermo公司产品;流式细胞分析仪FACSCantoⅡ,BD公司产品。
屋尘螨变应原提取物A~C分别来自浙江我武生物科技股份有限公司、法国Stallergenes Greer公司、德国Allergopharma公司,上述3种提取物的总蛋白含量分别为为7.7、33.5、1.0 mg/mL,1组主要变应原(Der.p1)含量分别为17.0、11.5、32.0 μg/mL。Al(OH)3佐剂购自InvivoGen公司;HRP(horse radish peroxiduse,辣根过氧化物酶)标记的山羊抗小鼠IgE、IgG1、IgG2a购自Southern Biotech公司;HRP标记的小鼠IL-2、IL-4、IL-5、IFN-γ ELISPOT试剂盒购自Mabtech公司;小鼠淋巴细胞分离液购自北京达科为生物技术有限公司;Albumin Bovine V、双抗购自索莱宝公司;FBS购自GIBCO公司;RPMI1640培养基购自HyClone公司。
1.2 实验方法
1.2.1 屋尘螨变应原致敏小鼠模型建立
SPF级BALB/c小鼠,雌性,6~8周龄,购自中国食品药品检定研究院实验动物资源研究所,动物生产许可证:SYXK(京)2017-0005。所有动物实验和处理程序均由中国食品药品检定研究院动物伦理委员会批准。首先利用抗原进行致敏小鼠模型建立,实验分组及免疫程序见表1。3-20、3-100、3-200、3-500组于第0、7和14天皮下注射以Der.p1计不同浓度的A企业屋尘螨变应原提取物溶液100 μL;2-20、2-100、2-200、2-500组于第7和14天皮下注射以Der.p1计不同浓度的A企业屋尘螨变应原提取物溶液100 μL;1-20、1-100、1-200、1-500组于第14天皮下注射以Der.p1计不同浓度的A企业屋尘螨变应原提取物溶液100 μL。对照组设为3组,其中卵清蛋白(ovalbumin,OVA)免疫对照组于第0、7和14天皮下注射抗原浓度为20 μg/mL的OVA溶液100 μL;阴性对照组和空白激发组(屋尘螨抗原滴鼻激发组)于第0、7和14天皮下注射100 μL的生理盐水。致敏结束后,停息一周,从第22天开始所有实验模型组、OVA免疫组和空白激发组每天给予20 μL屋尘螨变应原提取物(Der.p1浓度为500 μg/mL)滴鼻激发,持续7 d;阴性对照组滴鼻20 μL生理盐水。
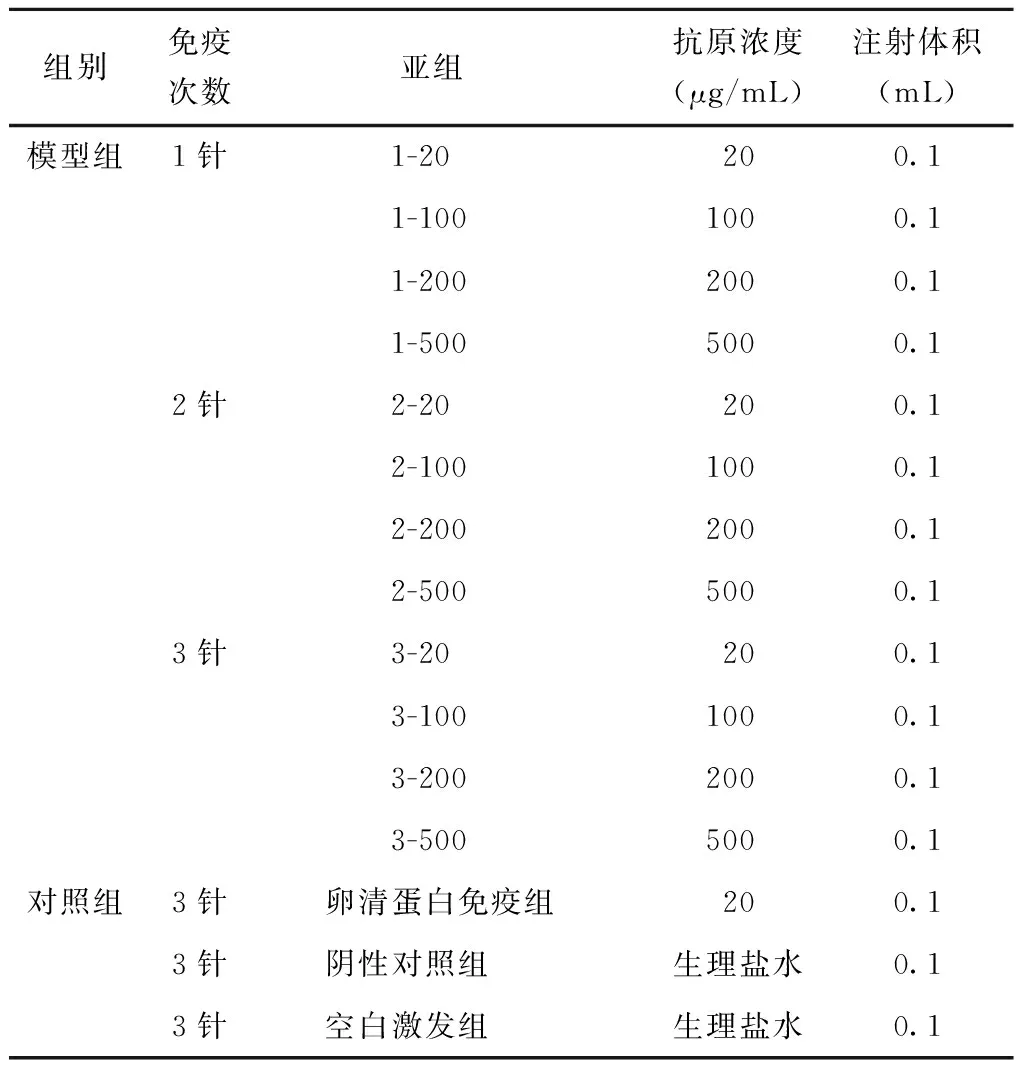
表1 实验动物分组Table 1 Group of experimental animals
1.2.2 体征观察和评分
每只小鼠滴鼻激发后,仔细观察并记录小鼠30 min内搔鼻、喷嚏次数和鼻分泌物量。小鼠体征评分标准参考文献[10],采用叠加量化计分法计分。
1.2.3 病理组织学观察
末次激发24 h,分离各组小鼠的鼻黏膜组织和肺组织,并用4%多聚甲醛溶液进行浸泡固定,置4 ℃环境过夜,石蜡包埋,进行常规石蜡切片,厚度约4 μm,用苏木精-伊红(hematoxylin-eosin,HE)染色,在光学显微镜下观察小鼠鼻黏膜组织嗜酸性粒细胞(EOS)等炎性细胞浸润和肺组织淋巴细胞及嗜酸性粒细胞浸润、水肿及支气管上皮损伤情况(NIKON CI-S,Nikon,Tokyo,Japan)。
1.2.4 细胞免疫学水平检测
1.2.4.1 ELISPOT检测IL-4和IFN-γ特异性淋巴细胞数量:末次激发后24 h,无菌条件下分离小鼠脾脏淋巴细胞,调整脾细胞浓度为2.5×106/mL,取出预包被IL-4和IFN-γ的检测用ELISPOT 96孔板,用无菌PBS洗5遍,200 μL/孔。加入含10% FBS的1640培养基,200 μL/孔,室温封闭至少30 min。弃培养基,依次向96孔板中加入细胞悬液100 μL/孔,Der.p1浓度为6 μg/mL的刺激物50 μL/孔。阴性对照孔:加入细胞悬液100 μL/孔,然后立即加入含10% FBS的1640培养基50 μL/孔;阳性对照孔:加入细胞悬液100 μL/孔,然后立即加入含ConA 1 μg/mL的阳性对照刺激物50 μL/孔,均做复孔。将96孔板置于5% CO2的37 ℃培养箱,培养12~48 h。弃掉细胞悬液,用PBS洗板5遍,200 μL/孔。用含0.5% FBS的PBS将检测抗体稀释至1 μg/mL,加入96孔板,100 μL/孔,室温孵育2 h。弃抗体溶液,用PBS洗板5遍,200μL/孔。用含0.5% FBS的PBS将HRP按1∶1 000稀释后加入96孔板,100 μL/孔,室温孵育1 h。弃HRP溶液,用PBS洗板5遍,200 μL/孔。加入TMB底物,100 μL/孔,显色至出现可区分的斑点。用去离子水冲洗以终止显色反应。自然风干后用ELISPOT读板仪计数。
1.2.4.2 流式细胞仪分析Th1和Th2细胞:在无菌条件下分离小鼠脾脏淋巴细胞,调整脾细胞浓度为1.0×106/mL,各管加入1.0×106个细胞在100 μL stain buffer反应体系内。各管加入适量荧光标记单克隆抗体:APC/FireTM750 anti-mouse CD3、FITC anti-mouse CD4、PerCP/Cy5.5 anti-mouse CD183 (CXCR3)、Brilliant Violet 421TManti-mouse CD194 (CCR4)、FITC anti-mouse Lineage Cocktail with Isotype Ctrl、APC/FireTM750 anti-mouse CD45、PerCP/Cy5.5 anti-mouse CD90.2 (Thy1.2)。使用FACS Calibur和FACS Canto Ⅱ系统分析样品。
1.2.5 ELISA检测血清抗体水平
对滴鼻激发前和滴鼻激发后24 h小鼠血清样本进行特异性IgE、IgG1、IgG2a抗体检测,方法如下: 屋尘螨抗原用pH 9.6碳酸盐缓冲液稀释成20 μg/mL的包被浓度,以100 μL/孔包被ELSIA板,4 ℃过夜。封闭后加入1∶50稀释的上述血清,37 ℃孵育1 h。依次加入1∶4 000稀释的特异性山羊抗小鼠二抗,用TMB显色测定血清样本的吸光度(A)值。滴鼻激发后的血样进行总IgE抗体水平检测,操作方法参见市售小鼠IgE检测试剂盒(Bethyl,State of Texas,USA)。
1.2.6 屋尘螨变应原致敏小鼠模型重复验证
分别利用屋尘螨变应原A~C进行屋尘螨致敏小鼠模型的构建,免疫抗原剂量参见表1中2-100组致敏程序,阴性对照组用生理盐水致敏,具体方法参见1.2.1。致敏后的小鼠通过症状观察、ELISPOT、Th1/Th2比值分析、血清特异性IgE抗体水平变化等指标变化(相关操作分别参见1.2.2、1.2.4、1.2.5),验证致敏模型过敏反应和免疫学评价的可重复性。
1.3 统计学分析
采用SPSS 22.0 统计学软件进行分析。数据符合正态分布的组间比较采用单因素方差分析;不满足正态分布和方差齐的数据,采用多组比较的非参数检验进行分析。P< 0.05为差异具有统计学意义。
2 结果
2.1 体征评分结果
各组小鼠屋尘螨变应原致敏后体外症状评分结果显示除空白激发组外所有模型组与阴性对照组相比均具有显著性差异(0.000 1≤P≤0.011),致敏成功;以Der.p1浓度为100 μg/mL的抗原免疫2针组(2-100组)与2-200、2-500、3-100、3-200、3-500等组比较症状无显著差异(0.099≤P≤1.00 0),但症状评分高于其他模型组(0.000 1≤P≤0.039)。OVA免疫组小鼠经屋尘螨抗原滴鼻后的症状评分虽与阴性对照组有差异(P=0.01 1),但评分低于各屋尘螨过敏模型组(表2)。表明本研究所建立的屋尘螨致敏小鼠模型具有较好的抗原特异性。

表2 屋尘螨抗原激发后各组小鼠症状评分Table 2 Comparison scores of in vitro after excitation of dust mite allergens(n=6)
2.2 病理组织学变化
2.2.1 小鼠鼻黏膜组织形态学变化
正常组小鼠鼻黏膜上皮细胞排列整齐,纤毛完整,黏膜下层缺少炎性细胞积聚,鼻腔黏膜的腺体增生不明显。OVA组(OVA免疫、屋尘螨抗原滴鼻激发)、空白激发组(用生理盐水进行皮下注射免疫,仅用屋尘螨变应原进行滴鼻激发7 d)和屋尘螨抗原免疫1针模型组小鼠鼻黏膜均无显著炎性症状。免疫2针模型组中2-100、2-200组和免疫3针模型组中3-100、3-200组小鼠鼻黏膜可见少量黏膜上皮脱失,黏膜下可见较多淋巴细胞,吞噬细胞浸润,鼻腔可见炎性渗出物,过敏炎症程度较明显。免疫2针模型组中2-20组鼻腔中有少量黏膜脱落,2-500组有少量黏膜细胞脱落和炎性细胞浸润。免疫3针模型组中 3-20和3-500组有少量黏膜细胞脱落(图1)。

图 1 各组过敏小鼠鼻黏膜病理形态学(HE staining,×40)(n=6)
2.2.2 小鼠肺组织形态学变化
正常组小鼠肺组织支气管管腔光滑、上皮完整、气道黏膜无水肿,肺泡间隔正常。OVA组、空白激发组和屋尘螨抗原免疫1针模型组小鼠肺组织均无显著炎性症状。免疫2针模型组中2-100、2-200和免疫3针模型组中3-100组小鼠细支气管周围炎细胞浸润,可见嗜中性粒细胞、淋巴细胞、巨噬细胞;细支气管黏膜纤毛柱状上皮有脱落,管腔内可见黏液渗出物。其他免疫2针和免疫3针组肺组织结构基本正常(图2)。

图 2 各组致敏小鼠肺组织病理形态学(HE staining,×40)(n=6)
2.3 细胞免疫学水平检测结果
采用ELISPOT技术检测末次滴鼻激发24 h后小鼠脾淋巴细胞的变化,结果显示经含Der.p1 2 μg/mL屋尘螨抗原刺激后,除1-20致敏组外,其余各模型组小鼠脾细胞分泌抗原特异性IL-4淋巴细胞数量与对照组比较均显著增加(0.011≤P≤0.046),其中2-100组与2-200组小鼠脾细胞中抗原特异性IL-4增长最显著(P分别为0.011和0.014),但这两者组间比较差异无显著性(P=1.000)。单纯用屋尘螨抗原激发的空白激发组及OVA免疫而屋尘螨滴鼻激发的OVA组与阴性对照组比较,屋尘螨抗原特异性IL-4淋巴细胞均未出现显著增高(P值分别为0.497和0.312)(图3A)。实验组小鼠脾组织淋巴细胞在Der.p1抗原刺激下未检测到特异性IFN-γ淋巴细胞显著升高(图3B)。
进一步利用流式细胞术检测屋尘螨变应原致敏小鼠脾淋巴细胞的Th1/Th2细胞分型,结果显示免疫3针模型组小鼠与阴性对照组比较脾组织中淋巴细胞明显向Th2型细胞极化,Th1/Th2细胞比例降低最显著(P=0.01);免疫2针模型组小鼠脾淋巴细胞与阴性对照组比较也出现淋巴细胞向Th2型的极化(0.012≤P≤0.047);免疫1针模型组小鼠脾淋巴细胞与阴性对照组比较未出现向Th2型淋巴细胞的明显极化(图3C)(0.961≤P≤1.000)。

图 3 致敏小鼠细胞免疫水平(n=6)Fig 3 Cellular immunity level in allergic mice(n=6)A:致敏小鼠抗原特异性IL-4型淋巴细胞检测结果;B:致敏小鼠抗原特异性IFN-γ淋巴细胞检测结果;C:致敏小鼠CXCR3+%/CCR4+%(Th1/Th2)淋巴细胞分型检测结果;IL-4:抗原特异性IL-4型淋巴细胞;INF-γ:抗原特异性γ干扰素型细胞;CXCR3+/CCR4+(Th1/Th2):Th1型免疫细胞与Th2型免疫细胞比值;Control:对照;OVA:卵清蛋白;Blank excitation:空白激发;模型组与阴性对照组比较,*P<0.05,**P<0.01;实验组与2-100组比较,#P<0.05
2.4 体液免疫水平检测结果
应用ELISA法检测各组小鼠激发前与激发后血清中Der.p1特异性IgE、IgG1与IgG2a抗体水平和激发后小鼠的总IgE水平。检测结果发现2-100、2-200、3-20和3-100四组小鼠经屋尘螨抗原激发后血清中特异性IgE增长显著,与激发前比较差异有统计学意义(P值分别为0.00017、0.003、0.01、0.01)(图4A)。2-200组模型小鼠的总IgE值与2-100、2-500、3-20、3-100组无显著差异(P>0.05),但显著大于其他实验组(图4B)(0.004≤P≤0.045)。此外,除1-20和1-100两个实验组外,其余实验组激发前与激发后的IgG1的OD值均有显著性差异,其中2-100、2-500组和3-500组的增长显著高于其他实验组(图4C)(P值分别为0.01、0.008、0.008),但这3组间差异均无统计学意义。各模型组激发前后的IgG2a的OD值变化差异不大,与阴性对照组差异无统计学意义。

图 4 致敏小鼠体液免疫水平(n=6)Fig 4 Humoral immunity level in allergic mice(n=6)A:致敏小鼠血清抗原特异IgE检测结果;B:致敏小鼠血清抗总IgE检测结果;C:致敏小鼠血清抗原特异IgG1检测结果;Blank excitation:空白激发;OVA:卵清蛋白;Control:对照;IgE:抗原特异性IgE抗体;Total IgE:总IgE抗体;IgG1:抗原特异性IgG1抗体;Senstized:致敏组;Challernged:抗原激发组;激发前与激发后比较,*P<0.05,**P<0.01; 实验组与2-200组比较,aP<0.05,aaP<0.01
2.5 屋尘螨致敏小鼠鼻炎模型建立方法的可重复性
在前期模型优化结果的基础上,选择3种不同来源的屋尘螨变应原提取物,依据Der.p1浓度,选择2-100致敏程序进行致敏小鼠模型的建立,进一步观察不同来源蛋白致敏后小鼠的症状评分、IL-4特异性淋巴细胞变化、血清特异性IgE抗体水平变化、Th1/Th2细胞分型。结果表明虽然不同来源的屋尘螨提取物蛋白组分差异较大,但依据Der.p1含量进行过敏小鼠模型建立,所建立致敏小鼠模型的各项评价指标基本一致,3种不同来源屋尘螨变应原致敏小鼠的体外特征评分结果基本一致(图5A),且与阴性对照组相比均有显著性差异(P值分别为0.003、0.003、0.002);3种不同来源屋尘螨变应原致敏后小鼠脾淋巴细胞抗原特异性IL-4数量与阴性对照组相比均增加(P值分别为0.002、0.005、0.005)(图5B);ELISA数据显示各实验组血清特异性IgE水平基本一致,与阴性对照组相比具有显著性差异(P值分别为0.004、0.003、0.003)(图5C);流式细胞结果分析各实验组小鼠脾组织中Th1/Th2细胞比例出现严重失衡现象,偏向Th2型细胞,极化程度较阴性对照组显著降低(P值分别为0.02、0.03、0.03)(图5D)。

图 5 3种不同来源屋尘螨抗原所建立致敏小鼠的过敏反应及免疫学评价比较(n=6)
3 讨论
过敏性疾病已成为全球性的公共卫生问题,其流行程度呈逐年上升趋势。采用变应原制剂进行特异性免疫治疗是过敏性疾病的唯一对因治疗方式,但迄今为止,过敏性疾病的发病机制和免疫治疗的耐受机制均不清楚,且尚未建立有效的疗效评价用生物标记物等现状严重阻碍了特异性免疫治疗制剂的开发。建立适宜的致敏动物模型对于变应原的致敏机制的探索以及变应原制品的临床前评价研究具有重要意义。
尘螨变应原是最重要的一类环境变应原,在亚洲、欧洲、北美等人口稠密地区,高达85%的哮喘患者对屋尘螨过敏[4]。尘螨变应原组分复杂,目前已至少鉴定出34种具有致敏活性的变应原蛋白,其中Der.p1是目前公认的引起人体过敏性疾病的最重要的变应原组分[5-6,11-12]。迄今为止,尘螨变应原类制品均是以纯化的螨虫培养物为原材料制备而成,除了上述Der.p1主要变应原外还含有很多其他的非致敏蛋白,不同企业制备的屋尘螨变应原提取物抗原组成差异非常大[5,13-15],为了加强对这类制品的质量控制,欧洲及中国的药典都将Der.p1的含量作为屋尘螨变应原体内诊断制剂及脱敏治疗制剂质量控制的一项关键参数[16-17]。但是目前文献报道的屋尘螨过敏小鼠模型都没有说明关键变应原活性组分与致敏症状之间的关系[10,18]。本研究探索主要变应原Der.p1在过敏小鼠模型建立中的作用,观察到屋尘螨1组主要变应原剂量与致敏效果间的量效关系,Der.p1的剂量是屋尘螨过敏小鼠模型建立的重要影响因素,以Der.p1含量为100~200 μg/mL的屋尘螨变应原皮下注射免疫BALB/c小鼠,注射体积为0.1 mL/小鼠,免疫2~3次,并以Der.p1含量为10 μg的屋尘螨抗原滴鼻激发,小鼠的过敏症状评分、病理结果、特异性IgE、总IgE、抗原特异性IL-4型淋巴细胞等变化均比较显著。病理检测结果显示本研究采用的致敏程序均能使过敏小鼠产生较明显鼻部炎性反应,其中2-100、2-200和3-100三组动物的过敏性鼻炎症状尤为显著,而这3组动物的肺部也有明显的炎性细胞浸润,由此推测重度过敏性鼻炎存在可发展成肺部炎性反应的可能性,但本研究尚未对实验小鼠开展深入的过敏性哮喘病理特征的评价,未来研究还需要进一步探索建立过敏性哮喘动物模型的最佳致敏程序。鉴于免疫2针的2-100组经抗原激发后特异性IgE与抗原滴鼻激发前比较升高最显著,本研究进一步依据Der.p1剂量,采用2-100组免疫程序,利用总蛋白含量差异较大的3种不同来源屋尘螨变应原提取物进行屋尘螨过敏小鼠模型的建立,所建立的屋尘螨过敏小鼠模型具有较好的可重现性。
已报道的过敏小鼠模型建立方法较多,包括直接利用抗原滴鼻激发进行过敏模型建立[19],以及采用皮下或腹腔注射免疫与变应原滴鼻激发相结合的方式进行过敏小鼠模型建立[20]。本研究发现皮下注射免疫与滴鼻激发相结合的方法仅需要3周时间即可成功建立过敏小鼠模型,过敏小鼠不仅产生明显的生理和病理反应,特异性IgE抗体水平和抗原特异性IL-4型淋巴细胞水平也均显著高于单纯屋尘螨抗原滴鼻激发组小鼠。
在过敏性疾病的发生过程中CD4+T细胞起重要作用。CD4+T细胞在抗原刺激下可以分化成两个亚群,即Th1和Th2,正常情况下,Th1和Th2型细胞处于相对平衡状态。过敏性疾病存在Th1/Th2向Th2细胞免疫偏移,Th2型免疫反应过强[21-24]。本研究发现屋尘螨致敏后小鼠出现不同程度的Th1/Th2比值下降,与文献报道一致。值得注意的是屋尘螨变应原免疫3针的各组小鼠Th1/Th2失衡严重程度高于免疫1针的各组小鼠,同时OVA免疫3针小鼠的Th1/Th2比值也出现严重失衡,提示变应原具有导致机体免疫反应偏向Th2发展的属性,采用变应原进行多次皮下注射免疫可快速导致Th1/Th2失衡,是建立变应原致敏小鼠模型的一个重要程序。
本研究通过ELISPOT技术检测到屋尘螨过敏小鼠脾脏淋巴细胞在屋尘螨抗原刺激下分泌IL-4淋巴细胞数量显著升高,IFN-γ性淋巴细胞数量在过敏小鼠内基本不能被诱导增生,进一步证实过敏反应会导致Th1和Th2型细胞失衡。Th2细胞被激活后会导致IL-4等细胞因子的分泌增加,介导B细胞分化成浆细胞并诱导其产生IgG1和IgE[25],本研究在过敏小鼠血清中同时检测到这两种抗体水平的升高,与文献报道的结果一致。目前IgG4被广泛认为是人体内的阻断抗体,其抗体水平与过敏症状呈负相关,而小鼠IgG2a抗体被认为是人IgG4抗体的功能等同物[26],二者可能是人和小鼠对变应原免疫耐受的生物标志[27]。本研究所用的致敏程序均未导致IgG2a升高,因而可推测上述致敏程序导致屋尘螨过敏小鼠出现免疫耐受的风险均不高。本研究发现2-100和2-200两个过敏组小鼠抗原特异性IL-4型淋巴细胞增生最显著,相应的这两个致敏组小鼠的总IgE和特异性IgE抗体水平的升高也比较显著,根据IL-4型淋巴细胞的变化与IgE抗体水平的一致性,初步推论利用ELISPOT技术检测特异性IL-4淋巴细胞数量的变化未作为过敏性疾病评价另一重要指标,今后的研究需进一步积累数据进行验证。
本研究成功建立了一种稳定的屋尘螨变应原致敏小鼠鼻炎模型,筛选了致敏相关的生物标识,为进一步研究螨变应原制品的脱敏治疗筛选有效生物考核指标奠定了基础。本研究不足之处,仅聚焦屋尘螨致敏小鼠模型中特异性IL-4和IFN-γ淋巴细胞数量的变化,在后续研究中应探索研究更多细胞活性因子在屋尘螨致敏过程中变化特征。

