基于网络药理学与分子对接探讨羟氯喹治疗干燥综合征的分子机制
韩婷, 吴锐
干燥综合征(Sjogren’s syndrome,pSS)是一种侵犯外分泌腺体尤以侵犯唾液腺和泪腺为主的慢性自身免疫性疾病,又名自身免疫性外分泌腺体上皮细胞炎或自身免疫性外分泌病,临床表现复杂,目前西医治疗方法主要包括局部治疗及对症治疗,系统受累时可予以糖皮质激素联合免疫抑制剂治疗。硫酸羟氯喹(hydroxychloroquine sulfate,羟氯喹)作为pSS的常用药物,证据等级仍缺乏[1-2],羟氯喹具有抗炎/免疫调节、抗疟、抗病毒、抗菌等多种药理学作用,然而其具体作用机制尚不完全清楚。羟氯喹相比于氯喹,多一个羟基基团,而且水溶性更好,并且在保留原有氯喹药效的同时,其毒副作用显著下降[3]。羟氯喹在临床上多应用于治疗自身免疫性疾病,如系统性红斑狼疮(systemic lupus erythematosus,SLE)、类风湿关节炎(rheumatoid arthritis,RA)、抗磷脂综合征(antiphospholipid syndrome,APS)等,羟氯喹治疗SLE和RA的疗效已经得到广泛认可,但其治疗pSS的疗效存在争议。
近年来,伴随着生物信息学、系统生物学以及药理学的飞速发展,可以认为基于网络药理学的药物发现和评价是探究更能获益的药物的一种有前景的方式[4]。网络药理学是一种基于“疾病-基因-靶点-药物”概念而言的一种交互式网络,是从系统及更全面的角度上看待药物对疾病网络的干预和作用,以探索药物对人体作用的复杂机制。网络分析目的在于通过提取目标或目标组合、药物或药物组合找到关键目标、生物活性化合物以及代谢途径[5]。本研究运用网络药理学的方法评估羟氯喹对pSS患者的潜在靶点,其结果可能有助于进一步证明羟氯喹对pSS的有效性,并促进新药的开发。
1 资料与方法
1.1 化合物成分收集与筛选
在pharmmapper数据库中检索羟氯喹的化学成分信息,可以获取其2D及3D结构,从而可预测羟氯喹的活性成分靶标,设定物种为人类,以z′-score>0作为筛选条件选取置信度较高的结果作为目标靶点。筛选条件设置为药物口服生物利用度(oral bioavailability,OB)≥30%,药物相似性(draglikeness,DL)≥0.18[6-7]。
1.2 pSS发病靶点检索及羟氯喹作用于pSS相关靶点预测
以“Sjogren’s syndrome”作为关键词,通过GeneCards(https://www.genecards.org/)、OMIM(https://www.omim.org/)、Drugbank(https://www.drugbank.com/)与TTD(http://db.idrblab. net/ttd/)数据库,从中检索并筛选出与pSS疾病相关的作用基因。通过UniProt数据库(https://www.uniprot.org/uniprot)将2.1项中所获得的药物作用靶标转化为与GeneCard数据库相匹配的基因名称(genename)。最后,将羟氯喹活性成分的靶点预测结果和pSS相关靶标的检索结果进行匹配,并选择重叠靶点作为羟氯喹治疗pSS的核心靶点。利用Venny2.1(https://bioinfogp.cnb. csic. es/tools/venny/index.html)进行羟氯喹活性成分靶点和pSS靶点的映射,并绘制韦恩图(图1)。

图 1 羟氯喹与pSS靶标的韦恩图Fig 1 Venn diagram of hydroxychloroquine and Sjogren’s syndrome targets
1.3 药物活性成分与疾病作用靶点网络构建
将上述筛选羟氯喹的分子靶点和pSS相关的靶点结果一起导入CytoScape Version3.7.1软件[8],构建羟氯喹靶点与pSS靶点网络。构建的网络节点(node)代表靶点或者是药物活性成分。CytoScape软件的中心架构是网络,每个节点代表的是基因、蛋白质或分子,节点与节点之间的连接代表这些生物分子之间的相互作用。
1.4 蛋白-蛋白相互作用(PPI)网络构建与核心基因筛选
将羟氯喹的分子靶点导入String数据库(https://string-db.org/),物种限定Homo sapiens,置信度为0.7,进行PPI网络分析,绘制出PPI网络图。将该PPI网络图导入CytoScape Version3.7.1软件进行分析。PPI网络连线的粗细代表互相作用的强弱,靶点的度值反映1个节点与其他节点的连接数目,度值越大代表此节点与其他节点的关系更紧密,在网络中地位越重要。对度值按降序进行排序,筛选出序号前20的靶点为关键靶点,借助R project软件绘制条形图,显示相关基因名与其连接节点数目。
1.5 羟氯喹治疗pSS预测靶点富集分析
先利用RStudio对核心靶点进行基因本体(GO)功能富集分析(molecular function,MF;biological process,BP;cellular component,CC)及基因组百科全书(KEGG)通路富集分析。在程序语言中,以P<0.05作为筛选条件获得靶点蛋白进行GO功能富集分析及KEGG通路富集分析,下载富集排名前20名通路。
1.6 分子对接
从Protein Data Bank数据库(http://www1. rcsb. org/)下载靶标蛋白质的晶体结构,利用AutoDock Tools将蛋白质晶体和原始配体分离,并对蛋白晶体结构进行加氢,去除水分子和计算电荷的处理,最后计算对接盒子的大小和中心后将蛋白质晶体结构导出PDBQT格式。将从pharmmapper下载的羟氯喹3D结构利用AutoDock Tools转化为PDBQT格式用于对接。利用AutoDock vina将羟氯喹依次与关键蛋白进行对接,并利用PyMol对接结合模式进行分析。用pymol对蛋白进行加氢、去除水分子以及提取小分子配体的预处理。通过AutoGrid进行能量格点计算,并通过AutoDock进行小分子与蛋白对接,对每个对接进行Binding Energy(对接能量)评分。使用pymol进行可视化。
2 结果
2.1 羟氯喹的预测目标及其网络
羟氯喹的潜在目标是根据二维和三维化学结构在pharmmapper数据库中获取。
2.2 羟氯喹活性成分靶点库与SS作用靶点集的构建
检索pharmmapper数据库中成分靶点,其收录羟氯喹中成分作用靶点共299个。通过GeneCards、OMIM、Dragbank及TTD数据库分别检索到974、338、45、11个pSS相关基因靶点。将279个活性药物靶点与1169个pSS相关靶点基因进行映射,将数据导入CytoScape Version3.7.1软件,构建药物靶点-疾病靶点交集网络,得到31个共同靶点基因(图2、3)。将药物活性成分与pSS靶点通过CytoScape 3.7.2建立羟氯喹成分靶点-pSS靶点群网络,得出羟氯喹靶点-pSS网络主要由31个节点组成,其中三角形节点红色表示药物羟氯喹,倒三角形绿色表示疾病pSS,矩形紫色节点表示羟氯喹可能是通过这些基因治疗pSS。

图 2 羟氯喹与pSS靶标网络群
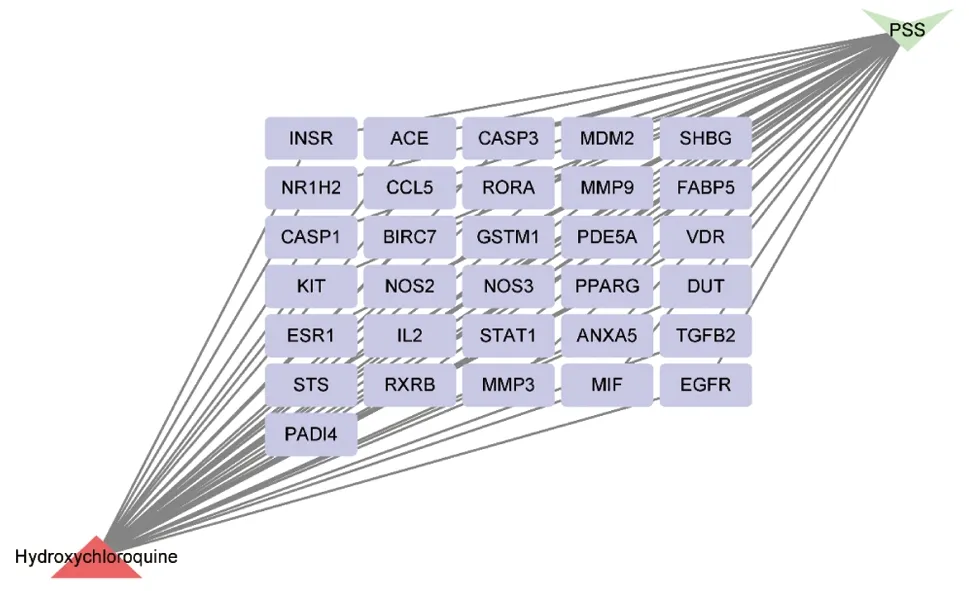
图 3 羟氯喹治疗pSS靶标网络图Fig 3 Target network of hydroxychloroquine in the treatment of Sjogren’s syndromeINSR:胰岛素受体;ACE:血管紧张素转化酶;CASP3:胱天蛋白酶3;MDM2:癌基因;SHBG:性激素结合球蛋白;NR1H2:核受体亚家族;CCL5:趋化因子配体5;RORA:视黄酸受体相关孤儿受体;MMP9:基质金属蛋白酶 9;FABP5:表皮型脂肪酸结合蛋白5;CASP1:胱天蛋白酶1;BIRC7:细胞凋亡抑制因子;GSTM1:谷胱甘肽硫转移酶M1;PDE5A:磷酸二酯酶5A;VDR:维生素D受体;KIT:原癌基因;NOS2:一氧化氮合酶2;NOS3:一氧化氮合酶3;PPARG:过氧化物酶体增生激活受体;DUT:脱氧尿苷三磷酸酶;ESR1:雌激素受体1;IL2:白细胞介素-2;STAT1:信号转导与转录激活子1;ANXA5:膜联蛋白A5;TGFB2:转化生长因子β2;STS:类固醇硫酸酯酶同工酶S;RXRB:类视黄醇X受体;MMP3:基质金属蛋白酶 3;MIF:巨噬细胞迁移抑制因子;EGFR:表皮细胞生长因子受体;PADI4:肽酰基精氨酸脱亚胺酶
2.3 靶点PPI网络、关键基因分析
将羟氯喹可能治疗pSS的31个关键靶标导入STRING数据库,获取其相互作用关系并保存PPI网络图与TSV格式文件(图4)。PPI网络中共包含节点31个。在PPI网络中,度值较高即处于较为核心位置的靶点包括胱天蛋白酶caspase-3(CASP3)、表皮细胞生长因子受体(EGFR)、基质金属蛋白酶 9(MMP-9)、白细胞介素-2(IL2)等。利用R软件绘制条形图,展示了PPI网络中度值中心性较高的前20位的靶点(图5)。

图 4 羟氯喹与pSS共有靶标的PPI网络Fig 4 Protein-protein interaction network of hydroxychloroquine Sjogren’s syndrome co-targetsNR1H2:核受体亚家族;PDE5A:磷酸二酯酶5A;MIF:巨噬细胞迁移抑制因子;MDM2:癌基因;VDR:维生素D受体;MMP3:基质金属蛋白酶 3;KIT:原癌基因;CASP1:胱天蛋白酶1;NOS3:一氧化氮合酶3;NOS2:一氧化氮合酶2;CCL5:趋化因子配体5;ACE:血管紧张素转化酶; PPARG:过氧化物酶体增生激活受体;ESR1:雌激素受体1;STAT1:信号转导与转录激活子1;ANXA5:膜联蛋白A5;IL2:白细胞介素-2;EGFR:表皮细胞生长因子受体;MMP9:基质金属蛋白酶 9;CASP3:胱天蛋白酶3

图 5 PPI网络中排名前20的关键靶标Fig 5 Top 20 key targets in PPI networkNR1H2:核受体亚家族;PDE5A:磷酸二酯酶5A;MIF:巨噬细胞迁移抑制因子;MDM2:癌基因;VDR:维生素D受体;MMP3:基质金属蛋白酶 3;KIT:原癌基因;CASP1:胱天蛋白酶1;NOS3:一氧化氮合酶3;NOS2:一氧化氮合酶2;CCL5:趋化因子配体5;ACE:血管紧张素转化酶; PPARG:过氧化物酶体增生激活受体;ESR1:雌激素受体1;STAT1:信号转导与转录激活子1;ANXA5:膜联蛋白A5;IL2:白细胞介素-2;EGFR:表皮细胞生长因子受体;MMP9:基质金属蛋白酶 9;CASP3:胱天蛋白酶3
2.4 GO生物过程分析
利用R语言程序包DOSE、ClusterProfiler及enrichplot对核心靶点进行GO功能富集(MF,BP,CC)及KEGG通路富集。根据错误发现率(FDR) < 0.05 筛选出1316个GO生物过程。其中炎症反应调节、肌肉细胞增殖、平滑肌细胞增殖的调节、平滑肌细胞增殖、节律过程、生殖结构发育、生殖系统发育、小分子代谢过程调节、对活性氧的反应等位于GO生物过程富集的前面(图 6)。

图 6 GO功能富集分析柱状图
2.5 KEGG信号通路分析
通过R语言程序包DOSE、ClusterProfiler、enrichplot及pathview将羟氯喹的31个靶基因在KEGG信号通路中富集,根据FDR<0.05筛选出与pSS密切相关的信号通路,分析结果显示,共富集在73条通路上,包括Chagas病、弓形虫病、癌症中的蛋白聚糖、炎症性肠病、冠状病毒疾病-COVID-19、小细胞肺癌、前列腺癌、内分泌抵抗、肺结核、AGE-RAGE信号通路在糖尿病并发症中的作用等信号通路(图7)。羟氯喹可能主要通过调节以上关键基因,影响此类信号通路发挥治疗pSS的作用。

图 7 羟氯喹治疗pSS关键靶标KEGG富集柱状图
2.6 分子对接分析
找到核心靶点,通过“network.txt”找到相对应的小分子配体,利用PubChem数据库搜索小分子配体的2D结构,下载小分子配体2D结构,再通过chemBio得到小分子配体3D结构。用uniprot数据库搜索基因对应的蛋白,CASP3、MMP9、EGFR、IL2分别对应P42574、P14780、P00533、P01590,再在RCSB.PDB数据库(https://www.rcsb.org/)分别搜索以上蛋白,从而获取各基因对应蛋白的三维结构。用AutoTools对蛋白进行加氢、去除水分子以及去除小分子配体的预处理。通过AutoGrid进行能量格点计算,并通过Autodock进行小分子与蛋白对接,对每个对接进行Binding Energy(对接能量)评分。使用pymol进行可视化。分子对接结果提示,羟氯喹的活性成分与pSS部分关键靶点蛋白的对接吻合度未见明显差异(图8)。

图 8 羟氯喹与靶标蛋白分子对接
3 讨论
pSS是一种全身性、慢性炎症性自身免疫性疾病,这种疾病主要累及到患者的外分泌腺体,临床上经常会出现各种分泌腺体损害,造成的多器官受累,从而出现多系统损害的症状[9]。pSS属于一种全球性疾病,通过流行病学调查研究发现,pSS在我国人群中的患病率为0.33%~0.77%,是最常见的中老年人自身免疫性结缔组织病,尤其以女性多见[10]。
羟氯喹是一种多靶点抗疟药,广泛应用于风湿免疫科。研究表明,羟氯喹为干燥综合征系统受累时常用的免疫抑制剂,能够改善患者口眼干燥以及降低免疫球蛋白IgG水平等,但更为确切的治疗靶点及相关的通路尚不清楚,缺乏相关层面的研究。抗疟药物具有许多生物效应,这些效应是其免疫调节作用的原因。羟氯喹在进入人体之后,其中50%经肝脏代谢,40%~50%通过肾脏排泄,而16%~21%以原型从尿中排泄。羟氯喹经肝脏代谢酶CYP2D6、CYP2C8、CYP3A4和CYP3A5等代谢,主要代谢产物包括N-去乙基羟氯喹(N-desethylhydroxychloroquine)、脱乙基氯喹(desethylchloroquine)、双去乙基羟氯喹(bisdesethylchloro-quine)等,其中N-脱乙基羟氯喹是主要活性代谢产物。羟氯喹在人体内的半衰期为40~60 d[11]。
根据网络药理学结果,从pSS与羟氯喹的共同靶点看,pSS与羟氯喹的活性成分-潜在靶点网络中包含31个靶点,其中度值较大的有CASP3、MMP9、EGFR、IL2等,推测CASP3、MMP9、EGFR和IL2在羟氯喹治疗干燥综合征中起着重要作用。
研究表明,pSS患者亚群中溶酶体相关膜蛋白3(LAMP3/CD208/DC-LAMP)表达增加,而LAMP3表达诱导蛋白酶caspase-3(CASP3)活性激活,并导致转染细胞的凋亡[12]。根据本网络药理学分析,羟氯喹与CASP3的结合可能在抑制LAMP3过程中发挥重要作用。SS唾液中含有较高浓度的基质金属蛋白酶 9(MMP-9),其局部MMP-9高活性与腺体结构和功能损伤相关,且MMP-9可能在腺体破坏和腺体功能障碍的发展中起作用[13]。在干燥综合征患者中,MMP-9表达和活性增加,导致基底膜破坏,进而SS唾液腺的腺泡结构也遭到破坏[14]。Ertugrul等[15]发现使用羟氯喹治疗的患者与未治疗的患者相比MMP-9水平升高,而Lesiak等[16]和Lim等[17]研究表明羟氯喹可以抑制MMP-9的表达,本研究结果也提示羟氯喹可以通过抑制MMP-9表达,从而对pSS发挥作用。关于羟氯喹调节MMP活性水平的机制还有待进一步探讨。
表皮细胞生长因子受体(EGFR)是一种广泛分布于上皮细胞的跨膜糖蛋白,可结合多种配体,主要包括表皮生长因子(EGF)和转化生长因子α(TGF-α)。有研究发现,通过镜下观察经皮下注射EGF的小鼠,随着时间的延长,可见小鼠舌上皮细胞生长呈增生现象, 细胞层增加, 基底层细胞增生活跃, 细胞体积增大,可见到较多的细胞分裂相以及较多的由基底层细胞分化而来的棘层细胞。上述细胞生长现象和正常小鼠相比较有较大的差异[18]。在pSS患者的人唾液腺腺泡和导管细胞中检测到的这种EGFR配体与健康对照组相比显著增加。重要的是,越来越多的证据提示,EGFR途径对上皮细胞的炎症及免疫反应有比较重要的影响。本研究中羟氯喹显示出与EGFR的强大对接能力,这可能是治疗pSS的机制之一,抑制EGFR可能成为pSS治疗的未来方向。
白细胞介素-2(IL-2)通过对调节性T细胞(Treg)以及对效应淋巴细胞反应的作用,调节Th1和Th2分化,抑制Th17和滤泡辅助性T细胞(TFH)活性,从而在免疫稳态过程中发挥重要作用[19]。由于这些特性,低剂量IL-2免疫疗法已被用于治疗自身免疫和慢性炎症性疾病。部分研究表明,低剂量IL-2可以通过调高Treg细胞比例、恢复Th17/Treg的比例,从而诱导和恢复自身免疫耐受,有利于控制包括pSS在内的自身免疫性疾病的进展,并且通过抑制pSS相关抗体的表达,而减轻自身抗体引起的炎症反应[20-22]。而王梅等[23]研究发现羟氯喹可提升患者血清中IL-2水平,从而对患者起到治疗作用。综上所述,若通过羟氯喹对CASP3、MMP9、EGFR、IL2等进行干预,可对PSS患者的治疗和预后起到积极的促进作用。
本研究涉及1 376个蛋白质的四个关键靶点(CASP3、MMP9、EGFR和IL2)共同成为羟氯喹治疗干燥综合征的多靶点机制。它们丰富了抑制免疫反应、负调节基因表达和调节免疫系统过程的功能。本研究通过网络药理学阐述了羟氯喹治疗干燥综合征的多靶点机制。首先,预测了羟氯喹的靶点,并从数据库中寻找干燥综合征的相关基因。然后,羟氯喹和pSS之间的31个交叉点被返回。与这31个靶点相关的扩展PPI网络由CytoScape进行。最后,筛选基于分数的前20个目标,选择前几位进行分子对接验证。CASP3、MMP9、EGFR和IL2可能是羟氯喹治疗pSS的关键靶点。有趣的是,羟氯喹在不同免疫疾病中的目标不同。例如,根据目前的研究,羟氯喹对慢性自发性荨麻疹的疗效主要与组胺H2受体、5-羟色胺2a受体、组胺N-甲基转移酶和维生素D3受体有关。本研究将网络药理学的新概念引入到多靶点药物治疗不同疾病的多靶点药物临床治疗中,有利于探索和评价临床上对自身免疫性疾病治疗有效但机制尚不十分清楚的多靶点药物。此外,还可以为相关科研提供用药说明和指导。

